过表达玉米ZmSC1基因增强转基因拟南芥的耐盐性
2022-11-24陈逸蓉刘雨晴李爱琪武健东
王 龙,陈逸蓉,于 伟,刘雨晴,李爱琪,武健东
过表达玉米基因增强转基因拟南芥的耐盐性
王 龙,陈逸蓉,于 伟,刘雨晴,李爱琪,武健东*
(安徽农业大学作物抗逆育种与减灾国家地方联合工程实验室,合肥 230036)
旨在从玉米中克隆耐盐相关基因,分析其分子特征并在拟南芥中研究其耐盐性的生物学功能。以玉米B73为试验材料,克隆全长序列,与其他物种进行同源性比对,解析其盐诱导表达模式和亚细胞定位情况,将转入到拟南芥突变体和野生型中,观察在盐处理下种子萌发率和主根根长情况,利用荧光定量PCR分析相关逆境(140 mmol·L-1胁迫)基因的表达量。结果表明,基因全长为423 bp,编码141个氨基酸,ZmSC1和小麦、拟南芥中已知的TaSC1、AtSC1具有较高保守性。烟草细胞瞬时表达、玉米原生质体亚细胞定位研究表明ZmSC1定位于细胞膜中。生物学功能研究发现在140 mmol·L-1的NaCl的盐处理下,相比较于拟南芥突变体,回补植株拟南芥的种子萌发率和主根根长得到了明显改善,这说明基因可以回补拟南芥同源基因突变体植株在盐胁迫下的表型。基因过表达拟南芥植株的种子萌发率和主根根长也显著高于野生型植株。荧光定量PCR结果显示相较于野生型,在过表达植株中、、、等胁迫相关基因的表达量也明显增强。研究结果表明、的同源基因对提高拟南芥的耐盐性具有重要作用。
玉米;基因;突变体; 过量表达;耐盐性
植物在生长过程中,常会受到各种非生物逆境的危害,从而影响植物的生长和发育。高盐作为非生物逆境中的一种主要胁迫,会引起植物产生渗透胁迫和离子胁迫,从而导致植物生长发育受到限制。同时,植物在长期生长过程中也进化出一系列调控蛋白和信号通路来适应高盐的影响,其中调控蛋白包括转录因子、分子伴侣、离子通道和转运蛋白[1]。如过表达玉米转录因子可以提高转基因植物的抗干旱和耐高盐能力[2];玉米中编码CBL结合蛋白激酶基因受到高盐和干旱的上调诱导表达[3]。
除了调控蛋白外,植物在盐胁迫下也会通过激活信号传导通路调控逆境响应基因的表达来提供防御,其中,对丝裂原激活蛋白激酶途径(mitogen- activated protein kinase pathway)、钙依赖型蛋白激酶途径(calcium-dependent protein kinase pathway)和盐敏感通路(salt overly sensitive pathway)的研究较为深入[4-5]。途径在植物生物和非生物胁迫反应中具有重要的调控作用[6],MAPK级联信号通路由3种丝氨酸/苏氨酸蛋白激酶所组成:分别为MAPKKK,MAPKK和MAPK,在玉米中具有74、6和19个成员。例如玉米在高盐胁迫下,种子会在基因的调控下储备渗透调节物质来缓解危害[7]。途径是通过激活应急蛋白的表达而参与到不同逆境途径中[8],如盐和干旱处理1 h后,拟南芥和基因的mRNA表达水平会明显升高[9];研究报道玉米中有40个CDPK家族编码基因,其中有12个参与到植物的非生物胁迫途径,分别参与到抗盐、高低温、干旱等逆境过程[10],如基因可以提高植物的耐盐性[11]。途径也是植物提高耐盐性的主要途径[12],SOS途径主要包含SOS3、SOS2和SOS1 共3个成员,在盐胁迫下SOS3和SOS2会形成蛋白激酶复合体从而磷酸化SOS1,SOS1是反向钠离子运输蛋白,被激活的SOS1可以降低植物内的Na+离子浓度从而达到耐盐的目的[13]。实际上植物对盐胁迫的防御是一个非常复杂的过程,研究者认为植物在受到高盐胁迫时,有多种机制共同参与到防御过程[14]。
玉米作为重要的粮食作物,其种植面积和产量已超过水稻,然而玉米的耐盐性较差,对NaCl的极限浓度为170 mmol·L-1[15]。因此挖掘耐盐相关基因并解析其功能具有重要的理论研究价值和实际应用意义,特别是随着玉米基因组序列的公布[16],使其在全基因组上进行大数据挖掘和分析成为可能。实验室前期通过转录组测序的方法分析玉米B73自交系在高盐处理下的基因表达情况,其中一个基因表达量明显提高,通过序列比对发现该基因同小麦基因同源性较高,因此该基因命名为。过表达基因可以显著提高转基因植株的耐盐性[17],然而基因的功能还鲜见报道。因此,本研究从玉米B73自交系中克隆了该基因,并对该基因的诱导表达模式和定位进行了分析,同时利用拟南芥同源基因突变体回补植株和过表达转基因植株对其功能进行了分析。此外,借助荧光定量PCR技术对基因在拟南芥中行使功能的可能作用途径进行初步分析,以期为后续研究该基因在玉米耐盐功能中所发挥的作用提供理论依据。
1 材料与方法
1.1 材料
拟南芥野生型(Col-0)、突变体(突变体号为SALK_072220,实验室已有材料)和转基因植株生长于温度22 ℃、光周期为16 h光照/8 h黑暗的人工温室中;烟草生长于实验室温室中,温度为25 ℃,光周期为16 h光照/8 h黑暗;玉米B73自交系生长于安徽农业大学校内温室中,温度为 28 ℃,光照强度1.5 mmol·s-1·m-2,光周期为 14 h 光照/10 h 黑暗。
1.2 方法
1.2.1 盐胁迫处理 当玉米生长至三叶期时期,选用150 mmol·L-1NaCl溶液进行浇灌模拟盐胁迫,分别于0、1、3、6和12 h后取叶片备用。
1.2.2 烟草瞬时表达分析、玉米原生质体瞬时表达分析 载体构建:利用Phytozome网站基因已知序列,结合Primer 5.0软件设计上下游引物,分别为5´- GACTAGTATGGAGAACCTTGCTCTG CTT-3´(加粗字体为I酶切位点),5´-GCTCT AGATTAATCTTCTGAGTGGCATGTCC-3´(加粗字体为I酶切位点),通过PCR方法把融合到pCAMBIA1305载体上(I和I双酶切),从而产生35S::GFP-ZmSC1融合载体,测序正确后,导入到农杆菌GV3101中备用。
亚细胞定位:选用6周生长良好的本氏烟烟草,将含有35S::GFP和35S::GFP-质粒的农杆菌注射烟草表皮细胞中,经过48 h暗培养后,置于蔡司LSM 710共聚焦荧光显微镜下观察拍照。
选玉米B73种子,经暗处理萌发10 d,培养成黄化苗(二叶期),将连接好的35S::GFP-质粒导入经酶解提纯后玉米原生质体中,经过48 h暗培养后,置于蔡司LSM 710共聚焦荧光显微镜下观察拍照。
1.2.3 转基因拟南芥植株的产生 利用PCR技术构建表达载体pCAMBIA1301--GUS,测序正确后导入农杆菌GV3101中备用。选取6周左右生长一致的拟南芥野生型和突变体植株,将含有目的质粒的农杆菌菌液滴到未开的顶端分生组织上,所得后代经过繁殖得到T3代纯合体株系,验证后备用。
1.2.4 转基因植株种子萌发率和主根根长分析 萌发率分析:将消毒过的野生型、突变体、回补植株和过表达转基因植株的种子分别铺到1/2 MS、含有140 mmol·L-1NaCl的1/2 MS平板上,春化2 d后,置于温室中培养,6 d后拍照,统计种子的萌发率,每种材料统计100个种子的萌发情况,试验重复3次。
根长统计分析:将消毒过的野生型、突变体、回补植株和过表达转基因植株的种子分别铺到1/2 MS上垂直培养3 d后,分别转移到1/2 MS和含有140 mmol·L-1NaCl的1/2 MS平板上,垂直培养9 d后拍照,统计主根根长,每种材料统计100个植株,试验重复3次。

表1 所用引物
1.2.5 RNA提取和荧光定量PCR分析 使用Trizol法提取玉米和拟南芥植株组织(各自包含3个独立的生物学重复)的总RNA,RNA提取后利用Transgen反转录试剂盒进行反转录,获得cDNA。基因引物见表1。利用ABI PRISM 7500 荧光定量PCR仪器进行荧光定量PCR分析(每个基因3个独立的技术重复),具体程序为第一步为95 ℃ 5 min,第二步为95 ℃ 15 s,60 ℃ 1 min,共41循环,使用2–ΔΔCT法对数据进行分析[18]
2 结果与分析
2.1 玉米ZmSC1基因及其诱导表达模式分析
前期实验室转录组数据结果显示在盐处理下,一个基因表达量显著提高,通过蛋白序列比对分析发现该蛋白和小麦TaSC1(AAY26392)、拟南芥中AtSC1(NP001319157)同源性很高,序列一致性分别达到91%和71%,预测其具有Uncharacterised protein family (UPF0220)保守结构域。因此该基因被命名为(salt-stress correlative,NP001335968),全长423 bp,编码141个氨基酸(图1A)。根据的氨基酸序列,通过蛋白跨膜结构域在线预测软件TMHMM,预测ZmSC1蛋白的跨膜区域(图1B)。分析结果显示ZmSC1总共含有4个跨膜区,这表明ZmSC1应该是一个膜整合蛋白,可能在离子跨膜转运过程中会发挥功能。
为了进一步验证转录组数据结果,利用荧光定量PCR进行分析,发现基因确实受到高盐胁迫的诱导表达,在高盐处理6 h后,其表达量达到最高值,约为0 h的3.3倍,随后下降(图2),这表明可能参与到盐胁迫的调控过程中。
2.2 ZmSC1定位于细胞膜
为了分析ZmSC1的亚细胞定位,构建了35S::GFP-表达载体,通过农杆菌注射的方法注射到烟草表皮细胞,48 h后观察其荧光表达情况。结果显示注射35S::GFP的烟草细胞在共聚焦显微镜中在细胞核和细胞质中都有表达,而注射35S::GFP-菌液的烟草细胞,只能在细胞膜上看到绿色荧光信号(图3A)。为了进一步证明ZmSC1是一个膜蛋白,我们将连接好的35S::GFP-质粒导入经酶解提纯后玉米原生质体中,经过48 h暗培养后,只能在细胞膜上看到绿色荧光信号(图3B),因此确定ZmSC1是膜蛋白,推测它对物质的跨膜运输起到一定的作用。
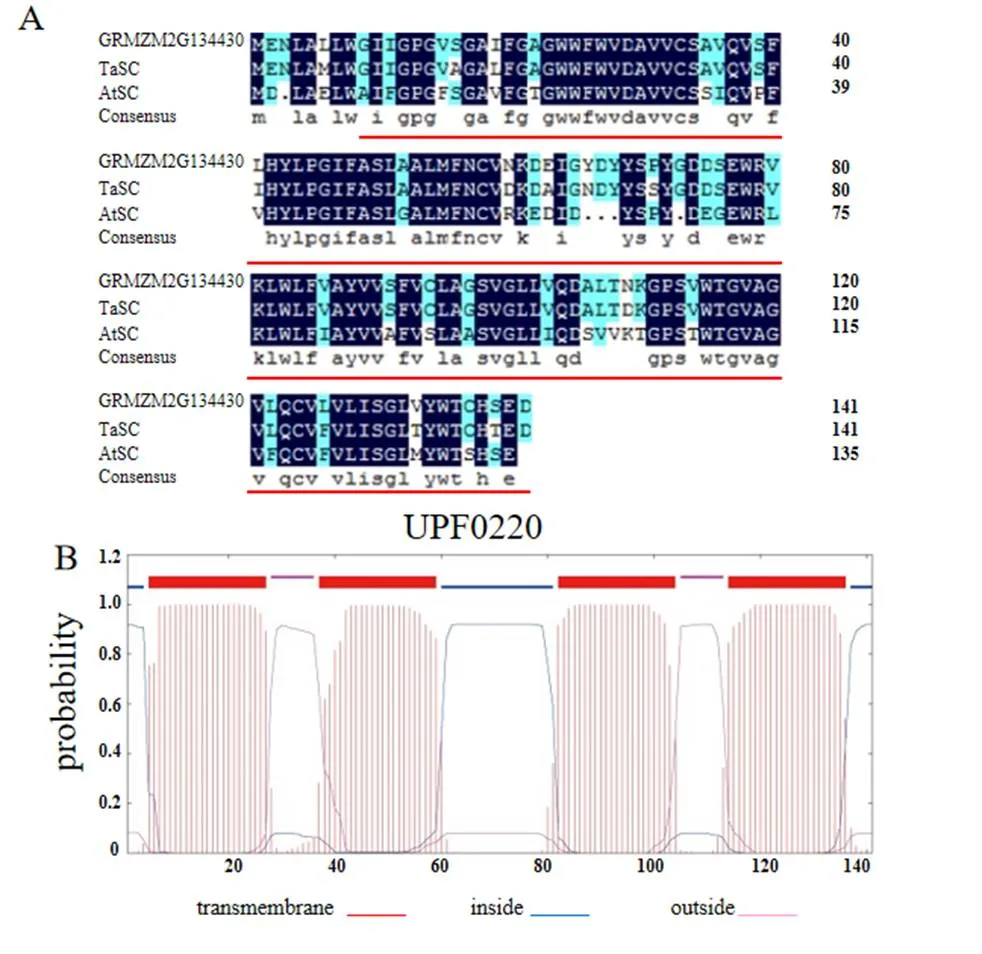
A. 玉米ZmSC1与TaSC1、AtSC1序列比对分析;B. 预测ZmSC1的蛋白跨膜区。
Figure 1 Bioinformatics analysis of ZmSC1
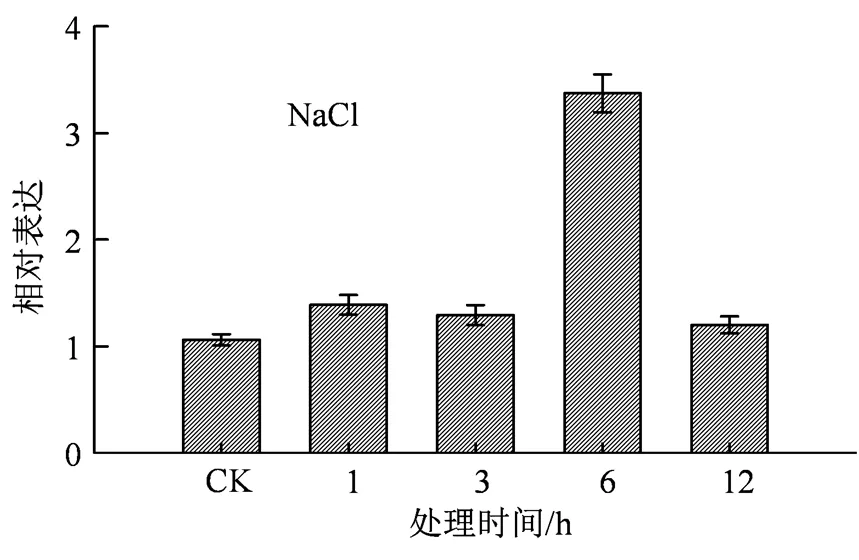
图中数据为实验重复的平均数值与标准差(SD)。
Figure 2 Expression level analysis ofunder NaCl stress
2.3 ZmSC1基因回补拟南芥突变体表型
为了解析的生物学功能,我们构建了35S启动子驱动的过表达载体,分别转化拟南芥同源基因突变体(SALK_072220)和野生型(Col-0)中,从而获得回补植株(Com-1,Com-2)(图4A)和过表达转基因植株(OE-1,OE-2)(图4B),所有材料繁殖T3代经过验证后进行下一步功能分析。正常生长条件下,野生型、突变体和回补植株在种子萌发率和主根根长上没有差异,然而在140 mmol·L-1NaCl 处理下,相对于野生型,突变体的种子萌发率和主根根长分别下降了18%和11%,这说明拟南芥基因具有耐盐功能;而转化了35S::ZmSC1的回补植株(Com-1,Com-2)的种子萌发率和主根根长得到了恢复(图5),这说明基因在盐胁迫的过程中发挥功能。
2.4 过表达ZmSC1基因增强拟南芥植株的耐盐性
为了进一步明确基因在盐胁迫中的功能,我们对过表达转基因植株OE-1和OE-2进行了种子萌发率和主根根长的统计。结果显示,在140 mmol·L-1NaCl 处理下,相较于野生型株系,过表达株系的种子萌发率分别提高了28.3%和26.4%,主根根长也分别增加了18.1%和18.3%(图6),这些结果说明基因具有增强植物的耐盐性功能。

A. 烟草瞬时表达分析;B. 玉米原生质体瞬时表达分析。
Figure 3 Subcellular localization of ZmSC1
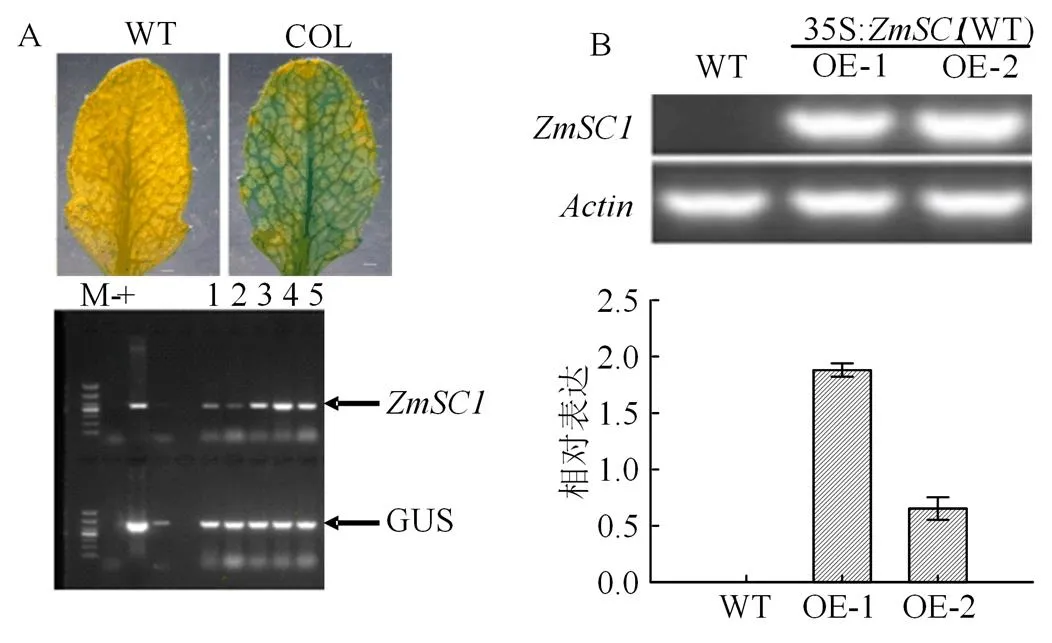
A. 回补植株GUS染色和PCR验证分析;B. ZmSC1在转基因拟南芥中表达量分析。
Figure 4 Verification ofcomplementation and overexpression transgenic lines
2.5 ZmSC1基因上调拟南芥植株中抗性相关基因的表达水平
在植物生物和非生物胁迫反应中,SOS途径、途径、COR蛋白等具有重要的调控作用[25-28]。为了初步分析基因调控拟南芥耐盐性的作用机制,我们利用荧光定量PCR技术分析了在盐胁迫条件下野生型和过表达转基因植株中胁迫相关基因的表达情况。结果显示,相较于野生型,转基因植株中,基因的表达量提高了3.4倍,和基因的表达量分别提高2.3倍和1.8倍,、、等基因的表达量也分别有不同程度的提高(图7)。这些结果说明通过提高抗逆相关基因的表达来增强拟南芥的耐盐性。

A. 正常和盐胁迫下各株系的萌发情况;B. 萌发率统计;C. 正常和盐胁迫下情况各株系幼苗主根的生长情况;D. 根长统计。
Figure 5can rescue the phenotype ofmutants under NaCl stress

A. 正常和盐胁迫下各株系的萌发情况; B. 萌发率统计;C. 正常和盐胁迫下情况各株系幼苗主根的生长情况;D. 根长统计。
Figure 6 Overexpression ofcan enhance salt tolerance in transgenicunder NaCl stress
3 讨论与结论
土壤盐渍化是影响植物生长和发育的重要因素,玉米作为重要的粮食饲料作物,其耐盐性较差,通过遗传改良手段有望成为选育耐盐品种的关键途径。然而玉米的遗传转化难度较大,首先利用模式作物拟南芥丰富的突变体库和异源转化来进行候选基因的功能验证已成为主要的研究思路[20-21]。
实验室已有转录组数据发现盐胁迫下基因的表达量升高。在本研究中,通过高盐诱导表达分析发现基因确实受到盐诱导6 h后表达量达到最高,12 h后开始下降(图2),此外在NaCl处理下,基因回补拟南芥植株比拟南芥突变体具有更好的种子萌发率和主根根长(图5),过表达转基因植株在正常情况下和野生型植株没有差异,但是在盐胁迫下比野生型也显示出更好的种子萌发率和主根根长(图6),这些结果和基因的功能报道一致[18],这也表明基因可以提高拟南芥的耐盐性,因此基因可以作为主要耐盐候选基因用于玉米遗传改良中。

图7 过表达ZmSC1在盐胁迫下可以上调转基因拟南芥抗逆相关基因的表达水平
Figure 7 Overexpression ofcan up-regulate the expression levels of stress-related genes in transgenicunder NaCl stress
耐盐相关基因常通过信号通路来行使功能,在盐胁迫下,过表达基因转基因植株中的基因的表达量是上调的(图7)。信号途径中CDPK激酶是钙依赖型的,钙激活通过调控下游转录因子的表达来提高已知耐盐相关基因、以及的表达,从而提高植物的耐盐性[22-24],这和本研究的结果是一致的。在盐胁迫下,过表达基因转基因植株中、以及基因的表达都分别提高了3.4、1.8和1.4倍(图7),这表明基因可能通过途径来提高植物的耐盐性。有趣的是在过表达转基因植株中,和基因的表达量也分别提高了2.3和1.8倍(图7),而在过表达转基因拟南芥植株中,和的表达量是没有变化的,这说明基因和虽然具有很高的序列相似性,并都能提高植物的耐盐性,但是其调控的信号通路可能是不同的,显然和基因表达量的变化也暗示基因调控植株的耐盐性也可能通过信号通路中,实际上已有报道和途径在植物耐盐途径中存在交叉对话[24]。当然,基因如何协同参与到和信号通路中还需要进一步的实验来验证。
综上所述,本研究从玉米中克隆到一个具有提高植物耐盐性的基因,进一步研究表明可能通过和信号通路来行使功能。研究结果为玉米耐盐性遗传改良提供了新基因,对玉米耐盐新种质的创建具有重要的指导意义。
[1] ZHU J K. Abiotic stress signaling and responses in plants[J]. Cell, 2016, 167(2): 313-324.
[2] WU J D, JIANG Y L, LIANG Y N, et al. Expression of the maize MYB transcription factor ZmMYB3R enhances drought and salt stress tolerance in transgenic plants[J]. Plant Physiol Biochem, 2019, 137: 179-188.
[3] CHEN X F, GU Z M, XIN D D, et al. Identification and characterization of putative CIPK genes in maize[J]. J Genet Genom, 2011, 38(2): 77-87.
[4] DE ZELICOURT A, COLCOMBET J, HIRT H. The role of MAPK modules and ABA during abiotic stress signaling[J]. Trends Plant Sci, 2016, 21(8): 677-685.
[5] ZHU M, SHABALA L, CUIN T A, et al.loci affect SOS1-like Na+/H+exchanger expression and activity in wheat[J]. J Exp Bot, 2016, 67(3): 835-844.
[6] LIU Y K, ZHANG D, WANG L, et al. Genome-wide analysis of mitogen-activated protein kinase gene family in maize[J]. Plant Mol Biol Rep, 2013, 31(6): 1446-1460.
[7] 刘玉鲲. 玉米基因家族的鉴定及基因对的功能分析[D]. 泰安: 山东农业大学, 2011.
[8] EDEL K H, MARCHADIER E, BROWNLEE C, et al. The evolution of calcium-based signalling in plants[J]. Curr Biol, 2017, 27(13): R667-R679.
[9] KARDILE H B, VIKRANT, SHARMA N K, et al. Calcium-dependent protein kinases (CDPK) in abiotic stress tolerance[J]. J Plant Sci Res, 2018, 34(2): 259-265.
[10] 张毓露. 玉米基因家族的克隆、表达分析及功能初探[D]. 乌鲁木齐: 新疆农业大学, 2012.
[11] BORKIEWICZ L, POLKOWSKA-KOWALCZYK L, CIEŚLA J, et al. Expression of maize calcium-dependent protein kinase (ZmCPK11) improves salt tolerance in transgenic Arabidopsis plants by regulating sodium and potassium homeostasis and stabilizing photosystem II[J]. Physiol Plant, 2020, 168(1): 38-57.
[12] JULKOWSKA M M, TESTERINK C. Tuning plant signaling and growth to survive salt[J]. Trends Plant Sci, 2015, 20(9): 586-594.
[13] SHI H Z, QUINTERO F J, PARDO J M, et al. The putative plasma membrane Na+/H+antiporter SOS1 controls long-distance Na+transport in plants[J]. Plant Cell, 2002, 14(2): 465-477.
[14] HUANG G T, MA S L, BAI L P, et al. Signal transduction during cold, salt, and drought stresses in plants[J]. Mol Biol Rep, 2012, 39(2): 969-987.
[15] 李卫明, 许辉欣, 柴政, 等. 不同浓度盐胁迫对三种饲草作物种子萌发特性的影响[J]. 中国奶牛, 2019(3): 62-65.
[16] SCHNABLE P S, WARE D, FULTON R S, et al. The B73 maize genome: complexity, diversity, and dynamics[J]. Science, 2009, 326(5956): 1112-1115.
[17] HUANG X, ZHANG Y, JIAO B, et al. Overexpression of the wheat salt tolerance-related gene TaSC enhances salt tolerance in[J]. J Exp Bot, 2012, 63(15): 5463-5473.
[18] JIANG Y L, ZHENG Q Q, CHEN L, et al. Ectopic overexpression of maize heat shock transcription factor gene ZmHsf04 confers increased thermo and salt-stress tolerance in transgenic Arabidopsis[J]. Acta Physiol Plant, 2018, 40: 9.
[19] LUDWIG A A, ROMEIS T, JONES J D G. CDPK- mediated signalling pathways: specificity and cross-talk[J]. J Exp Bot, 2004, 55(395): 181-188.
[20] ZHANG H L, ZHANG Y N, DENG C, et al. The Arabidopsis Ca2+-dependent protein kinase CPK12 is involved in plant response to salt stress[J]. Int J Mol Sci, 2018, 19(12): 4062.
[21] HUANG G T, MA S L, BAI L P, et al. Signal transduction during cold, salt, and drought stresses in plants[J]. Mol Biol Rep, 2012, 39(2): 969-987.
[22] ZHAO R, SUN H M, ZHAO N, et al. TheCa2+-dependent protein kinase CPK27 is required for plant response to salt-stress[J]. Gene, 2015, 563(2): 203-214.
[23] HUANG K, PENG L, LIU Y Y, et al. Arabidopsis calcium-dependent protein kinase AtCPK1 plays a positive role in salt/drought-stress response[J]. Biochem Biophys Res Commun, 2018, 498(1): 92-98.
[24] 陈柯岐, 邓星光, 林宏辉. 植物响应非生物胁迫的分子机制[J]. 生物学杂志, 2021, 38(6): 1-8.
[25] XIAO F, LI X C, HE J X, et al. Protein kinase PpCIPK1 modulates plant salt tolerance in[J]. Plant Mol Biol, 2021, 105(6): 685-696.
[26] ZHOU X L, DONG Y, ZHANG Q, et al. Expression of multiple exogenous insect resistance and salt tolerance genes inL.[J]. Front Plant Sci, 2020, 11: 1123.
[27] WAN F X, PAN Y, LI J H, et al. Heterologous expression ofandenhanced chilling tolerance in transgenic eggplant (L.)[J]. Plant Cell Rep, 2014, 33(12): 1951-1961.
[28] ZOU J J, WEI F J, WANG C, et al.calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca2+-mediated stomatal regulation in response to drought stress[J]. Plant Physiol, 2010, 154(3): 1232-1243.
Overexpression of maizegene enhances salt stress tolerance in transgenic
WANG Long, CHEN Yirong, YU Wei, LIU Yuqing, LI Aiqi, WU Jiandong
(National Engineering Laboratory of Crop Stress Resistance Breeding, Anhui Agricultural University, Hefei 230036)
The purpose of this study was to clone the gene of salt-stress correlative (from maize and analyze the molecular features and biological function of salt tolerance in. The full length ofwas cloned from maize B73 and protein sequence was compared and aligned with ZmSC1 homologs in other species. In addition, the mRNA level was measured using qRT-PCR under the treatment of NaCl, and the protein localization of ZmSC1 in tobacco leaves was analyzed.gene was transferred intomutant and wild-type plants, and its effects on the seed germination rates and primary root length were analyzed. The expression level changes of stress-related genes inoverexpressing transgenic lines were analyzed under the treatment of 140 mmol·L-1NaCl. As results, the full length ofwas 423 bp, encoding 141 amino acids. Protein sequence alignment revealed that ZmSC1 had high conservation with TaSC1 and AtSC1, which are known to be involved in salt stress responses. Transient expression of the-GFP in tobacco leaf epidermal cells showed a membrane localization of ZmSC1. The pCAMBIA1301-ZmSC1 vector was constructed and further transferred into, and then the complemental lines formutant and overexpressingtransgenic lines were obtained. Under the treatment of 140 mmol·L-1NaCl, the results showed that complemental lines had higher seeds germination rate and primary root length than the mutant, suggesting thatcan rescue the phenotype ofmutant. In addition, the overexpressingtransgenic lines showed higher seed germination rate and longer primary roots than the wild type. Moreover, the higher expression level of stress-related genes (,,and) in overexpressingtransgenic lines were detected than the wild type. In conclusions, the result showed thatgene, a homologous gene ofand, can play an important role in improving salt tolerance of.
maize;; mutants; overexpression; salt stress tolerance
S513
A
1672-352X (2022)05-0694-06
10.13610/j.cnki.1672-352x.20221111.002
2022-11-14 10:54:49
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20221111.1101.004.html
2022-01-01
安徽省自然科学基金(2008085MC70)和安徽省高等学校自然科学研究项目(KJ2021A0172)共同资助。
王 龙,硕士研究生。E-mail:wl15255636163@163.com
武健东,副教授。E-mail:wujiandong@ahau.edu.cn
