木质素与纤维素酶间相互作用及其抑制纤维素酶水解的研究进展
2022-11-24李大林黄六莲2陈礼辉2罗小林3刘
李大林黄六莲,2陈礼辉,2罗小林,2,3刘 婧,2,
(1.福建农林大学材料工程学院,福建福州,350002;2.植物纤维功能材料国家林业和草原局重点实验室,福建福州,350002;3.南京林业大学江苏省制浆造纸科学与技术重点实验室,江苏南京,210037)
尽管化石燃料(如汽油和柴油等)促进了人类社会的快速发展,但其也在全球范围内引发一系列环境问题[1-2]。基于可再生、廉价及来源丰富等特性,木质生物质已成为制备燃料化学品的理想原材料[3-6]。酶水解和发酵可将木质生物质转化为燃料化学品(如乙醇或丁醇)。但在酶水解前,通常需采用物理或化学预处理来突破木质生物质致密结构对酶的抗降解屏障[7]。尽管现有预处理方法(如热水、稀酸、稀碱、氨纤维爆破、亚硫酸盐、离子液体或低温共溶剂等)可在一定程度上破坏木质生物质的致密结构,提高预处理固体基质中纤维素对酶的可及性,但预处理(特别是酸法预处理)也会促使细胞壁内木质素发生解聚、移位、缩合和反沉积。研究发现,沉积木质素可对纤维素酶组分产生严重的无效吸附[8]。这种无效吸附不仅使酶水解液中有效作用于纤维素的酶分子减少,而且也会影响部分酶组分的活力,导致预处理固体基质中酶水解效率下降。为获得较高的纤维素酶水解转化率,纤维素酶用量则随之增加。因商品纤维素酶价格昂贵,这导致酶水解过程中的酶成本达到纤维素燃料乙醇整体生产成本的30%~50%。可见,木质素对纤维素酶的无效吸附已成为严重制约纤维素基燃料化学品产业(如燃料乙醇等)发展的技术瓶颈[7-10]。
除对酶分子进行改造和对木质素分子进行化学修饰外,研究者主要通过向酶水解液中添加屏蔽剂(如牛血清蛋白[11]、聚乙烯醇[12]或Mg2+等[13])来克服木质素对纤维素酶的不利影响。然而,因木质素和纤维素酶间作用机制较为复杂,现已开发的木质素屏蔽剂存在成本较高(如牛血清蛋白)[10,14]或影响后续发酵微生物活性及发酵液后处理效率等缺陷[15]。可见,确定木质素与纤维素酶间相互作用机制是合理开发新型木质素屏蔽剂、减少木质素对酶无效吸附以及降低燃料乙醇生产成本的重要理论基础。因此,除简要介绍木质素及纤维素酶物化特性外,本文重点概述木质素与纤维素酶间相互作用、两者相互作用的表征以及木质素屏蔽剂缓解木质素对纤维素酶不利影响的研究进展。
1 木质素和纤维素酶的物化特性
尽管预处理方法及其剧烈程度均对残余木质素结构和官能团产生不同影响(见表1),但预处理过程中木质素主要发生解聚(如β-O-4和α-O-4芳基醚键断裂等)和缩合(如β-β′、5-O-4′、5-5′等连接结构的形成)两类反应。因此,基于前期研究[16-33],预处理后残余木质素分子中可与纤维素酶发生作用的官能团主要包括:①非离子化基团,如酚羟基、脂肪羟基和苯基等;②离子化基团,如—COOH和—SO3H等。

表1 不同预处理残余木质素的物理化学特性Table 1 Physicochemical properties of residual lignin from different pretreatments
为提高协同催化效率,商品纤维素酶通常含有多种组分,主要包括外切葡聚糖酶(CBH)Ⅰ~Ⅱ型、内切葡聚糖酶(EG)Ⅰ~Ⅴ型、β-葡萄糖苷酶(β-G)Ⅰ型等(见表2)[8,23]。由表2可知,除相对分子质量外,不同酶组分的等电点(pI)也不同,即在特定pH值(如pH值为5的醋酸-醋酸钠)的缓冲液中,不同酶组分表面电荷特性不同(如CBHⅠ、EGⅠ和EGⅤ带正电,其他组分带负电)。同时,不同酶组分的疏水性也不同,里氏木霉(T.reesei)和黑曲霉(A.niger)代谢产生的纤维素酶组分按照疏水性由高到低的次序为:EGⅣ>EGⅤ>CBHⅡ>β-GⅠ>EGⅡ>EGⅢ>EGⅠ>CBHⅠ。
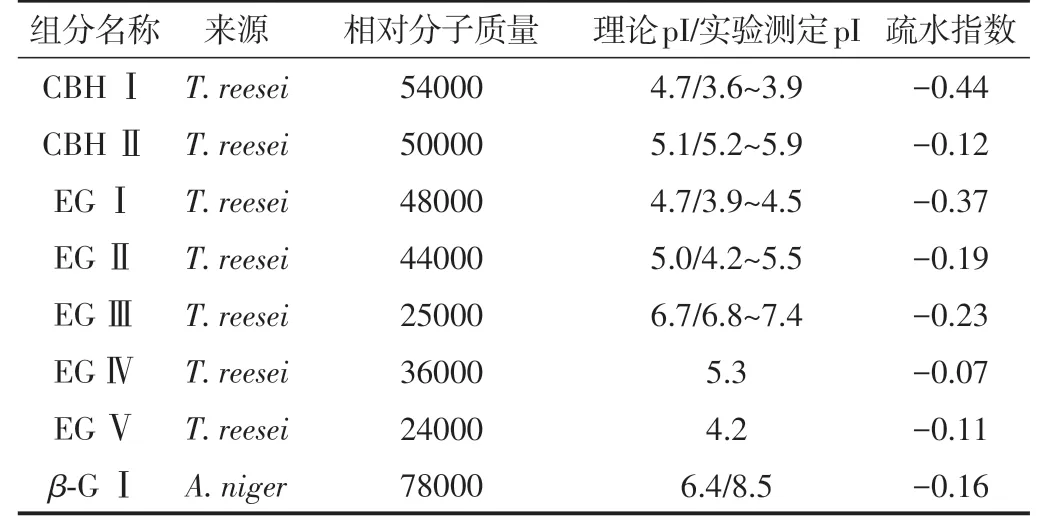
表2 纤维素酶组分的物理化学特性Table 2 Physicochemical properties of cellulase components
基于木质素和纤维素酶组分的物理化学特性,大量研究表明,木质生物质预处理后残余木质素可对纤维素酶产生显著的无效吸附。无效吸附造成的不利影响主要包括两方面:①木质素对纤维素酶产生无效吸附后,部分纤维素酶无法脱附,致使酶水解液中有效酶浓度显著降低;②被吸附的部分纤维素酶分子结构发生重构,即便发生脱附,酶分子也会失去其催化活性。因此,除孔隙结构、半纤维素含量及纤维素本身特性外,固体基质内外表面残余木质素对纤维素酶的无效吸附已被证实为影响纤维素酶水解效率的最重要因素之一[6,8,21-22]。
2 木质素与纤维素酶间的相互作用
为减少残余木质素的无效吸附对酶水解过程的不利影响,大量研究从不同角度揭示木质素与纤维素酶间的相互作用机制。基于前期报道,木质素与纤维素酶间的相互作用可总结为:①静电作用,即纤维素酶带电官能团和木质素带电官能团间可发生静电吸引或排斥作用;②疏水作用,即纤维素酶外层氨基酸残基上烷基碳链与木质素上苯基或联苯基团间发生疏水作用;③氢键作用,即纤维素酶外层氨基酸残基上极性非电离基团(—OH、—COOH和—C(=O)—NH2等)与木质素的羟基和羧基发生氢键作用;④离子-π作用,即纤维素酶组分中氨基酸残基基团(如—NH3+)与木质素芳基基团(苯基和联苯基等)产生的离子-π作用(见图1)。因此,下述将从这4个方面来阐述木质素与纤维素酶间相互作用的研究进展。
2.1 静电作用
根据前述研究[16,23-24,26-28],木质素与纤维素酶间的静电作用可产生2种效应:①静电吸引引发纤维素酶组分的无效吸附或失活,降低酶水解效率;②静电排斥减少木质素对纤维素酶的无效吸附,提高酶水解效率。
前期研究[15]发现,在pH值为5的酶水解缓冲体系中,带正电的纤维素酶组分(如β-GⅠ(pI≈8)、EGⅢ(pI=6.8~7.4)和CBHⅡ(pI=5.2~5.9)可与带负电的木质素产生无效吸附。Fritz等[25]发现,相同酶水解条件下,因枫木硫酸盐未漂浆中木质素表面静电荷高于枫木磨木木质素,前者对纤维素酶的吸附量比后者高20%。Kellock等[24]也报道了类似的现象。然而,将酶水解缓冲液pH值从常规的4.8~5.0调至5.2~6.2后,Lan等[26]发现,SPORL预处理固体基质(杨木和松木等)中纤维素的酶水解转化率提高约20%。这主要是由于,提高缓冲液的pH值后,纤维素复合酶和SPORL预处理固体基质中木质素的Zeta电位均为负值,两者间静电排斥作用随缓冲液pH值的升高而不断增强,无效吸附相应减弱。同时,相关研究团队[27-30]也相继提出,增加木质素所带负电荷有利于降低其对纤维素酶的无效吸附,进而提高固体基质中纤维素的酶水解效率。
总体而言,静电排斥对预处理固体基质中纤维素酶水解效率的促进作用较为有限(<30%)[26-27]。由此可推测,在特定pH值的酶水解缓冲体系中,木质素非带电基团(如苯基和酚羟基等)与纤维素酶特征基团间可能还存在其他类型的相互作用(见图1)。
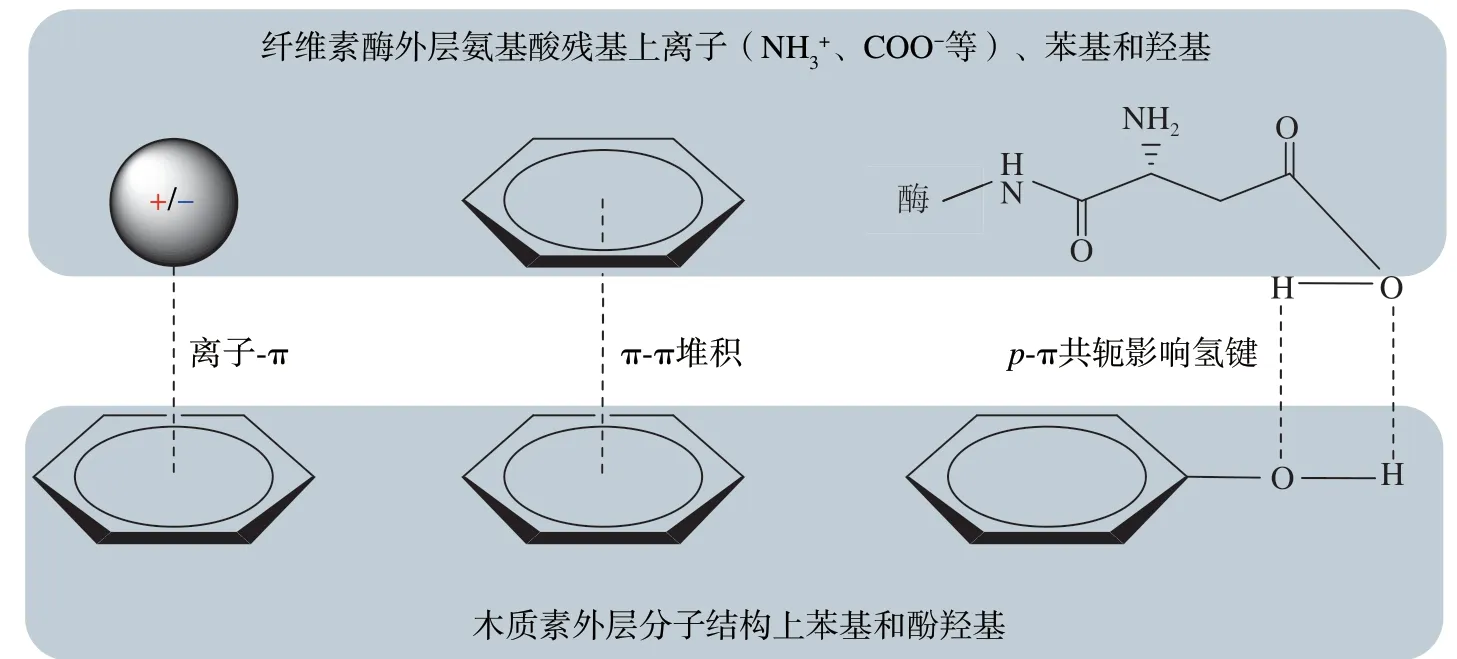
图1 木质素与纤维素酶间存在的离子和非离子-π作用Fig.1 Ionic-and non-ionic-π interactions between lignin and cellulase
2.2 疏水作用
部分研究[32-35]认为,木质素芳基基团(如苯基和联苯基团等)与纤维素酶外层氨基酸残基上烷基基团(如亮氨酸烷基基团等)间的疏水作用是导致木质素无效吸附的最主要因素。例如,Lai等[32]发现,因针叶木木质素的疏水性高于阔叶木木质素,前者对纤维素酶的吸附力高于后者。基于分离5种木质生物质(棉花、黑柳、白杨、桉树和火炬松)中木质素的研究,Huang等[33]发现,木质素的疏水性越高,其对纤维素酶水解效率的抑制作用也越强。Qin等[36]对原子力显微镜(AFM)探针分别进行聚苯乙烯(PS)微球、羟基化或羧基化修饰,使探针具有相应的疏水或亲水性质;结果发现,PS微球修饰探针对纤维素酶的吸附力比其他2种修饰探针分别高13%和43%,进而推测木质素芳基基团与纤维素酶分子烷基基团间的疏水作用是2种大分子间最主要的作用力。然而,除烷基基团外,纤维素酶外层氨基酸残基上也可能含有芳香基团(如苯丙氨酸的苯基以及部分氨基酸残基上的吲哚基团等),其也可能与木质素芳基基团产生π-π堆积作用[37],该作用力对疏水作用的贡献有待验证。
与上述研究结果不同的是,Kellock等[24]发现,木质素对EGⅠ的吸附量显著高于CBHⅡ,但EGⅠ的疏水指数(-0.37)明显低于CBH II(-0.12)(见表2)。这可能是由于,尽管CBH II的疏水性高于EG I,但EG I氨基酸残基上的苯丙氨酸(Phe)的数量高于前者。基于Neel等[38]对π-π堆积效应的系统论述,Gusakov等[23]证明,芳香性物质间的π-π堆积效应可强化其疏水作用。基于理论计算和实验验证,Sinnokrot等[39]和Krenske等[40]也分别发现,芳香性化合物(苯-苯和苯-咪唑等)分子间存在π-π堆积效应,其可能对疏水作用产生较大贡献。对于纤维素酶而言,Yama‐guchi等[41]发现,通过基因编辑等手段将酶分子多肽链中部分Phe(含残余苯基)替换为异亮氨酸(Ile,含残余异丁基)后,其催化活性不变,但对木质素的吸附量显著降低。由此,该研究团队推测,基因编辑可降低多肽链中Phe苯基与木质素苯基间的π-π堆积效应,进而弱化两者间的疏水作用。因此,π-π堆积对增强木质素与纤维素酶间疏水作用的机制仍有待深入探索。
2.3 氢键作用
根据现有研究,木质素与纤维素酶间的氢键作用主要体现在前者的羟基(酚羟基和脂肪羟基)与后者的羟基和酰胺基间的相互作用。然而,木质素酚羟基和脂肪羟基对此种氢键作用的影响程度不同。
相关研究[16,20]先后证实,随着酸法预处理(LHW和DA等)剧烈程度的提高,尽管固体基质中半纤维素去除率显著提高,其孔隙率也相应提高,但木质素降解后缩合程度也不断提高,即便在高纤维素酶用量条件下,固体基质中纤维素的酶水解效率也难以再提高[42-44]。Sewalt等[45]推测,这主要是由木质素中酚羟基含量增加所致,其可能通过氢键作用加剧对纤维素酶组分的无效吸附。Yu等[21]和Sun等[22]将木质素上酚羟基含量和脂肪羟基含量与纤维素酶的吸附量以及酶水解效率进行定量关联;结果发现,纤维素酶无效吸附量随木质素酚羟基含量的提高而不断增加,酶水解效率则随之不断下降。由此,这些研究者推测,木质素酚羟基与纤维素复合酶间的氢键作用力高于脂肪羟基与纤维素复合酶间的此种作用力。为验证此结论,Yang等[31]对木质素酚羟基进行羟丙基化修饰,结果发现,木质素对纯纤维素酶水解效率的抑制作用大幅降低(由70%降至15%),进而推测由酚羟基介导的氢键作用是木质素与纤维素酶间最主要的作用力。
2.4 离子-π作用
Dougherty[46]基于理论计算首次发现,阳离子(如Li+和K+等)与芳香性化合物(如苯和苯丙氨酸等)间存在阳离子-π作用。随后Lu等[47]证实,基于纳米力学分析,在液相环境(pH值3.0的乙酸溶液)中,带正电的聚赖氨酸(P-Lys,残余—NH3+)与芳香性聚色氨酸(P-Trp,残余吲哚基)间存在阳离子-π作用。
根据Ko等[16]和Kellock等[24]的研究,在pH值为5.0的缓冲体系中,CBH I和EG I等纤维素酶组分均含有带正电的氨基酸残基基团(如—NH3+)。理论上,这些带正电基团可与木质素芳基基团(苯基和联苯基等)产生阳离子-π作用。早期,研究者推测,阳离子-π作用有利于促进木质素与阳离子聚合物(聚二烯丙基二甲基氯化铵)的自组装[48]。近期,通过不同Debye长度外源离子(如Na+和K+等)排除静电、氢键和疏水作用的干扰,在液相环境(酶水解缓冲液)中,本课题组[49]系统研究了木质素与纤维素酶间的纳米力学行为,初步证明纤维素酶(Celluclast 1.5L®,T.reesei)与毛竹磨木木质素间存在阳离子-π作用力(见图2)。
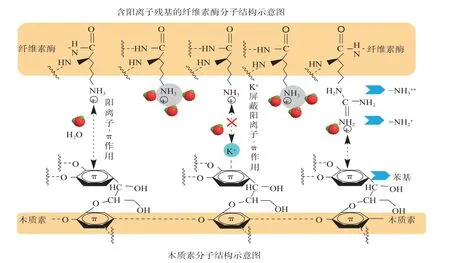
图2 木质素与纤维素酶间的阳离子-π作用Fig.2 Cation-π interaction between lignin and cellulase
与阳离子-π作用类似,Gamez等[50]和Frontera等[51]先后证实,阴离子(如Cl-等)与芳香性化合物(如苯和咪唑等)间存在阴离子-π作用。在pH值为5.0的缓冲体系中,因EG III和β-G I等纤维素酶组分均含有带负电的氨基酸残基基团(如—COO-),理论上,其也可与木质素芳基基团产生阴离子-π作用。但目前,还未见木质素与纤维素酶间阴离子-π作用的相关报道。
3 木质素与纤维素酶间相互作用的表征
基于物理吸附及酶水解效率等宏观研究手段,前期研究间接推测出木质素与纤维素酶间主要存在静电、疏水和氢键作用[6,8,52]。尽管这些基础研究为部分实际应用(如磺化木质素提高静电排斥[24-25]、Mg2+弱化酚羟基介导的氢键作用[13]以及非离子型表面活性剂屏蔽疏水作用[34-35]等)奠定了理论基础,但因2种大分子自身的复杂结构及宏观实验研究的局限性,部分研究结果间存在矛盾。Eriksson等[12]、Cai等[35]和Qin[36]等认为疏水作用是导致纤维素酶被无效吸附的主导因素;然而,其他研究者(Yu等[21]、Sun等[22]、Yang等[31])则认为由酚羟基介导的氢键作用是最重要的影响因素。这主要是由于,纤维素酶含有多种组分,木质素结构和官能团较为多样化,二者的相互作用也由此变得较为复杂。物理吸附和间接验证(如木质素抑制酶水解效率)等宏观手段往往无法获得确定的研究结论。因此,引入更为微观的研究手段则显得尤为必要。
纳米力学是指特征尺度在0.1~100 nm距离范围内纳米物体或纳米界面间的力学行为[38,46-47]。在特定环境(如气相或液相)中,基于微观力学分析仪器(如AFM[36]和表面力仪(SFA)[47,49]),纳米力学分析距离及力学强度的灵敏度可分别达到埃米和nN数量级,显著提高了研究结果的准确性。据此,研究者近期利用SFA初步证实,木质素与纤维素酶间存在阳离子-π作用[49]。可见,区别于物理吸附和间接验证等宏观研究手段,纳米力学分析可为揭示大分子间新型作用机制提供直接且可靠的实验证据,有利于系统分析木质素与纤维素酶组分间的非共价作用机制。
4 木质素屏蔽剂对木质生物质酶水解的促进作用
尽管分子修饰或代谢基因改造等生物化学技术是降低木质素对纤维素酶产生不利吸附的理想手段,但木质素和纤维素酶分子结构及组成成分均较为复杂,基于木质素-纤维素酶相互作用来确定靶向改性位点的研究仍存在挑战[52-53]。因操作简单、成本低、效果明显等原因,目前,研究者主要通过开发屏蔽剂来弱化木质素-纤维素酶分子间的相互作用,进而达到减少无效吸附以及提高木质生物质酶水解效率的目的[6,8,54]。下述将从屏蔽剂与木质素相互作用的角度来概述不同类型屏蔽剂的开发和应用效果。
4.1 基于静电和氢键作用的木质素屏蔽剂
Akimkulova等[13]采用Mg2+对木质素进行处理后发现,其可在一定程度上降低木质素对纤维素酶的吸附(见表3)。以单宁酸为木质素模型物,该研究团队推测,Mg2+可与木质素酚羟基产生螯合作用,进而降低纤维素酶组分与木质素酚羟基间的氢键作用;同时,Mg2+也可能与部分酚羟基中的氢质子发生交换,减少木质素表面的负电荷,从而削弱木质素与纤维素酶分子间的静电吸引作用。当向SPORL预处理固体基质酶水解体系中添加Ca2+后,研究者发现,酶水解液中纤维素酶的稳定性和活性显著提高;由此推测Ca2+可与木质素磺酸盐(LS)形成表面负电荷较低的复合物,降低LS大分子间的静电排斥,促使LS自身通过氢键等作用发生絮聚沉淀,进而减少木质素对纤维素酶的无效吸附[8,55-56]。
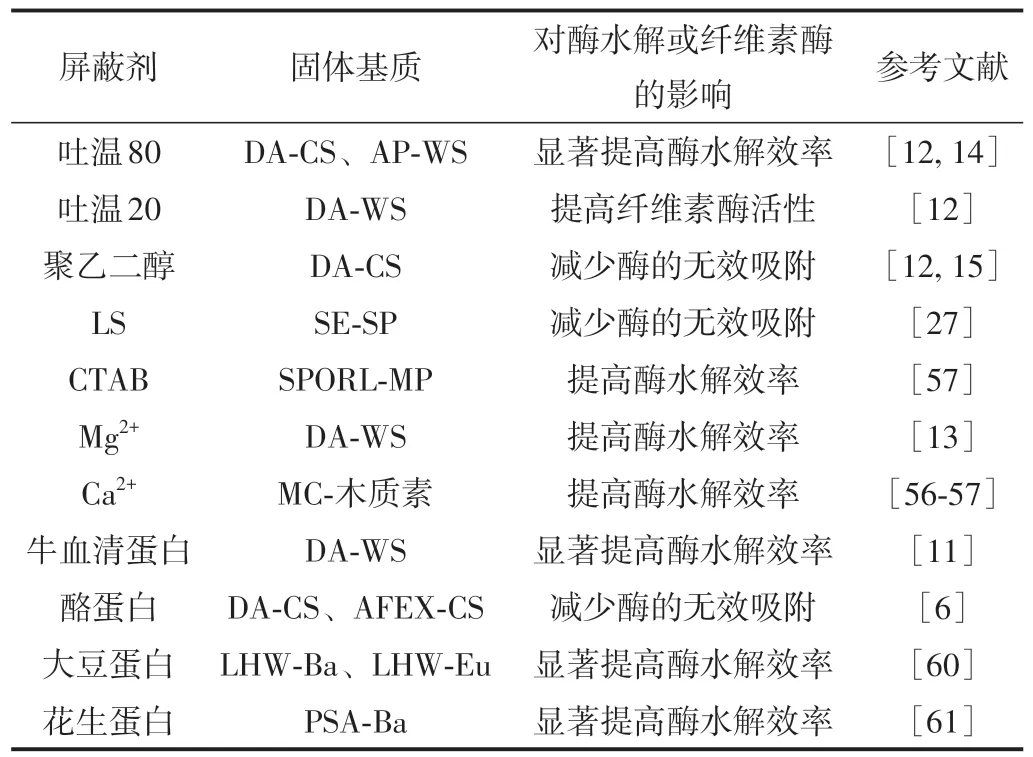
表3 木质素屏蔽剂对预处理固体基质酶水解的影响Table 3 Effects of lignin-blocking agents on enzymatic hydrolysis of pretreated solid substrates
此外,离子型表面活性剂(如LS和十六烷基三甲基溴化铵(CTAB))也被开发为木质素屏蔽剂。例如,Wang等[27]发现,将LS添加到酶水解体系中,木质素对纤维素酶的吸附量从182 mg/g降至88 mg/g,纤维素酶水解效率提高了约30%。这是因为,LS可吸附于木质素上,增加LS-木质素复合物的电负性,进而通过静电排斥作用减少木质素对酶的无效吸附。进一步将聚乙烯醇(PEG)修饰于LS上,研究者发现,LS-PEG可通过静电排斥等作用分散纤维素酶的聚集状态,进而提高木质纤维素的酶水解效率,且其作用效果与LS相对分子质量和磺酸根含量均有关[57-58]。此外,将LS加入酶水解体系后,研究者还发现,如继续添加CTAB,二者具有协同作用,CTAB可降低LS表面负电荷,促进LS在预处理固体基质残余木质素表面的吸附,强化木质素与纤维素酶的静电排斥作用,最终提高SPORL预处理固体基质酶水解效率[59]。
4.2 基于疏水作用的木质素屏蔽剂
研究者发现,部分屏蔽剂主要通过疏水作用屏蔽木质素。Castanon等[34]和Eriksson等[12]先后采用非离子表面活性剂吐温80和PEG来屏蔽木质生物质预处理固体基质表面的木质素,纤维素酶水解效率得到显著提高(30%~50%)。近期,Cai等[35]利用两亲性聚乙烯吡咯烷酮(PVP)作为添加剂,在低酶用量(3 FPU/g聚葡萄糖)条件下,桉木稀硫酸预处理固体基质中纤维素的酶水解效率从~30%提高到70%。研究者认为,吐温80和PVP等非离子型表面活性剂主要通过疏水作用与木质素结合,被吸附的屏蔽剂可在木质素表面发生重排,其亲水基团(醚键)暴露于水相,所形成的水化层可抑制木质素对纤维素酶的无效吸附[6,11-12,35]。
尽管非生物基木质素屏蔽剂(如金属离子和表面活性剂等)可通过疏水和静电等作用有效缓解木质素对纤维素酶的不利影响,但其具有废液难以处理以及不具生物兼容性等缺陷[62-63]。因此,研究者进一步将动植物蛋白开发为生物基木质素屏蔽剂。
因对酶水解效率具有明显的促进作用,牛血清蛋白(BSA)常被用作生物基木质素屏蔽剂。例如,添加一定量BSA至酶水解液中,诸多酸法预处理固体基质中纤维素的酶水解效率得以显著提高[10,60-61,64-65]。这主要是由于,基于蛋白疏水区域与木质素的疏水作用,BSA可选择性屏蔽固体基质表面的木质素。大量研究[10,16,60-61,64]发现,酸法预处理固体基质对纤维素酶和BSA均具较强的吸附能力,但纯纤维素(如微晶纤维素Avicel)仅对纤维素酶产生吸附。这表明,在选择性屏蔽预处理固体基质表面木质素的同时,BSA将不会影响纤维素对酶的可及性[11]。在实验研究方面,尽管BSA具有一定的应用价值(如减弱木质素的无效吸附),但商品BSA主要来源于牛血清,其价格昂贵,不具备工业化应用的潜在可能性[10,66]。酪蛋白也被用于木质素屏蔽剂制备,作为动物蛋白,其也存在成本较高的缺陷。
近期,研究者进一步将部分廉价植物蛋白开发为木质素屏蔽剂。本研究团队发现,廉价脱脂豆粉中水溶性大豆蛋白(SP)具有显著提升水热预处理固体基质酶水解效率的作用[60,64]。添加80 mg/g聚葡萄糖的SP后,水热预处理竹子、桉木及马尾松固体基质中纤维素酶水解效率从对照样品的57%、54%和45%分别增加至87%、94%和86%[60]。添加SP后,达到相近的酶水解效率(如80%~90%),纤维素酶用量可减少4~8倍,这将显著降低酶水解的成本。与此类似,本研究团队[61]还发现,脱脂花生粉中水溶性花生蛋白(PP)具有与SP相似的作用效果,这进一步扩大了廉价生物基木质素屏蔽剂的选择范围。基于对酶水解底物及蛋白的表征,研究者初步认为,SP和PP主要通过疏水和氢键等作用力吸附于木质素上,被吸附的蛋白分子的亲水区则裸露在水相中,形成水合层后,其可降低木质素对纤维素酶的吸附[6,60-61]。可见,此作用机制与非离子表面活性剂(如吐温80和PVP等)屏蔽木质素的过程具有相似之处,但SP和PP等蛋白与木质素间是否存在离子-π作用还有待进一步证实。
5 结语及展望
高效制备可发酵糖(如葡萄糖)是开发纤维素基燃料化学品的基础。然而,木质素对纤维素酶的无效吸附严重抑制了酶催化水解纤维素制备葡萄糖的效率。目前,屏蔽剂是克服木质素对纤维素酶不利影响的最简单、廉价的方法。但木质素与纤维素酶分子结构复杂,两者间相互作用的机制较为复杂,这也在一定程度制约了高效、绿色屏蔽剂的开发。前期研究发现,木质素与纤维素酶间存在静电、疏水、氢键和阳离子-π作用,但关于“木质素与纤维素酶间阴离子-π、π-π堆积或p-π共轭等非共价相互作用”等方面的报道仍然较少。同时,纤维素不同酶组分与木质素官能团对特定作用力的影响也有待进一步深入探索。因此,仍需从不同角度、采用不同手段来系统揭示木质素与纤维素酶间的非共价作用机制。
利用纳米力学等微观分析手段以系统解析木质素与纤维素酶间的作用机制,目前还需继续探索研究以下关键问题:①明确纤维素酶主要组分外层氨基酸残基上带电基团(如—NH3+和—COO-等)与木质素苯基基团间的阳离子-π和阴离子-π作用;②探索分析木质素苯环所连接官能团(苯环、酚羟基和甲氧基等)对离子-π作用的影响;③辨明非离子-π作用(如π-π堆积和p-π共轭效应)对木质素与纤维素酶间疏水和氢键作用的强化机制。研究这些问题将不仅有利于系统揭示木质素与纤维素酶间的非共价作用体系,也可为新型木质素屏蔽剂的定向开发以及酶和木质素分子结构的精准调控奠定坚实理论基础,有利于推动纤维素燃料乙醇的产业化发展。
