硫酸新霉素制药废水好氧活性污泥中优势硝化菌的分离鉴定及实验研究
2022-11-24吴媛媛乐超银龚大春谢飞
吴媛媛,乐超银,龚大春,谢飞
(1.三峡大学 生物与制药学院,湖北宜昌 443002;2.宜昌三峡制药有限公司,湖北宜昌 443002)
在全面控制污染物排放专项整治行动中,原料药制造行业属于十大重点行业之一,制药(抗生素、维生素)行业需严格控制其废水污染物排放。制药废水因污染物质组分复杂,氨氮含量高,且包含有生物抑制物、有毒有害物质而难以被微生物自然降解,因此抗生素类制药废水的处理是一个棘手问题。在制药废水生化处理过程中,脱氮菌是影响生物脱氮效果的关键因素,发掘新型的高效脱氮菌对生物脱氮技术在废水处理中的运用具有十分重要的意义。
1 材料与方法
1.1 仪器与试剂
1.1.1 实验仪器
LDZM-80KCS压力灭菌器,上海申安医疗器械厂;VS-1900净化工作台,苏州市金净净化设备科技有限公司;Applied Biosystems 2720热循环仪,美国赛默飞世尔公司;GWA-UN4-F20超纯水器,北京普析通用仪器有限公司;FR980凝胶成像仪,上海复日科技仪器有限公司;TH2-C恒温摇床,太仓市实验设备厂;FE28型酸度计,瑞士梅特勒-托利多公司;Applied Biosystems 3730XL测序仪,美国赛默飞世尔公司;DT5-6A离心机,北京时代北利离心机有限公司;SHH-250L生化培养箱,重庆康城永生试验设备有限公司;E100光学显微镜,日本尼康公司;Cary 60 UV-Vis分光光度计,美国安捷伦公司。
1.1.2 试剂
NaCl、MgSO4·7H2O、Na2CO3、CaCO3和NaH2PO4,AR级,成都市科隆化学品有限公司;K2HPO4、KH2PO4、CH3COONa、(NH4)2SO4和MnSO4·H2O,AR级,西陇科学股份有限公司;FeSO4·7H2O、NH4Cl,AR级,国药集团化学试剂有限公司;无水葡萄糖,AR级,中国惠兴生化试剂有限公司。
1.2 样品与培养基
1.2.1 样品来源
活性污泥样品采集自湖北省宜昌市三峡制药有限公司生化池。使用前先用纯化水进行清洗处理:用250 mL烧杯装入一半容积的污泥,加入等体积纯化水后,玻璃棒搅拌1 min,静置沉降30 min,去除上层水洗液,重复3次后备用。同时取样进行宏基因测序,分析目标样品内微生物结构丰度。
1.2.2 培养基
(1)富集培养基。富集培养基A:NH4Cl 0.8 g、NaNO20.5 g、KH2PO44.0 g、MgSO4·7H2O 0.4 g和 Na2CO30.8 g,加水 2 000 mL,pH 7.4,121 ℃高温灭菌15 min。富集培养基B:NaNO22 g、NaCl 1 g、K2HPO41 g、MgSO4·7H2O 1 g、FeSO40.8 g 和Na2CO32 g,加水 2 000 mL,pH 7.8,121 ℃高温灭菌15 min。
(3)硝化培养基培养基。NH4Cl 0.4 g、NaCl 0.12 g、K2HPO40.2 g、CH3COONa 2 g、MgSO40.05 g、MnSO40.01 g和FeSO40.01 g,加水1 000 mL,调节pH值7.2,添加18 g/L的琼脂,121 ℃高温灭菌15 min。
(4)反硝化培养基。NaNO20.05 g、NaCl 3 g、KH2PO42 g、CH3COONa 1 g、NaH2PO43 g和无水葡萄糖10 g,加水1 000 mL,调节pH值7.2,添加18 g/L的琼脂,121 ℃高温灭菌15 min。
1.3 硝化菌富集培养及菌株分离
取经过前处理的活性污泥20 mL分别加入装有100 mL无菌富集培养基的250 mL三角瓶中。30 ℃、180 r/min恒温摇床中富集培养72 h;转接后,再次富集。将富集液进行梯度稀释(10-2~10-4)后,分别涂布于、硝化和反硝化固体培养基上,30 ℃恒温培养至出现明显单菌落[1]。
1.4 硝化菌的筛选
将分离得到的菌株分别接种到富集培养基中,在30 ℃、180 r/min的摇床中培养24 h。将初筛选出的菌株(OD600约为1.0)按5%的接种量接种于液体培养基中,在30 ℃,180 r/min摇床中培养[2]。分别在培养0 h、24 h、48 h、72 h后取样检测总氮(TN)、氨氮、硝态氮和亚硝态氮浓度,选取脱氮效果良好的菌株。
1.5 菌种鉴定
1.5.1 形态学鉴定
1.5.2 16 S rDNA分子鉴定
按SK8255(细菌)试剂盒操作说明提取基因组DNA。采用16S rDNA通用引物:27F(5’-AGTTTGATCMTGGCTCAG-3’) 和 1492R(5’-GGTTACCTTGTTACGACTT-3’);7F(5’-CAGAGTTTGATCCTGGCT-3’) 和 1540R(5’-AGGAGGTGATCCAGCCGCA-3’)进行PCR扩增。菌株由上海生工生物完成16S rDNA分子鉴定。将16S rDNA序列结果在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)中进行比对,搜索相似性较高的模式菌株及其基因序列。
1.6 生长曲线的测定
目标菌液(OD600约1.0)按5%体积比接种于液体培养基中,在30 ℃、180 r/min摇床中培养,定期取样测定菌液在600 nm处吸收值,绘制生长曲线。
2 结果与分析
2.1 好氧活性污泥微生物结构丰度分析
如图1所示,硫酸新霉素制药废水的好氧活性污泥中优势菌为变形菌门(47.85%),可能存在4种变形菌:β-变形菌(Betaproteobacteria),22.46%;γ-变形菌(Gammaproteobacteria),12.01%;ɑ-变形菌(Alphaproteobacteria),8.84%;δ-变形菌(Deltaproteobacteria),3.97%。

图1 活性污泥中的微生物群落分类学系统树状图
2.2 硝化细菌的筛选
2.3 细菌分离鉴定
2.3.1 形态学观察
3株细菌的主要形态学特点见表1。

表1 菌株的菌落形态特征
2.3.2 不同菌株对氨氮、亚硝态氮、总氮降解效果
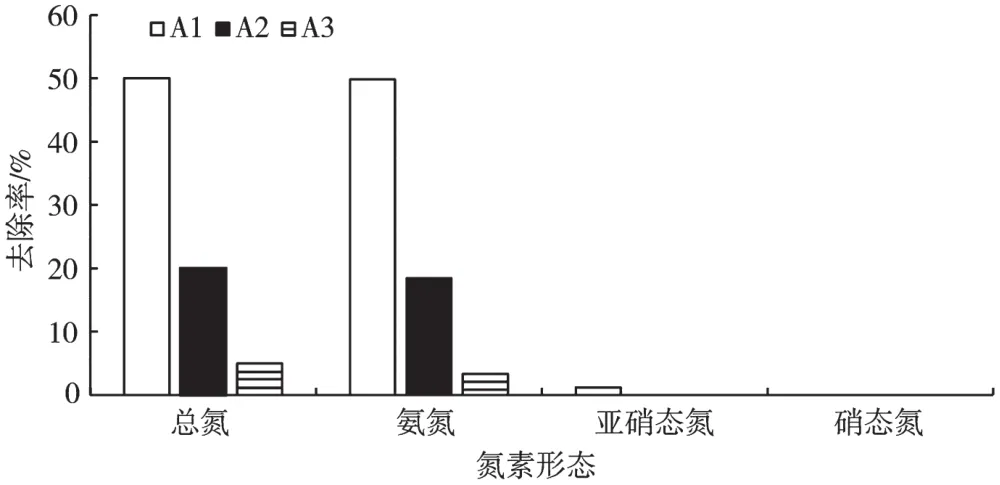
图2 不同菌株对总氮、氨氮、亚硝态氮和硝态氮的去除效果
2.3.3 优势菌株A1的染色鉴定
对目标菌株A1进行染色,结果显示为革兰氏阴性菌,呈短杆或球杆状,见图3。
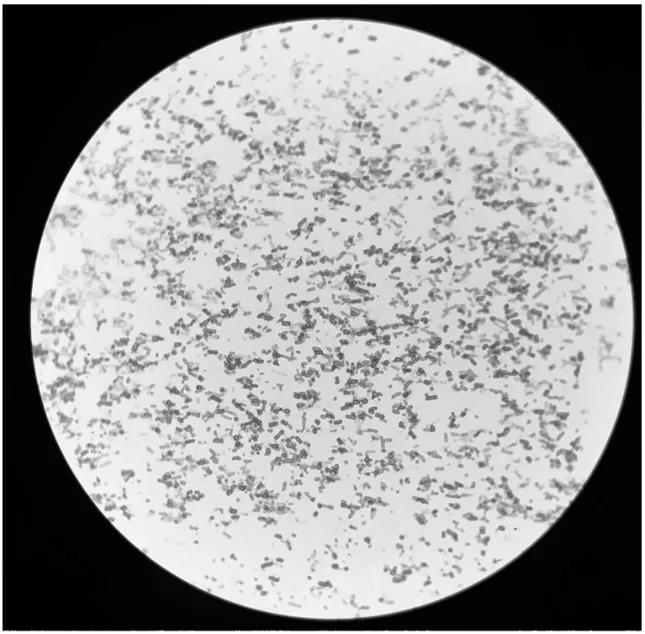
图3 菌株A1在显微镜下观察的形态结果
2.3.4 菌种鉴定
对目标菌株A1进行16S rDNA测序分析,发现与泛养副球菌(Paracoccus pantotrophus)DSM 2944的1号染色体完整序列相似性水平达到100%。结合菌株的形态学特征及菌种鉴定结果,确定其为泛养副球菌(Paracoccus pantotrophus),见表2。

表2 基于目标菌株16S rDNA 序列测定结果
2.4 菌株A1生长曲线测定
由图4可知,在培养初期细菌生长速率缓慢,12 h后进入对数生长期,48 h左右到达稳定期。

图4 菌株A1的生长曲线
3 结论
本实验对硫酸新霉素制药废水处理中的好氧活性污泥的微生物菌群结构采用宏基因组技术进行了解析。研究结果表明,从门水平而言,好氧污泥中细菌类型主要为变形菌门(丰度47.85%)和拟杆菌门(丰度11.77%),其中硝化螺菌属丰度为0.75%;通过宏基应组测序对主要差异物种进行解析,好氧污泥中丰度最高的变形菌门可能存在着4种变形菌属,分别为α-变形菌、丙型变形菌、β-变形菌、δ-变形菌;从污泥样本中分离筛选出3株具有硝化能力的菌株,其中菌株A1具有较好的硝化能力,经鉴定为泛养副球菌(Paracoccus pantotrophus),与污泥中高丰度菌门结果一致,A1除有明显脱氮效果外,还表现出反硝化功能。该研究发现对硫酸新霉素制药废水处理研究具有重要意义,今后将结合实际对菌株脱氮条件进行优化,为制药废水脱氮工程实践应用提供依据及经验。
