液晶液滴制备及其在生物检测领域的应用
2022-11-24杨秀秀杨忠强
杨秀秀,田 艺,杨忠强
(清华大学 化学系 有机光电子与分子工程教育部重点实验室,北京 100084)
1 引 言
液晶是介于液态和晶态之间的一种特殊物质形态,它既具有液态的流动性,又具有晶态的取向性,呈现光电学各向异性[1]。1998年,美国威斯康星-麦迪逊大学Nicholas L.Abbott课题组首次提出了液晶生物传感概念[2]。其检测原理在于液晶分子具有较大的长径比,可以形成长程有序的取向,而目标物会诱导局部液晶分子发生取向转变,继而被体相液晶放大至微米级别,在偏光显微镜下传导为肉眼可见的光学信号。例如,呈现特异的颜色、亮度和图案,从而实现对目标物的检测[3-5]。液晶独特的光学特性使其在开发简单、便携、免标记、免复杂仪器检测方面具有重要的研究价值。目前常用的液晶生物传感器根据使用液晶体系的不同主要分为3类:基于液晶-固体界面、液晶-水相界面和液晶液滴的生物传感器[6-7]。相较前两类体系,基于液晶液滴体系发展较晚,但因液滴具有较大的比表面积,加之液晶液滴独特的取向变化和光学性质,使其获得与日俱增的关注。本文综述了液晶液滴制备的研究进展及其在生物检测应用中的成果和发展趋势。
2 液晶液滴的取向
液晶检测常用的小分子液晶为4-氰基-4’-戊基联苯(5CB),如图1(a)所示,这是因为5CB在室温下具有向列相,并且市售易获得。液晶液滴有两种常见取向,例如在液滴两极出现点缺陷的两极取向和液滴中心出现点缺陷的径向取向,其取向示意图如图1所示[8]。已有研究表明,液晶液滴的大小会显著影响液晶液滴的点缺陷和取向,对于直径大于3 μm的液晶液滴,呈现两极取向(图1(b)~(d));而对于直径约为700 nm的小液晶液滴,呈现径向取向(图1(e)~(g))[8]。另一方面,一些化学和生物物质在液晶液滴表面的吸附和反应可能改变液晶液滴表面锚定能和内部液晶弹性能,诱导液晶液滴取向发生转变[6]。例如,当两亲分子在液晶表面吸附,液晶液滴会发生由两极取向至径向取向的转变[8-9]。使用偏光显微镜或者流式细胞仪对液晶液滴两极和径向取向的光学信号转变进行监测,即可实现检测的目的。

图1 液晶分子结构及液晶液滴取向示意图。(a)液晶5CB的分子结构;(b)、(c)两极取向,(e)、(f)径向取向及两种取向对应的示意图(d)、(g);(b)、(e)液晶液滴在偏光显微镜下的图像;(c)、(f)液晶液滴在明场下的光学显微图像。比例尺为5 μm[8]。Fig.1 Structure of liquid crystal(LC)molecule and ori⁃entation of LC droplets.(a)Molecule structure of 5CB;(b,c)Bipolar orientation,(c,f)radial orien⁃tation and their corresponding schematic figures(d)and(g);(b),(e)Polarized light microscopy images;(c),(f)Bright field optical microscopy images.The scale is 5 μm[8].
值得一提的是,液晶液滴的取向受尺寸大小影响,并且液晶液滴尺寸具有均一性是保证液晶液滴取向发生同步转变的关键,所以液晶液滴的制备方法会影响其检测性能。另外,由于液晶分子本身对目标物不具有特异识别能力,因此,需要对液晶液滴表面进行特殊修饰,赋予其特异响应性。综上,如何可控制备具有精确尺寸和表面化学的液晶液滴成为提高液晶液滴传感器检测性能的关键。
3 液晶液滴的制备
3.1 超声法制备液晶液滴
2006年,Nicholas L.Abbott课题组首次报道了利用超声的方法,实现了液晶液滴的制备[10]。将5CB和水溶液按1∶100体积比混合,10 W超声处理60 s,即得到了液晶液滴乳液。该工作选取纯水和带正电荷的磷脂水溶液(700 μmol/L 1,2-二月桂酰基-sn-甘油基-3-乙基磷酸胆碱(DLEPC))作为分散剂,所用物质的分子结构如图2所示。由此制备的液晶液滴乳液分别记作5CB-H2O和5CB-DLEPC。
上述得到的液晶液滴,尺寸范围为1~10 μm。在5CB-H2O液滴界面上的液晶分子维持平行取向,液晶液滴呈现两极取向(图2(b))。而对于分散剂为两亲分子DLEPC的液晶液滴体系,DLEPC的疏水烷基链可以插入液晶相中,诱导液晶分子形成垂直于界面的取向,使液滴呈现径向取向(图2(c))。另外,一些体积较大、且自身有强组装作用的两亲分子,为促进其在液晶液滴表面的吸附,有报道采用大功率的针尖超声法混合处理液晶和两亲分子,获取尺寸范围在1~5 μm的两亲分子修饰的液晶液滴[11-12]。总之,超声法制备液晶液滴,操作简单,但是液晶液滴尺寸不够均一。
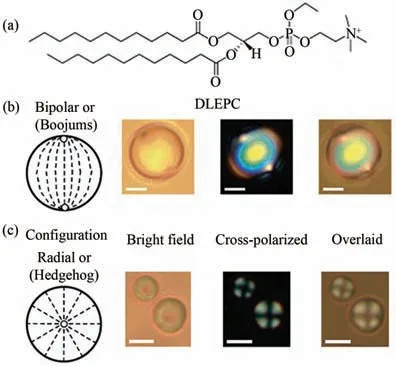
图2 (a)DLEPC的结构式;(b)5CB-H2O液晶液滴和(c)5CB-DLEPC液晶液滴的取向示意图和光学显微照片。比例尺为2 μm[10]。Fig.2(a)Structure of DLEPC;Schematic illustrations and optical micrographs of(b)5CB-H2O emulsions and(c)5CB-DLEPC emulsions.The scale bar is 2µm[10].
3.2 超声涡流法制备液晶液滴
为了提高液晶液滴的尺寸单分散性,2011年,Nicholas L.Abbott课题组利用连续超声和涡流处理制备液晶液滴[9]。首先将2~10 μL液晶加入到1 mL缓冲溶液中,进行10 s的超声处理,然后在2 500 r/min的涡流条件下处理10 s,经过12个循环后即得到乳白色液晶液滴乳液。该体系中的液晶液滴具有两极取向,直径大约4~8 μm。该方法与之前方法相比,所获得的液晶液滴均一性有所提高,且操作相较于后续介绍的微流控和胶囊模板法简单,但仍未能达到尺寸单分散分布。
3.3 微流控法制备液晶液滴
随着微流控技术的逐渐发展,使用微流控法制备液晶液滴的技术也获得越来越多的关注。早在2000年,美国西北大学David A.Weitz课题组首次实现利用简易微流控装置制备出液晶液滴[13]。2011年,韩国庆北大学Soo-Young Park课题组利用改进的微流控法成功制备出用于生物检测相关的液晶液滴,其微流控装置如图3所示[14]。该工作使用质量分数为0.2%聚(1丙烯酸-b-4-氰基联苯-4-氧十一烷基丙烯酸酯)(PAA-b-LCP)溶液作为连续相,5CB作为分散相。连续相从两侧通道进入,分散相由中间通道进入,两相在交汇处相遇,形成由PAA-b-LCP包裹的液晶液滴(图3(a))。通过控制连续相和分散相的流速,则能得到具有不同尺寸(33~50 μm)且尺寸较均一的液晶液滴(图3(b)~(d))。

图3 (a)利用微流控装置得到液晶液滴的示意图;在控制通道内连续相的流速为(b)0.2、(c)0.15和(d)0.1 mL·h-1和分散相流速为0.01 mL·h-1条件下得到液晶液滴的图像。比例尺为100 μm[14]。Fig.3(a)Schematic illustration of the formation of LC droplets through microfluidic system;LC droplets in the channel were made at flow rates of(b)0.2,(c)0.15,and(d)0.1 mL·h-1 of the continuous phase with a constant flow rate of the dispersed phase of 0.01 mL·h-1.Scale bar is 100 μm[14].

综上所述,微流控法制得的液晶液滴尺寸可调、分散窄,同时微流控技术具有快速分析、易集成和重复性好等优点,使其在液晶传感领域显示出巨大的应用前景[15]。但是,在微流控体系中,液体的流动会对液晶取向产生干扰。其次,微流控方法仍然难以制备小尺寸液晶液滴(<10 μm)。
3.4 胶囊模板法制备液晶液滴
针对缺乏精确可控制备小尺寸(<10 µm)单分散液晶液滴的方法,以及裸露的液晶液滴存在聚并和粘附等问题,在2008年,澳大利亚墨尔本大学Frank Caruso课题组报道了一种基于层层自组装模板法制备液晶液滴的策略,实现了小尺寸液晶液滴的可控制备[16]。
首先以直径约为5 μm的二氧化硅颗粒为模板,将其表面接枝3-氨丙基三乙氧基硅烷(APTS)实现胺官能化修饰。随后,将聚电解质多层膜(PEMs)层层组装到APTS官能化的二氧化硅颗粒表面。之后,利用氢氟酸将二氧化硅颗粒刻蚀掉,得到空心的PEMs胶囊。最后,将5CB渗透到PEMs胶囊中,即得到了PEMs包裹的液晶液滴(图4(a))。
该工作研究了两种类型的PEMs胶囊:聚(4-苯乙烯磺酸钠)(PSS)和聚烯丙胺盐酸盐(PAH)组成的PEMs,及聚甲基丙烯酸(PMA)和聚乙烯基吡咯烷酮(PVPON)组成的PEMs。因为APTS官能化的二氧化硅带正电荷,因此,首先使用带负电荷的阴离子聚电解质(PSS或PMA)作为第一层,PAH或PVPON作为第二层,以此类推,层层组装。该方法可通过改变二氧化硅模板的大小,得到纳米/毫米尺寸的单分散液晶液滴。另外,PMA/PVPON层还可以通过暴露在pH 7.5的溶液中破坏体系中氢键,以去除PEMs层,得到“裸”液晶液滴(图4(b)、(c))。

图4 (a)用于制备单分散液晶液滴的方法示意图;(b)由二氧化硅颗粒模板制备的5CB-填充的(PMA/PVPON)4胶囊和(c)将PMA/PVPON层解组装后获得的5CB液滴在明场下的光学显微照片[16]。Fig.4(a)Schematic representation of the procedure used to prepare monodisperse emulsion droplets;Bright field optical micrograph of(b)5CB-filled(PMA/PVPON)4 capsules made from silica particles tem⁃plates and(c)naked 5CB droplets obtained after disassembly of PMA/PVPON layers[16].
该工作首次提出具有尺寸和表面化学可控的液晶液滴制备方法。液晶液滴表面包裹的半渗透性胶囊壳既可以阻止液滴聚并,又可以通过官能化进而实现液晶液滴的定点锚定。基于PEM选择的多样性,该制备方法有助于后续生物响应性液晶液滴传感器的设计。
3.5 超重力技术制备液晶液滴
上述液晶液滴的制备方法均受限于小量的实验体系,不能满足尺寸小、分布窄液晶液滴大量制备的需求。为此,在2017年,中国清华大学Zhongqiang Yang课题组提出利用超重力技术实现大量、单分散液晶液滴快速、简易的制备[17]。利用超重力机制备液晶液滴的实验装置如图5所示。其工作原理是在超重力环境中,使两相在多孔介质或孔道中产生流动接触,利用由此形成的巨大剪切力将液体撕裂成微纳米级的膜、丝和滴,并不断重复该过程,直至形成粒径约为950 nm的液晶液滴。该方法与上述几种制备方法相比,可以保证液晶液滴具有较好的均一性,制备出大量液晶液滴。该工作为液晶液滴的简易、可控制备提供了一个新的技术平台,有望满足液晶液滴乳液领域工业化生产的需求。

图5 超重力机实验装置示意图及其制备出的液晶5CB液滴的偏光图像[17]Fig.5 Schematic illustration of the high gravity equip⁃ment setup and 5CB droplets prepared by high gravity technique under polarized light[17]
4 液晶液滴生物传感器的检测应用
对于液晶液滴,一些两亲分子在液晶液滴的吸附可以诱导液晶液滴发生由两极取向至径向取向的转变,此时,若向体系中加入可以将两亲分子解组装的分子,则液晶液滴会出现由径向取向至两极取向的转变[18]。利用上述液晶液滴的取向转变,即可实现对特定目标物的检测。例如,目前通过液晶液滴生物传感器已经实现了对细菌、病毒、蛋白质以及生物分子间相互作用的检测[9,19-23]。
4.1 液晶液滴检测和区分细菌和病毒
2009年,Nicholas L.Abbott课题组报道了利用液晶液滴实现了对不同类型的细菌(革兰氏阴性和阳性细菌)和病毒(包膜和非包膜型)的检测区分[19]。该工作中使用PMA/PVPON胶囊模板法制备得到液晶液滴,随后通过将液滴置于pH 7.5的溶液中除去PMA/PVPON外壳,得到尺寸约为4.7 μm的裸液晶液滴。研究发现,如图6所示,当裸液晶液滴与大肠杆菌(革兰氏阴性细菌)和A/NWS/Tokyo/67(包膜型病毒)接触后,会发生由两极取向至径向取向的转变(图6(a)、(c)和(f));而当液晶液滴与枯草芽孢杆菌和黄体微球菌(革兰氏阳性细菌)以及M13辅助噬菌体(非包膜型病毒)接触后,液晶液滴保持两极取向(图6(b)、(d)、(e)和(g))。研究发现,当革兰氏阴性细菌和包膜型病毒与液晶液滴接触后,其表面的两亲性磷脂会迁移并吸附到液晶液滴表面,由此诱导液晶液滴发生取向转变。该体系中的液晶液滴可以灵敏地响应出浓度低至104pfu·mL-1的病毒。该研究结果为检测、区分细菌和病毒提供了一种新方法。

图6 病毒和细菌与裸液晶液滴相互作用以及对应液晶液滴取向的示意图。(a)径向取向;(b)两极取向;在偏光显微镜下,液晶液滴与(c)大肠杆菌、(d)枯草芽孢杆菌、(e)黄体微球菌、(f)A/NWS/Tokyo/67病毒和(g)M13辅助噬菌体接触后的图像[19]。Fig.6 Schematic of the interaction of viruses or bacteria with naked liquid crystal emulsions.The cartoons depict of(a)radial and(b)bipolar configurations of LC droplets;Polarized light microscopy image of naked 5CB droplets with(c)E.coli.,(d)B.subtilis,(e)M.luteus,(f)A/NWS/Tokyo/67 and(g)M13 helper phage[19].
2011年Nicholas L.Abbott课题组进一步提出利用液晶液滴对大肠杆菌内毒素进行实时、高灵敏的检测[9]。内毒素是一种存在于革兰氏阴性细菌细胞壁中的细菌脂多糖,对宿主具有毒性,其主要成分为磷脂A(图7(a))。当前通常使用“鲎试剂”方法实现对内毒素的检测,但是该方法重复性差且危害鲎生物资源等。

图7 (a)内毒素的主要组成磷脂A;(b)、(c)液晶液滴在无内毒素时,分别处于明场和偏振光下的显微图像及其(d)对应的两极取向示意图,红色箭头表示液晶液滴在液晶-水相界面处的缺陷;(e)和(f)在含有1 μg/mL内毒素的溶液中,液晶液滴分别处于明场和偏振光下的显微图像及其(g)对应的径向取向示意图[9]。Fig.7(a)Lipid A portion of endotoxin;(b)Bright-field and(c)polarized light micrographs of an LC droplet in endotox⁃in-free water and(d)corresponding schematic illustration of the bipolar configuration.The red arrows indicate boojums at the aqueous-LC interface of the droplet;(e)Bright-field and(f)polarized light micrographs of an LC droplet after exposure to endotoxin from E.coli(1 μg/mL)in water and corresponding(g)schematic illustration of the radial configuration[9].
为解决上述问题,该工作通过超声涡流法制备得到直径为4~8 μm的液晶液滴,其在明场和偏光显微镜下呈现两极取向(图7(b)~(d))。随后在水中加入浓度为1 μg·mL-1来自大肠杆菌的内毒素后,液晶转变为径向取向(图7(e)~(g))。该研究还发现液晶液滴的尺寸在大肠杆菌内毒素诱导液晶液滴由两极缺陷至中心缺陷的转变起着重要的作用。其中,直径大于10 μm的液晶液滴对pg·mL-1浓度下内毒素的存在不敏感,维持两极缺陷;而直径处于2~6 μm区间的液晶液滴对pg·mL-1浓度下的内毒素取向转变响应率超过90%。进一步通过使用氟化硼二吡咯(BODIPY)标记大肠杆菌内毒素的方法证实了内毒素位于液晶液滴的中心缺陷处,并且在短短数十秒内,液晶液滴表面的磷脂A即可迁移至液滴中心。这表明液晶取向的转变是由大肠杆菌内毒素在液滴缺陷处驱动的。该方法对大肠杆菌内毒素的检测灵敏度,比由表面锚定能量变化驱动液晶取向转变的液晶-水相平面体系高出6个数量级。并且,与鲎试剂法相比,该工作利用液晶液滴检测内毒素,具有免标记、快速、生态友好且易操作等优点[24]。
上述液晶液滴体系检测的大肠杆菌需要使用偏光显微镜对大量单个液晶液滴进行成像观察,该过程繁琐且耗时。因此,2021年Nicholas L.Abbott课题组与美国威斯康辛-麦迪逊大学Victor M.Zavala课题组合作,将液晶液滴传感器与机器学习方法结合,实现了对内毒素不同细菌来源的分类及定量[25]。来自不同细菌的内毒素可能具有不同的磷脂A结构,例如来自铜绿假单胞菌、大肠杆菌和明尼苏达沙门氏菌的磷脂A分别具有5条、6条或7条疏水的碳链。内毒素的不同结构会影响液晶液滴的取向转变行为,由此导致液晶取向变化带来的光侧散射强度和前向散射强度不同。通过流式细胞仪测量液晶液滴的光散射数据,结合机器学习技术,从而实现在8个数量级(0.01 pg·mL−1~1 μg·mL−1)范围内对细菌来源的分类和内毒素浓度的定量,有望应用于水质监测。该工作不仅提供了一种简单、精确的内毒素检测方法,而且将液晶体系与机器学习技术结合,实现高效、精确的数据处理[26-27]。
2020年,美国威斯康辛-麦迪逊大学David M.Lynn课题组报道了利用液晶液滴实现对细菌群体感应信号和毒性的监测[20]。许多细菌往往通过化学信号实现群体感应来调整群体行为,这些化学信号的强度在一定范围内会随着细菌群落的尺寸成比例增加。因此,若能实现对特定细菌化学信号的检测,就能实现对细菌群体感应和毒性的监测。该工作以致病性革兰氏阴性细菌铜绿假单胞菌产生的具有两亲性的化学信号分子N-酰基-l-高丝氨酸内酯(AHL)为研究对象,探索液晶液滴对其响应性。首先通过涡流法制备得到尺寸小于10 μm的液晶液滴,随后利用流式细胞仪测量液晶液滴侧散射强度与前向散射强度来确定液晶液滴取向。研究发现AHL可以吸附在液晶液滴表面,诱导液晶发生由两极取向至径向取向的转变(图8(a)),表明液晶液滴可以对细菌生长培养物产生的AHL做出响应性。随着细菌产生AHL的量不断增加,发生取向改变的液晶液滴百分比也不断增加(图8(b))。该研究结果表明,液晶液滴体系为细菌群体感应和毒性的检测以及细菌群落的原位监测提供了一个新平台。

图8 (a)利用液晶液滴实现对细菌群体感应检测的示意图;(b)液晶液滴在37°C下培养6 h(白色条带)、12 h(黑色条带)和24 h(灰色条带)90 min后从两极取向转变为径向取向的百分比。第I-VI列显示了使用LB培养基对照(I)或使用指定菌株和条件的结果。结果是3个独立实验的平均值[20]。Fig.8(a)Schematic illustration of using LC droplets to sense bacterial quorum;(b)Percentage of LC drop⁃lets transformed from bipolar to radial after 90 min of incubation with cultures grown at 37 °C for 6 h(white bars),12 h(black bars),and 24 h(gray bars).Columns I~VI show results of using an LB medium control(I)or using the indicated bacterial strains and conditions.Results are the average of 3 independent experiments[20].
4.2 液晶液滴检测酶活性
2009年,Nicholas L.Abbott课题组利用磷脂L-二棕榈酰磷脂酰胆碱(L-DLPC)修饰的液晶液滴实现对磷脂酶A2(PLA2)的酶活性检测[28]。该实验过程如图9所示,首先通过模板法制备了直径约为8.0 μm的液晶液滴,然后两亲性磷脂自发吸附到液晶液滴表面,诱导液晶液滴由两极取向转变为径向取向。再将上述L-DLPC修饰的液晶液滴与PLA2混 合 后,PLA2将L-DLPC水解导致其在液晶液滴表面解吸附,引起液晶液滴发生由径向到两极取向的转变,实现对PLA2酶活性的检测。与之前报道的基于液晶-水相平面界面的检测体系相比,液晶液滴体系对PLA2的响应速度提高了约5倍[21]。

图9 (a)L-DLPC修饰的5CB液滴(直径8.0 μm)分散在TBS缓冲液(pH 8.9,5 mmol/L CaCl2)中,与1 nmol/L浓度的PLA2接触,经历从径向到两极取向转变的示意图;(b)、(c)液晶液滴在与1 nmol/L PLA2接触后,取向转变过程中在明场和偏光显微镜下对应的图像[28]。Fig.9(a)Schematic illustration of process by which L-DLPC-decorated 5CB droplets(diameter of 8.0 μm)dispersed in TBS buffer(pH 8.9,5 mmol/L CaCl2)in contact with 1 nmol/L con⁃centration of PLA2 undergo anchoring transitions from radial to bipolar configurations;(b),(c)Cor⁃responding bright-field,and polarized images indi⁃cated changes in the optical appearance of the LC droplets in contact with 1 nmol/L PLA2[28].
2014年,中国淡江大学Chih-Hsin Chen课题组报道了利用寡肽修饰的液晶液滴检测蛋白酶活性[29]。该工作首先设计了含有酶切位点的两亲性寡肽,让其吸附在液晶液滴表面,诱导液晶液滴形成径向取向。随后将液滴与蛋白酶接触,酶解作用破坏了两亲性寡肽在液晶液滴表面的吸附,导致液滴恢复两极取向,由此实现了对α-糜蛋白酶和胰蛋白酶等丝氨酸蛋白酶的检测。2019年,Zhongqiang Yang课题组报道了通过设计两亲性多肽,利用液晶液滴实现对胰蛋白酶的检测[30]。该工作不仅为构建多肽修饰的液晶液滴提供了简单、通用的方法,而且可以通过设计合成特定多肽序列,实现对特定酶活性以及生物分子间相互作用的检测。
以上利用液晶液滴检测酶活性的方法都是基于酶解反应破坏两亲分子在液滴表面的吸附,诱导液晶液滴发生取向变化实现的。除此之外,还可以利用酶解反应引起环境pH的变化,间接影响两亲分子在液晶液滴表面的吸附,进而诱导液晶取向发生转变。目前已经实现对溶血素、青霉素酶等酶活性的检测[31-32]。
4.3 液晶液滴检测蛋白及分子间相互作用
液晶液滴体系还可用于蛋白-蛋白相互作用的研究。2011年,新加坡国立大学Kun-Lin Yang课题组首次报道了将液晶液滴传感器与抗原-抗体相互作用结合,实现蛋白免疫分析[22]。该工作选择了抗人免疫球蛋白G(AIgG)和抗人血清白蛋白(AHSA)作为模型抗体。首先将液晶5CB与聚乙烯亚胺(PEI)溶液混合,通过涡流法制备尺寸约为61 μm的PEI修饰的液晶液滴。接着将戊二醛(GA)通过静电作用吸附到包裹PEI的液晶液滴表面,以此引入后续固定抗体蛋白的醛基。最后将GA修饰的液晶液滴与一定浓度IgG或HSA混合培养一段时间,GA与蛋白形成酰胺键共价连接,即得到两极取向的、IgG或HSA修饰的液晶液滴。两亲分子Tween 20可以吸附到液晶液滴表面,诱导液晶液滴呈现径向取向(图10(a))。
在Tween 20存在的条件下,将IgG修饰的具有径向取向的液晶液滴与一定浓度的AIgG接触后,IgG与AIgG的结合会干扰吸附在液滴表面的Tween 20,导致液晶液滴由径向取向转变为两极取向(图10(b)和(c))。而将IgG修饰的液晶液滴与AHSA接触后,由于IgG与AHSA之间不会发生特异性结合,Tween 20依然稳定地吸附在液晶液滴表面,液滴的径向取向不会改变(图10(d))。若要实现对AHSA的检测,则可选择与其有特异性结合的HSA修饰的液晶液滴。以上实验通过液滴取向的转变,实现对特定蛋白的检测,最低响应浓度低至0.01 μg·mL-1AIgG和0.02 μg·mL-1AHSA。该工作首次提出利用液晶液滴实现蛋白免疫分析,与传统需要蛋白质标记或复杂免疫分析仪器相比,该方法具有简单、免标记的优势。后续研究将AIgG修饰在液晶液滴表面,实现对IgG的检测[33-34]。上述工作表明,通过选择合适的抗原、抗体,利用液晶液滴传感器可实现对一系列蛋白的特异性检测,为开发简易、便携式和低成本的免疫分析提供了新平台。

图10 (a)对液晶液滴进行化学修饰和蛋白固定的示意图;IgG修饰的液晶液滴在加入AIgG(b)之前和(c)之后,以及(d)加入AHSA之后,在偏光显微镜下的图像[22]。Fig.10(a)Schematic illustration of the LC droplet dur⁃ing chemical functionalization and protein immo⁃bilization;Polarized light images of LC droplets:IgG-LC droplets(b)before and(c)after the ad⁃dition of AIgG,(d)IgG-LC droplets after the addition of AHSA[22].
2015年,Soo-Young Park课题组报道了利用微流控法制备PAA-b-LCP修饰的液晶液滴,用以研究抗生物素和生物素之间的相互作用[35]。后续还有利用液晶液滴研究膜相关细胞色素c与线粒体心磷脂之间相互作用的研究[36]。
目前,液晶液滴除了检测特定蛋白、研究蛋白间相互作用,还可用来研究蛋白的二级结构。2019年,印度科学教育研究所Santanu K.Pal课题组报道了利用聚赖氨酸(PLL)修饰的液晶液滴研究纤维连接蛋白在液滴表面的不同二级结构[23]。修饰在液晶液滴表面带正电荷的PLL可以与带负电荷的纤维连接蛋白产生一定的相互作用,诱导其发生二级结构的变化,聚集形成纤维样蛋白,同时伴随着液滴由径向到两极取向的转变。如果在体系中加入钙离子,则可以阻断纤维连接蛋白和PLL相互作用的位点,使得蛋白无法发生聚集,从而保持液晶液滴的两极取向。该工作首次提出将液晶液滴体系用于研究蛋白的二级结构变化,不仅为蛋白质的聚集化检测提供了一个新的方法,还加深了蛋白在界面相互作用的理解。
4.4 细胞可穿戴的液晶液滴传感器及细胞环境的检测
2013年,Nicholas L.Abbott课题组首次报道了细胞可穿戴的液晶液滴传感器[37]。
首先,制备直径约为6.5 μm的PEI/聚(4,4-二甲基氮内酯)(PVDMA)胶囊,随后灌入液晶E7,即得到了部分填充的液晶胶囊。细胞实验证明,单个细胞表面可以通过静电作用沉积、吸附多个液晶胶囊。这些固定在细胞表面的液滴呈现两极取向,加入50 μmol/L有细胞毒性的小分子阳离子型表面活性剂溴化十六烷基三甲铵(HTAB)后,HTAB可以穿过胶囊外壳,吸附到液晶液滴表面,诱导液晶由两极取向转变为径向取向(图11)。上述结果表明,固定在细胞上的液晶胶囊可用于实时检测细胞培养环境中是否存在细胞有害物质,为在单细胞水平实时、局部监测化学环境提供了新方法。

图11 (a)将填充液晶的胶囊锚定到细胞上的示意图;(b)、(c)加入HTAB后0和3 min时,液晶胶囊在偏光显微镜下的图像,其中HTAB沿着左下方箭头指示的方向缓慢扩散。比例尺为10 μm(放大图中比例尺为5 μm)[37]。Fig.11(a)Schematic illustration of LC-filled capsules are anchored to cells;Polarized light images of(b)and(c)capsule-decorated cells after 0 and 3 min addition of HTAB.Experiment in which HTAB was allowed to diffuse slowly along the direction indicated by arrows in lower left.Scale bars are 10 μm(5 μm for insets)[37].
2019年,中国清华大学Jin-Ming Lin课题组在液晶E7中掺杂4-戊基-4’-联苯羧酸(PBA),并封装在PSS和聚烯丙基胺(PAAM)聚合物微胶囊中,得到尺寸为2~3 µm的液晶液滴[38]。然后将其固定在细胞上,用以研究人脐静脉内皮细胞、骨髓瘤细胞、人原发性胶质母细胞瘤细胞、人结肠癌细胞和人乳腺癌细胞释放NH3的情况。当体系在生理pH下时,E7中掺杂的PBA会自组装在液晶-水相界面上,脱质子的羧基留在水相中,而疏水部分嵌入E7中,诱导液晶液滴形成径向取向。然而当体系中有NH3存在时,其与羧基的结合降低了液晶-水相界面的电荷密度,影响PBA在液晶液滴表面的组装,从而诱导液晶液滴转变为两极取向。不同细胞释放NH3的量不同,直接影响液晶液滴取向的转变速度,因此该体系可用于区分细胞系和探索细胞异质性。通过进一步设计,该方法可扩展到细胞微环境中其他物质的检测,在生物医学研究中具有潜在应用价值。
除了将液晶液滴固定在细胞表面,对细胞外环境进行监测,还可将液晶液滴通过细胞内化,实现对细胞内环境的检测[39]。2021年,David M.Lynn课题组报道了使用模板法制备尺寸约为5 µm、填充液晶E7的液晶液滴。随后以HeLa细胞和3T3细胞作为模型细胞系,将液晶液滴加入细胞培养基中,发现3T3细胞可以将液晶液滴内化。被内化的液晶液滴未显示出细胞毒性,并且液晶液滴可以维持两极取向。在细胞外环境加入和除去表面活性剂Triton X-100后,细胞内部的液晶液滴可以快速、可逆地进行取向转变的响应。该工作为实时监测细胞内环境提供了新思路和新平台。
4.5 液晶液滴传感器用于其他生物分子的检测
2017年,Santanu K.Pal课题组研究了DNA与吸附在液晶液滴表面的PLL之间的相互作用,并实现了对DNA的检测[40]。首先,通过超声法,制备了尺寸约为10~40 µm的液晶液滴,PLL在液晶液滴表面吸附并诱导液晶液滴呈现径向取向。随后向其中加入单链或双链DNA,DNA与PLL的静电吸引作用可以进一步诱导液晶液滴发生向两极取向的转变,其可能与DNA-PLL复合物的形成有关。该工作中构建的液晶液滴传感器虽然对DNA具有响应性,但是由于DNA与PLL之间静电吸引作用不具有特异性,因此体系无法区分DNA单、双链,也无法利用DNA碱基互补配对实现对特定序列DNA单链的检测。
2022年,Zhongqiang Yang课题组将DNA纳米技术的可编程性与液晶液滴的传感特性相结合,构建了具有特异响应性的DNA修饰的液晶液滴[12]。首先将DNA与含有18个碳的疏水烷基链共价连接,得到两亲分子DNA-C18。随后,通过大功率的针尖超声法处理DNA-C18和液晶5CB的混合物,得到尺寸在1~5 µm DNA-C18修饰的液晶液滴。其中,DNA-C18的疏水烷基链插入液晶相中,亲水的DNA向外伸展在水相溶液中。与以往报道的两亲分子诱导液晶液滴产生径向取向不同,DNA-C18修饰后的液晶液滴仍保持两极取向,其可能与DNA-C18在液晶液滴表面较低的修饰密度有关。利用DNA序列的可编程性,针对两亲分子DNA-C18中的DNA部分,该工作设计并合成了具有特异识别功能的DNA核酸适配体(DNA aptamer)序列,得到具有特异响应性的液晶液滴。当体系加入与DNA aptamer有特异作用的待检测物后,DNA-C18修饰的液晶液滴发生聚集或者分散,以此实现对Hg2+、凝血酶和DNA酶等物质的特异性检测。结合DNA aptamer技术的发展,该体系有望对更多化学/生物分子进行特异性检测[41-42]。
2013年,Soo-Young Park课题组通过构建具有pH响应的、PAA-b-LCP修饰的液晶液滴,实现对葡萄糖的检测[43]。由于PAA在不同pH下具有特定构象,诱导PAA-b-LCP修饰的液晶液滴在pH较高时(pH=12)呈现径向取向,而在pH较低时(pH=2)呈现两极取向,实现液晶液滴对pH的响应。将葡萄糖氧化酶(GOx)共价固定到PAA链上后,通过GOx氧化葡萄糖前后的pH变化带来液晶光学信号的改变,即可实现在3 min内对浓度低至0.03 mmol/L葡萄糖的检测。该液晶传感器与已有报道的针对葡萄糖检测的其他生物传感器相比,具有成本低、简单及光学信号肉眼可见等优点,有望未来应用于人体葡萄糖水平的监测。
此外,液晶液滴传感器还被用于检测乙酰胆碱酯酶(AChE)抑制型农药[44-45]、胆酸[11,46-47]和尿素[48]等。
5 液晶液滴复合材料的制备及其在生物传感中的应用
为了提高传统液晶液滴溶液体系的便携性和材料成型问题,2016年,美国中佛罗里达大学Jiyu Fang课题组将液晶液滴嵌入水凝胶膜材料中,通过引入水凝胶体系的成型性和生物分子可渗透性等特点,实现了对肝脏和肠道疾病临床诊断的生物标志物脱氧胆酸(DCA)和胆酸(CA)的免标记检测[49]。
首先通过针尖超声法得到尺寸在1~5 μm、壳聚糖(CHI)稳定的5CB乳液。之后加入十四烷基硫酸钠盐(SC14S),其带负电荷的亲水头通过静电作用留在带正电的CHI层中,而疏水尾部则插入液晶液滴中诱导液滴形成径向取向。随后将乳液灌注在玻璃基底上形成乳液膜,再将其浸入AgNO3溶液中。通过Ag+触发CHI的凝胶化反应,形成镶嵌液晶液滴的CHI水凝胶膜(图12),并且凝胶化过程不会改变液晶液滴的取向。所得的镶嵌液晶液滴的水凝胶膜抗拉强度约为125 kPa,杨氏模量约为64 kPa。具有良好机械性能的水凝胶膜可被切割成所需形状和尺寸,用于后续检测实验。

图12 (a)液晶5CB和CHI的化学结构式;(b)~(e)向CHI/SC14S复合稳定的5CB乳液中添加Ag+,以触发凝胶化而形成镶嵌5CB液滴的水凝胶膜的过程示意图[49]。Fig.12(a)Chemical structures of 5CB and CHI;(b)~(e)Schematic illustrations of the formation process of 5CB dropletembedded CHI hydrogel films by the Ag+ion-triggered fast gelation of CHI/SC14S-stabilized 5CB emulsion[49].
将镶嵌5CB液滴的水凝胶膜浸入200 μmol/L DCA溶液后,在偏光显微镜下可以观察到5CB液滴逐渐由径向取向转变为两极取向(图13(a)~(f))。该取向转变源于渗透到水凝胶中的DCA破坏/取代了SC14S在液滴表面的吸附。研究发现,镶嵌5CB液滴的水凝胶膜对DCA和CA的响应时间受待检测物的浓度和种类的影响。例如,在100 μmol/L的条件下,镶嵌5CB液滴的水凝胶膜对DCA的响应时间为30 s,而对CA则为4 min。利用该体系对DCA和CA响应性的不同,即可实现特异性定量检测(图13(g))。

图13 (a)~(f)将镶嵌5CB液滴的CHI水凝胶膜浸入200 μmol/L DCA溶液(a)0 s、(b)8 s、(c)12 s、(d)17 s、(e)20 s和(f)23 s后的偏光显微图像;(g)镶嵌5CB液滴的水凝胶膜对DCA和CA的响应时间随浓度变化的关系图[49]。Fig.13(a)~(f)Polarized microscope images of 5CB droplet-embedded CHI hydrogel sheets taken at 0 s(a),8 s(b),12 s(c),17 s(d),20 s(e)and 23 s(f)after the addition of 200 μmol/L DCA;(g)Response time of the embed⁃ded 5CB droplets as a function of DCA and CA concentrations,respectively[49].
该便携式镶嵌液晶液滴的水凝胶膜材料易制备、成本低、稳定性好、使用方便,为实时检测DCA和CA提供了新方法,未来可能应用于点对点检测和远程理疗中。
6 液晶液滴的表面固定及其应用
针对现有液晶液滴存在流动性、难以固定观察其取向等问题,2010年,Nicholas L.Abbott课题组设计了一种聚合物胶囊包裹的液晶液滴,其可通过弱/可逆离子相互作用或者强/共价相互作用锚定到基底表面,在复杂媒介或流动条件下依然保持体系稳定性[50-51]。
首先通过胶囊模板法制备以带正电的PEI为最外层、PEI/PVDMA聚电解质层层包裹的、直径约为4.9 μm的液晶液滴。该液晶液滴通过弱且可逆的阴阳离子相互作用固定到带负电的羧基官能化的基底表面。若用5 mol/L NaCl溶液对固定液晶液滴后的基底进行冲洗,液滴表面与基底间离子相互作用被破坏,导致液晶液滴从基底表面脱落。如果液晶液滴表面的伯胺与氨内酯官能化的基底表面反应,形成强的共价键而将液晶液滴固定在基底表面,在5 mol/L NaCl溶液或Triton X-100溶液冲洗的条件下,液晶液滴仍能稳定固定在基底上。另外,使用带正电的胺功能化的基底可以通过静电排斥作用防止带负电的液晶液滴在基底上的非特异性吸附。
为探究该固定化液晶液滴的长期保存性,研究人员进行了干燥实验。实验结果表明,大多数液晶液滴中的液晶在干燥时不会从聚合物胶囊中泄漏。并且液晶液滴至少可以干燥保存6个月,再次将其放入水环境中后,液晶液滴可以恢复其响应性,例如对水溶性两亲性分子十二烷基三甲基溴化铵(DTAB)做出取向转变响应(图14)。

图14 (a)将干燥的液晶液滴(红色)制备的“检测试纸”浸入待检测溶液(蓝色)的设计示意图;(b)~(e)将固定在玻璃基底上、干燥的液晶液滴浸没在5 mmol/L DTAB溶液(b)~(c)前和(d)~(e)后的明场和偏光显微镜光学图像[51]。Fig.14(a)Schematic illustration showing the design of LC droplet-based“test strips”consisting of dried caged LCs(red)that can be dipped into aqueous analyte solutions(blue);(b)~(e)Bright-field and polarized light microscopy images of dried caged LC droplets immobilized on a multilayer-coated glass chip before(b)~(c)and after(d)~(e)in⁃sertion into 5 mmol/L DTAB solution[51].
上述研究结果表明,聚合物胶囊包裹的液晶液滴可以通过静电作用或共价作用固定在基底表面。由此得到的固定化液晶液滴可以在干燥条件下长期保存,解决了液晶液滴在表征、稳定性和存储性等问题。同时,该工作为液晶液滴的锚定提供了新方法,将其检测应用范围扩展到复杂、流动的体系中,进一步提升其实际应用价值。
上述方法是采用非特异性相互作用固定液晶液滴,2022年,Zhongqiang Yang课题组则报道了利用DNA碱基特异性识别作用,实现液晶液滴在图案化基底表面的固定[12]。该工作首先通过针尖超声法得到DNA修饰的液晶液滴。结合微接触印刷技术,在基底特定图案处修饰DNA单链,随后加入与其序列互补的DNA修饰的液晶液滴,通过碱基互补配对作用实现液晶液滴的固定和图案化(图15)。液晶在液晶相和各向同性相之间的转变,赋予了图案温度响应性:在温度升至液晶相转变点以上时,液晶液滴在偏光显微镜下的明亮图案消失;温度降至转变点以下时,图案重现。另外,通过升高温度打开DNA双链的方法,将液晶液滴从基底表面除去,图案消失;降低温度,图案重现,实现图案的可重复印刷。该工作将液晶液滴与DNA序列可编程性、微接触印刷技术相结合,实现液晶液滴的图案化,为表面信息可视化、产品防伪提供了新方法。另外,结合DNA核酸适配体的发展,该工作为检测试剂盒的设计提供新思路。

图15 将DNA修饰的液晶液滴用于可重复图案印刷的示意图。(a)将DNA修饰的液晶液滴加到DNA修饰的金基底表面;(b)通过碱基互补配对固定在金基底上的液晶液滴形成特定图案以及(c)对应的偏光显微图像;(d)通过在60 °C下加热,破坏碱基互补配对,将形成的液晶液滴图像擦去及其(e)对应的、在室温下拍摄的偏光显微图像[12]。Fig.15 Schematic illustration of repeatable printing pat⁃terns with DNA modified LC droplets.(a)Add DNA modified LC droplets on the surface of DNA modified gold substrate;(b)Formation of specific pattern through the base-pair complemen⁃tation rule and(c)corresponding polarized image;(d)Experimental repeatability through breaking base-pair at 60 °C and(e)corresponding polarized image taken at room temperature[12].
7 结论与展望
近年来,基于液晶液滴的生物传感器得到了迅速发展,当前可以实现对以下几类生物相关的检测:(1)DNA和蛋白质等生物大分子;(2)病毒和细菌等微生物;(3)生物分子之间的相互作用;(4)酶抑制型农药、胆酸和尿素等生物相关小分子。并且,液晶液滴通过对表面的功能化,实现了液晶液滴在固体基底表面的固定化,解决了其表征、抗干扰和便携性等问题[12,50-51]。
然而,目前液晶液滴传感器仍面临着一些亟待解决的问题。首先,液晶液滴的检测灵敏度和准确性受液晶液滴尺寸大小和均一性的影响。当液晶液滴尺寸大于10 μm时,会显著降低液晶液滴的检测灵敏度。而当液晶液滴尺寸不够均一时,会导致液晶取向转变无法同步发生,给检测带来误差。因此,制备小于10 μm且尺寸均一的液晶液滴是提高液晶液滴检测性能的前提和基础。其次,因为液晶本身不具有对待检测物的特异性识别功能,因此,如何对液晶和液晶液滴界面进行通用、简单的特异性化学/生物修饰,赋予其特异响应能力,是当前研究的重点。同时,考虑到人眼难以快速、准确处理大量液晶光学图像,将液晶液滴传感器与深度学习技术结合,将进一步提升其精准性和实用性。最后,当前对于液晶液滴的制备,其尺寸的精确控制和大规模生产难以同时满足,需要进一步通过工程技术改进液晶液滴的制备工艺,推动其产业化发展。
