香菇多糖提取、结构和生物活性的研究进展
2022-11-23朱俊友李志佳董赵微王岸娜吴立根
朱俊友,李志佳,董赵微,王岸娜,吴立根
河南工业大学 粮油食品学院,河南 郑州 450001
香菇(Lentinulaedodes)属于真菌门、担子菌纲、伞菌目、口蘑科、香菇属真菌,主要在东亚特别是中国栽培。根据中国食用菌协会统计,中国在2020年香菇的产量达到1 188.21万t。香菇多糖(Lentinan)是从香菇子实体中获得的一类多糖物质,最早由Chihara 等[1]在1969年从香菇中分离得到,其分子量(Mw)位于0.53×105~17.6×105Da区间[2-5]。香菇多糖为白色粉末状固体,对光和热稳定,溶于水,尤易溶于热水,而不溶于甲醇、乙醇、丙酮、乙醚、乙酸乙酯等有机溶剂[6]。
香菇多糖具有良好的生物活性,包括抗肿瘤[1]、增强免疫[7]、抗氧化[8]、抗病毒[5]、抗副作用[9]、抗辐射[10]等作用,因此,备受医药健康领域研究者重视。多年来,许多学者研究了香菇多糖的提取、纯化并探索提高其提取率的不同方法。目前,应用最为广泛的香菇多糖提取方法为热水(60~100 ℃)浸提法[2,11-14],利用酶[15-16]、超声[17-19]、微波[20-21]、高压微射流[22-24]等辅助处理手段来提高香菇多糖的提取率,不同香菇多糖的单糖组成[11,25-26]、糖苷键构型[1,12,27]、糖苷键连接位置[11-12,28]、分支度[1,27-28]等结构形式存在差异,呈现出多种初级结构形式。然而,目前对香菇多糖高级结构的测定手段仍然有限;不同结构形式的香菇多糖其活性不同,分子量[29]、糖苷键类型[30]、三螺旋结构[31]和一些高温、超声、有机试剂等外在条件[28,32-33]对其活性都产生影响。作者综述了香菇多糖热水浸提法和多种辅助提取方法以及对其纯化的方法,列出了香菇多糖不同初级结构形式并探讨了其多种生物活性作用及机制,总结了影响结构和活性的因素,提出了香菇多糖未来研究的趋势。
1 香菇多糖的提取和纯化
1.1 香菇粗多糖的提取
香菇多糖通常由热水浸提法提取[2,11-14],即将干香菇切片或粉碎成粉末,然后用10~30倍、60~100 ℃热水提取2~3次,每次2~3 h。过滤后,提取液用旋转蒸发仪浓缩。浓缩液中添加乙醇并使其体积分数达到60%~75%,离心得沉淀,沉淀直接在干燥箱或真空冷冻干燥得到香菇粗多糖[8,34]。不同的浸提条件(水温、浸提时间、次数)多糖提取率不同。为了提高香菇多糖提取率,采用了多种辅助提取手段。香菇多糖不同提取方法比较见表1。
酶辅助提取选用的酶通常为纤维素酶、半纤维素酶、木瓜蛋白酶和果胶酶。不同酶的添加比例较接近,添加量一般为1.5%~2.0%,通常在酶的最佳活性温度和pH值条件下处理香菇粉末悬浮液。酶解后,灭酶并按照热水浸提法进行提取。因香菇细胞壁含有纤维素、半纤维素和果胶,所以酶解过程可使香菇的细胞壁破裂,有助于多糖转移至提取液,从而提高提取率[15-16]。
超声辅助提取,即在热水提取过程中应用超声设备进行超声处理。超声功率一般在300~600 W,温度40~70 ℃,时间20~60 min[16-19]。超声有利于提高提取率,原因是超声波的热效应、机械效应和空穴效应可以破坏细胞壁,有利于多糖从破碎的细胞中释放出来。
微波辅助提取,即热水浸提过程辅助以微波处理。微波功率一般为450~800 W,操作温度为室温至80 ℃,处理时间10~20 min[16,20]。该方法利用了微波的加热效应和生物破壁效应,微波的生物破壁效应使细胞膜和细胞壁破裂,胞外溶液易进入细胞内,溶解香菇多糖并能够快速扩散至细胞外,促进溶剂向香菇颗粒内部扩散及香菇多糖从颗粒内部向溶剂的扩散。微波辅助不仅提高香菇多糖的提取率,而且大大缩短提取时间。
高压和高压微射流辅助提取,即高压辅助温度超过100 ℃的提取,高温热水使香菇组织膨胀破裂,细胞壁软化,多糖更易浸出[19]。高压微射流的辅助使提取率增加,其原因是高压微射流处理带来的剪切力、冲击力和高频振动导致了细胞破碎程度和传质速率的增加[22]。
多种方式结合辅助提取的目的是获得更高的提取率,操作温度是酶的最佳活性温度,所需时间一般在30 min之内。酶-微波-超声辅助提取的提取率分别比热水提取、酶辅助提取、超声辅助提取和微波辅助提取提高50.32%、26.59%、16.38%和8.56%[16]。另外,利用超声-亚临界水(190 W,140 ℃)提取香菇多糖时其提取率达到17.34%[35]。
除了以上热水浸提法及其辅助方法以外,碱性溶液(NaOH/NaBH4)也被用于提取香菇多糖。
1.2 香菇多糖的纯化
香菇多糖的纯化包括脱蛋白、脱色和分级。香菇粗多糖脱蛋白通常应用Sevage方法[29]:粗多糖溶解于蒸馏水中,与Sevage试剂(氯仿与正丁醇体积比4∶ 1)混合,搅拌15 min,离心得上清液。重复以上过程若干次直到蛋白被彻底去除。脱蛋白后,应用30% H2O2处理使脱蛋白多糖溶液脱色[12]。
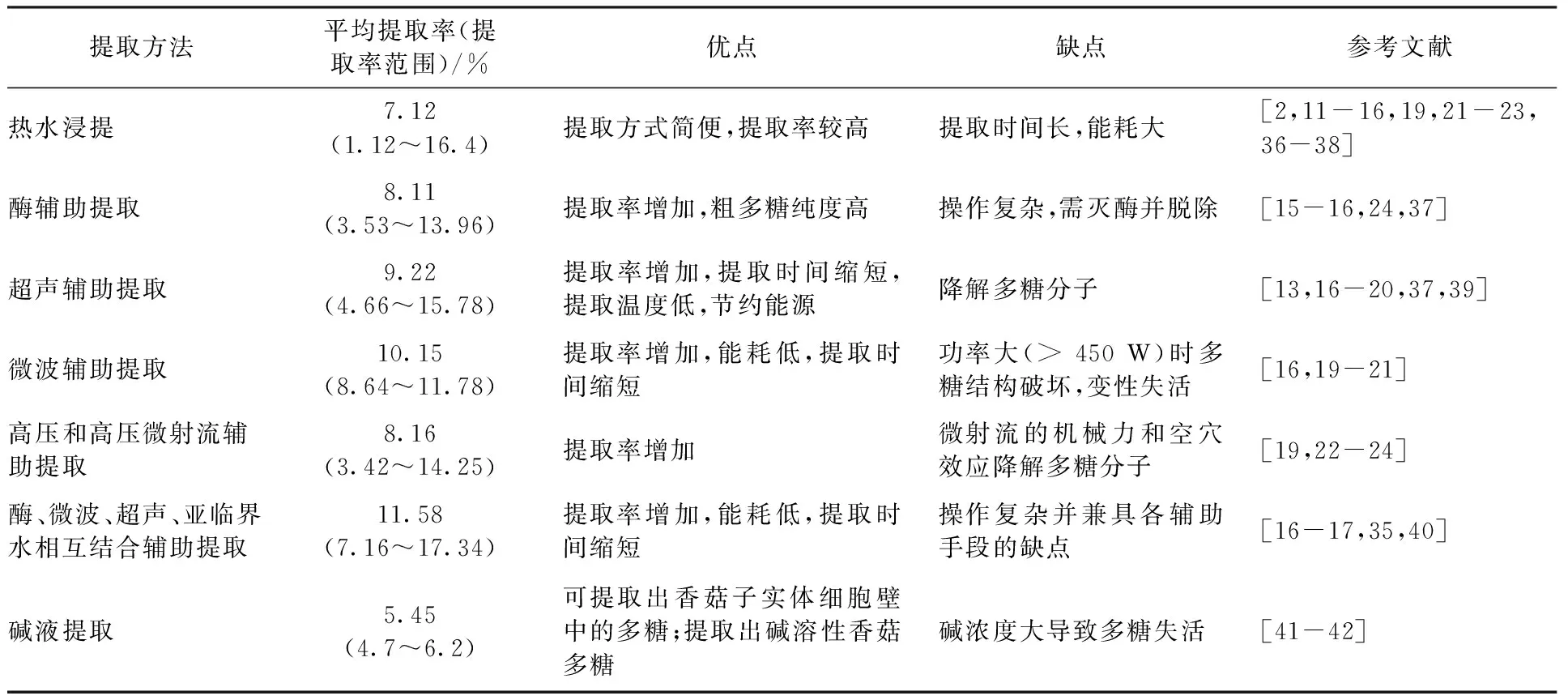
表1 香菇多糖不同提取方法比较Table 1 Comparison of different extraction methods of lentinan
香菇多糖的分级纯化通过离子交换色谱和分子排阻色谱完成。离子交换柱层析是分离纯化多糖最普遍的一种方法,DEAE-纤维素经水溶胀后分别用0.5 mol/L HCl和0.5 mol/L NaOH处理,使其转为OH-型阴离子交换剂,水洗至中性使用。香菇多糖溶液上样,分别用蒸馏水和NaCl浓度梯度溶液洗脱,不同离子强度的NaCl溶液将多糖从离子交换剂上逐一分离,得到香菇多糖的纯组分[2]。再将分离的多糖经分子排阻色谱进一步分离纯化,其原理是根据多糖分子的大小和形状的不同即按分子筛原理用凝胶柱层析进行分离。常用的凝胶有各种型号的交联葡聚糖凝胶(Sephadex)、琼脂糖凝胶(Sepharose)和聚丙烯酰胺葡聚糖凝胶(Sephacryl)[43],其中Sephadex最为常用。洗脱的不同组分分别通过Sephadex G-100[15]或G-200[25],应用蒸馏水[44]或0.2 mol/L NH4HCO3[2]或0.05 mol/L NaCl[29]或0.05 mol/L NaHCO3[12]洗脱。收集洗脱的不同组分冷冻干燥成粉末,得到纯化香菇多糖。
Rahman 等[45]应用有机试剂分离纯化香菇多糖,将香菇粉末用甲醇和二氯甲烷(体积比2∶ 1)混合液提取得到粗多糖,粗多糖溶解于90%甲醇水溶液,再分别用己烷、二氯甲烷和乙酸乙酯分离纯化。另外,香菇粗多糖的分级可用超滤的方法完成,即依次使用截留不同分子量的超滤膜,得到不同分子量的精制香菇多糖组分。
2 香菇多糖结构
2.1 初级结构
2.1.1 香菇多糖的单糖组成
香菇多糖经分离纯化得到单一多糖后应用高效液相色谱技术测定其分子量,然后将其水解制成适当衍生物进行气相色谱分析,确定其单糖组成及比例。香菇多糖属于香菇的多糖类物质,不同的菌株、多糖分子具有不同的单糖组成:只含有D-葡萄糖一种成分的多糖[3,9,26];含有葡萄糖、半乳糖和甘露糖3种成分的多糖,且葡萄糖含量最大[5,11];包含少量的阿拉伯糖[8,13]、果糖[25,46]、木糖[8,13]和鼠李糖[25,35]。
2.1.2 香菇多糖的不同初级结构
测定香菇多糖初级结构,首先,根据红外光谱分析,根据多糖类特征吸收峰(1 200~1 400 cm-1、2 800~3 000 cm-1和3 200~3 500 cm-1区间)、α-糖苷键特征吸收峰(850 cm-1附近)、β-糖苷键特征吸收峰(890 cm-1附近)、吡喃环特征吸收峰(1 043 、1 080 、1 157 cm-1)确定为多糖以及其糖残基构型[47]。然后,应用高碘酸氧化和Smith降解来判断糖苷键的连接位置、连接方式、聚合度和支链数目等结构信息。同时,应用甲基化方法确定糖链连接次序,推测糖链重复单位中各种单糖的数目和末端糖的性质以及分支点的位置[48]。还可以应用NMR手段,根据异头氢和异头碳谱图信号,进一步确定糖残基的构型(α或β)[30]。最后,推断出整个多糖分子较为确切的化学结构。根据香菇多糖不同的单糖组成和不同的链接方式发现其具有不同的初级结构。以下几种情况为不同香菇多糖分子的初级结构。
香菇多糖结构为β-(1→3)-链接的直链葡聚糖[1],见图1。

图1 香菇多糖直链结构Fig.1 Linear chain structure of Lentinan
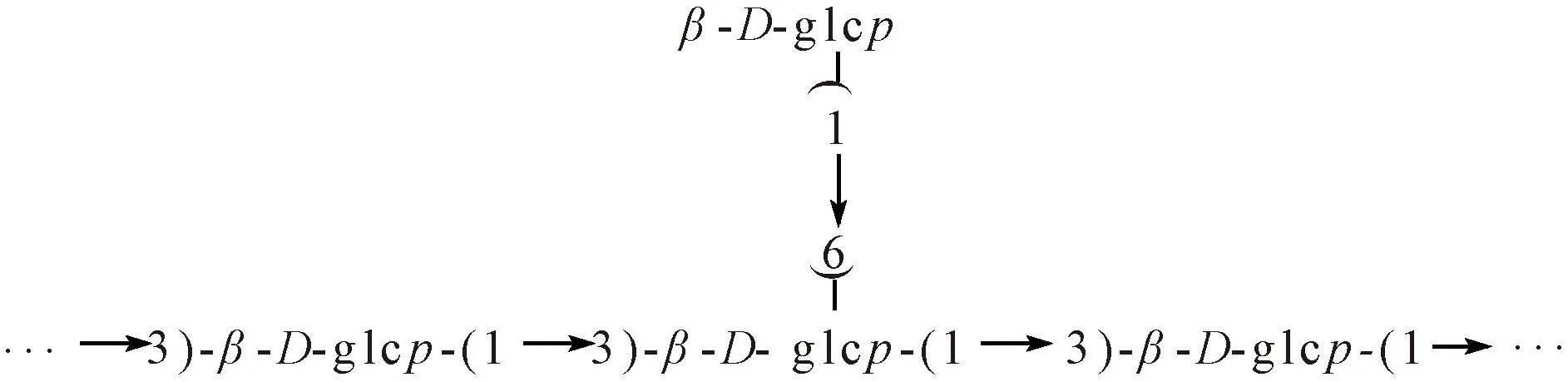
图2 香菇多糖典型结构Fig.2 Typical structure of lentinan
最典型的香菇多糖结构为β-(1→3)-链接的葡聚糖主链和(1→6)-链接的葡萄糖侧链[26],见图2。(1→6)-链接和(1→3)-链接比例约为1∶ 3或2∶ 5[9,28]。
香菇多糖结构为α-(1→3)-链接的葡聚糖主链和少量(1→6)-支链(2%)[27],见图3。
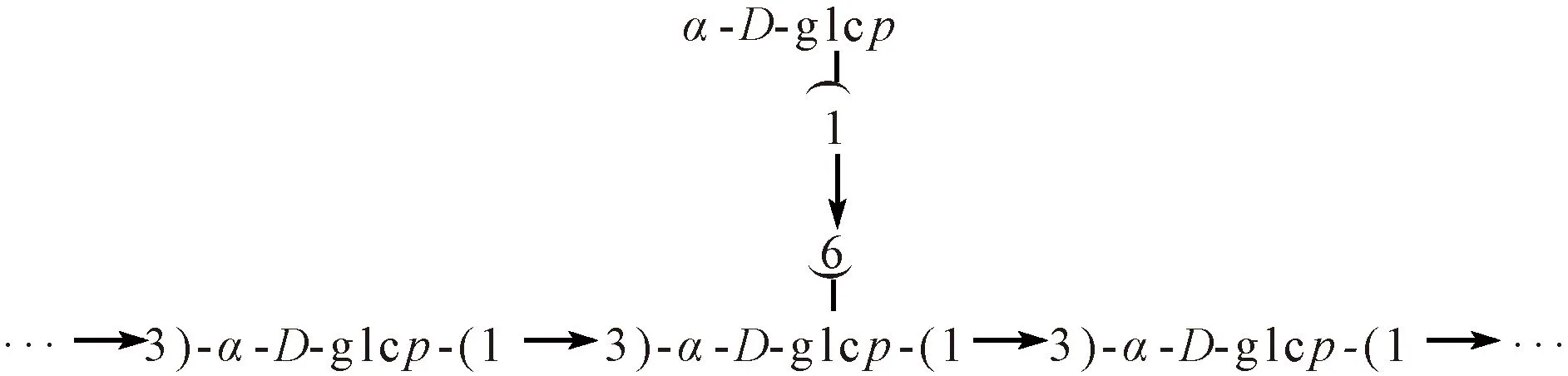
图3 香菇多糖α构型结构Fig.3 α configuration structure of lentinan
香菇多糖分子结构的主链为1→4-和1→3-链接的吡喃葡萄糖基,侧链位于β-(1→4)-链接的葡萄糖的C-6位置,见图4。由图4可知,香菇多糖结构既含有α-糖苷键又含有β-糖苷键[12]。
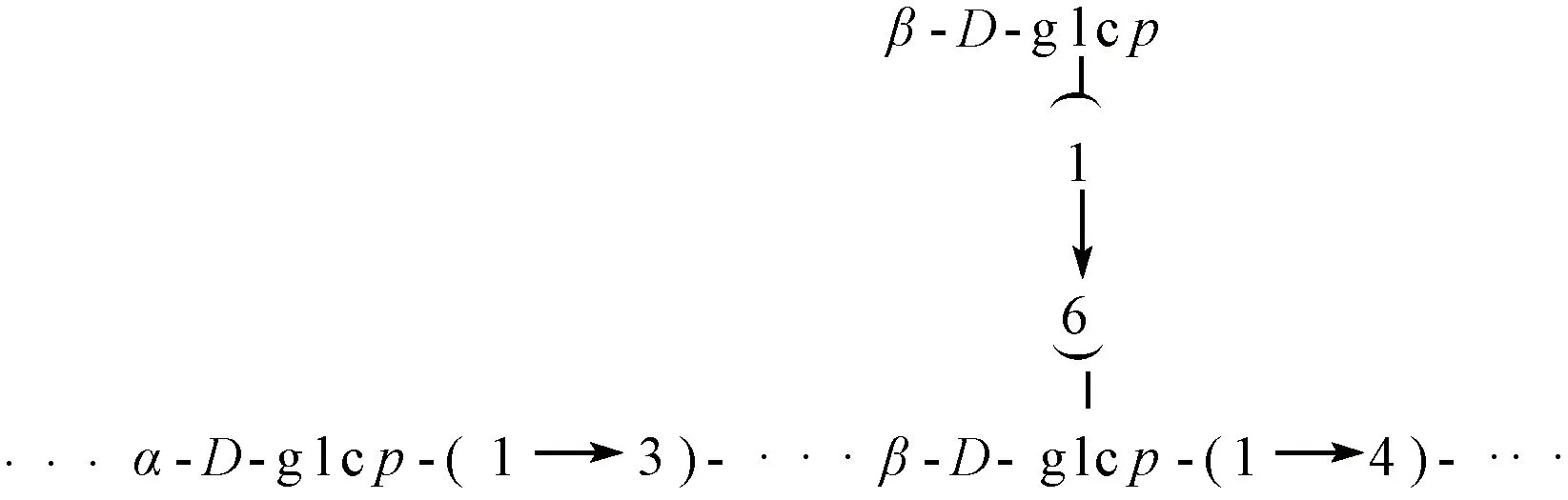
图4 香菇多糖混杂构型结构Fig.4 Hybrid configuration structure of lentinan
香菇多糖不仅含有葡萄糖还含有其他单糖,这种情况的香菇多糖分子主链是β-(1→3)-葡聚糖,侧链为-(1→6)-葡糖基起始并以甘露糖和半乳糖为末端的支链[5],见图5。
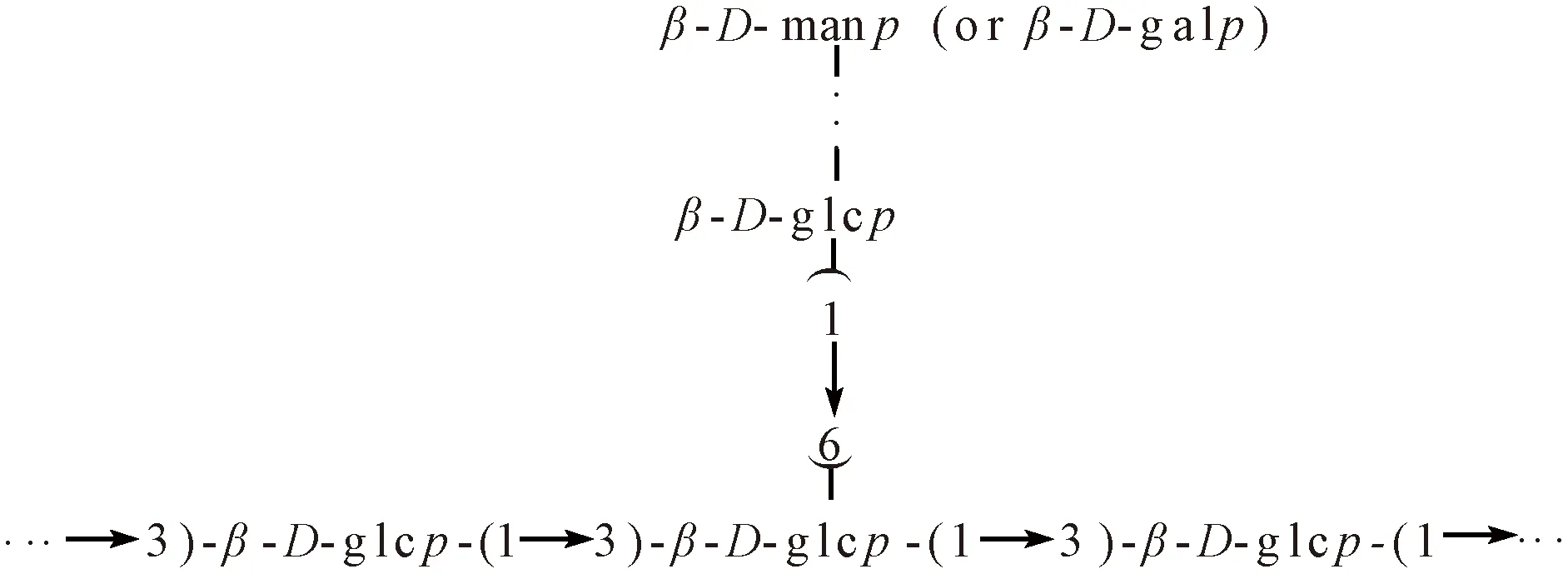
图5 香菇多糖多种单糖组成结构Fig.5 Structure of various monosaccharides of lentinan
此外,某些香菇多糖分子有更复杂的结构:多糖为(1→6)-β-D-吡喃葡萄糖,含有少量的D-半乳糖(3.9%)和D-甘露糖(4.1%);多糖含有(1→6)-、(1→4)-和(1→3)-α-D-吡喃葡萄糖,(1→6)-α-D-吡喃半乳糖,(1→3,6)-和(1→2,4)-α-D-吡喃甘露糖,以及吡喃葡萄糖基终端[11],见图6。

图6 香菇多糖非典型连接结构Fig.6 Atypical connection structure of lentinan
2.2 高级结构
香菇多糖的三螺旋高级结构由刚果红试验验证,刚果红与具有螺旋构象的多糖形成络合物,与纯刚果红相比,络合物的最大吸收波长发生红移。研究表明,香菇多糖在水和稀溶液中以三螺旋结构存在,且此三螺旋结构是刚性的[32]。水溶液中香菇多糖的三螺旋结构是由分子内和分子间氢键维持。在水中,香菇多糖螺旋结构的主要维系力是分子内氢键,而三链结构的维系力是分子间氢键[33]。诸多研究表明只有具备三螺旋结构的香菇多糖才具有生物活性。
另外,还有X射线衍射技术(XRD)和原子力显微镜技术(AFM)可以证明香菇多糖的高级结构。对于精制香菇多糖,应用XRD测定,在2θ为20°左右时有一个明显的衍射峰,证明香菇多糖结构中存在规则排布的螺旋结构。AFM可以直接观察溶液中香菇多糖的表观形态分布并推测其空间构象,AFM扫描平面图可以看出水溶液中香菇多糖的线性支链状结构[30]。
3 生物活性
3.1 抗肿瘤作用
香菇多糖具有显著的抗肿瘤活性并具有剂量依赖性,比如S180[1,31,49]、宫颈癌[15]、结肠癌[50-51]、乳腺癌[26]、肺癌[52]、肝癌[9]、膀胱癌[53]等。香菇多糖不仅抑制肿瘤细胞增殖[15,50],而且能直接杀死肿瘤细胞直至消失[49]。
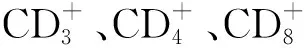
3.2 提高免疫力作用
香菇多糖是一种有效的免疫刺激剂[7],且以一种非特异性免疫刺激物起作用[34]。香菇多糖免疫刺激作用的主要效应细胞为巨噬细胞和T淋巴细胞,香菇多糖能够加强T细胞应答、自然杀伤细胞活性和吞噬作用效果[56]。活化的T细胞和巨噬细胞加速激活人体免疫系统,从而攻击癌细胞[57]。
具体而言,香菇多糖可使小鼠外周血CD3+、CD4+百分比增高,使CD4+/CD8+上升[58]。香菇多糖可以增强巨噬细胞RAW264.7细胞内NO、TNF-α和IL-6的分泌[25],并显著提高血清中细胞因子IL-1b和TNF-α水平[59]。香菇多糖还可以调节基因的表达和蛋白的产生[60-61]。另外,香菇多糖可以和单核细胞结合,从而影响免疫系统[62]。
3.3 抗氧化作用
香菇多糖呈现出明显的与浓度相关的抗氧化活性。香菇多糖的抗氧化活性试验评价:DPPH、羟基自由基和超氧自由基清除能力,铁还原抗氧化能力和亚铁离子螯合能力,脂质过氧化抑制能力[46]。另外,还可以通过测定超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力和丙二醛(MDA)含量测定香菇多糖的体内抗氧化活性。试验表明,香菇多糖可以显著提高小鼠血清中SOD和GSH-Px的活力,同时降低血清中MDA含量。SOD活性提高表明香菇多糖可以有效降低体内氧自由基,调节氧化与抗氧化的平衡;GSH-Px活性提高表明香菇多糖可以有效分解过氧化物,降低自由基对机体组织的伤害;MDA含量降低表明香菇多糖能够显著抑制体内的脂质过氧化过程,降低自由基对机体的损伤程度[63]。
香菇多糖的抗氧化作用还体现在抗动脉粥样硬化的生物功能。香菇多糖可以通过调节过氧化物酶体增殖物激活受体(PPARs)的表达从而显著降低血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇含量,提高血清抗氧化酶活性及胸腺和肝脏指数[8,64]。
3.4 抗病毒作用
香菇多糖对一些病毒呈现出抗病毒活性,比如传染性造血坏死病毒和乙型肝炎病毒。香菇多糖的抗病毒机制主要包括直接使病毒失活和抑制病毒的复制。人体受到传染性造血坏死病毒威胁时,香菇多糖通过显著地降低TNF-α、IL-2和IL-11的表达水平而增加IFN-1和IFN-γ的表达水平来抑制病毒,该抑制作用与其调节先天免疫应答和特异性免疫有关[5]。香菇多糖可以抑制乙肝病毒DNA的复制、病毒受体细胞的增殖并可减少抗凋亡相关蛋白(stat3, p-stat3 and survivin)的表达[65]。
3.5 抗辐射作用
辐射主要对基因和膜结合蛋白造成损害,而香菇多糖可通过调节信号转导保护膜结合蛋白和细胞的外形而达到抗辐射效果。香菇多糖针对辐射的保护作用主要源于修复损坏的蛋白,通过膜调节信号转导,而不是直接保护基因物质[10]。另外,辐射导致T淋巴细胞活性降低,IL-2分泌减少,NO含量上升,而香菇多糖可使T淋巴细胞活性、IL-2增加,NO含量降低[66]。所以,另一种观点认为,香菇多糖对辐射的保护作用主要是通过调节T淋巴细胞内NO和IL-2的生成而提高T淋巴细胞的生存能力和功能[67-68]。
3.6 抗副作用
肿瘤的化学治疗和放射治疗后经常出现副作用。然而,香菇多糖可以减小或减轻副作用的发生,如肝损伤和腹泻[9]。香菇多糖对正常细胞没有细胞毒性作用,并可以通过提升巨噬细胞CD11b+和TIM-4+的累积抑制化疗药物的毒副作用,促进损伤细胞的吞噬作用[25,69]。香菇多糖辅助化疗可提高T细胞和自然杀伤性细胞比例,有效改善患者免疫功能,有效增强患者对化疗药物的耐受能力,减少化疗不良反应,提高化疗近期和远期疗效[70]。
除了以上的活性以外,香菇多糖还可以减少约氏疟原虫血症,提高小鼠存活率[58];具有抗疲劳作用[44];在冷水鱼养殖中具有抗炎效果从而阻止炎症疾病[71];具有降血糖作用,能够显著降低糖尿病小鼠空腹血糖值,改善糖耐量,增加肝糖原的含量[72]。
4 影响香菇多糖结构和功能的因素
4.1 分子量
香菇多糖的抗肿瘤和抗氧化活性与其分子量有关。研究表明,分子量为(5~7)×105Da的香菇多糖具有较高的活性[15,73],而高分子量(15.4×105Da)和低分子量(1.523×105Da)的活性减弱[29]。高分子量香菇多糖活性差的原因为分子太大而较难进入细胞内部[29]。超声、微波和动态超高压微射流辅助提取香菇多糖使较大分子量减小到活性较高的分子量范围时,其抗氧化能力增强[73-74],该现象也证明了分子量与其生物活性有一定关系。另外,分子量的影响根据不同的应用方式而不同。抗肿瘤试验表明,对S-180有最大抑制率的分子量在体内和体外分别是11.4×105Da和5.71×105Da[75]。
4.2 糖苷键
只含有D-葡萄糖一种成分的香菇多糖和含有几种单糖且葡萄糖含量最大的香菇多糖都具有良好的生物活性[2,9],但单糖间糖苷键的类型对其活性有较大影响。首先,对于单糖的连接位置,具有1→3连接方式的香菇多糖大多具有生物活性,少部分1→6连接方式的多糖也具有生物活性,但是1→2、1→4等连接方式的多糖很少具有生物活性[76]。其次,对于糖苷键构型,一般认为具有β-(1→3)-D-吡喃葡萄糖的基本骨架是香菇多糖发挥抗肿瘤活性的前提,以β-(1→3)-D-葡萄糖为主链、β-(1→6)-D-葡萄糖连接为支链的香菇多糖最具活性,比β-(1→6)-D-葡萄糖连接为主链的抗肿瘤活性好[30,41]。
4.3 高级结构
香菇多糖在自然状态和溶液中以三螺旋结构存在,三螺旋结构香菇多糖呈现出明显的抗肿瘤活性。然而当受到高温、有机试剂、碱液等因素而解体为单链结构时[33,77],其活性明显降低甚至消失,表明三螺旋结构在抗肿瘤作用方面起重要作用[31]。香菇多糖的高级结构对功能的影响比初级结构重要得多,且特定的空间构象是其产生生物活性所必需的[78]。但也有研究将三螺旋结构的香菇多糖转变为单股螺旋结构后,结果两者均具有良好的抗肿瘤作用。该研究认为天然香菇多糖中单螺旋结构是香菇多糖发挥生物活性的基础,三螺旋可能为辅助作用,使香菇多糖在体内更易被受体识别,激活免疫系统,联合其直接抑制肿瘤细胞的作用,从而可发挥双重抗肿瘤效果[30]。另外,香菇多糖分支侧链的存在可以稳定多糖链的螺旋结构,从而使分支度成为衡量活性的一个重要因素,研究表明具有生物活性的β-(1→3)-D-葡聚糖分支度在0.20~0.33时活性最强[30,41]。
4.4 内源金属离子
分离的香菇多糖含有许多内源金属离子,且这些金属离子与其活性有直接关系,除去金属离子后,香菇多糖的抗氧化和抗肿瘤活性降低[29]。因此,香菇多糖分子内固有的金属离子对其活性是有益的,它们可能与香菇多糖活性的机制有关。
4.5 其他外在因素
4.5.1 温度
室温环境下,香菇多糖在水溶液中以三螺旋结构存在,100~121 ℃的高温不改变其初级结构[23]。另外,高温可以提高香菇多糖的抗氧化能力并对HepG2和HeLa细胞有抑制效果[23]。然而,当温度高于130 ℃时水溶液中香菇多糖的结构将由三螺旋结构不可逆地转变为单链结构[28],而且发生此转变的温度在130~145 ℃区间[33]。温度促使结构转变的原因是维系香菇多糖三螺旋结构的分子间和分子内氢键的断裂,结构的变化直接导致生物活性的减弱或消失。
4.5.2 超声处理
室温下超声处理可以使香菇多糖分子降解[32-33],分子量随着超声时间延长和功率的增加而减小[79]。由于分子量与活性有关,所以超声处理也直接影响其生物活性。
4.5.3 有机试剂
室温下香菇多糖在水溶液中以三螺旋结构存在[33],然而有机试剂可以破坏此结构,从而影响其生物活性。室温下,当溶液中二甲基亚砜含量达到0.85时香菇多糖的结构将发生从三螺旋结构到单链结构的不可逆转变,在纯二甲基亚砜中香菇多糖完全以不规则形状单链结构存在[28,77]。这样,变性失活的香菇多糖几乎没有抗肿瘤活性[31]。
4.5.4 碱液
随着NaOH浓度的增加,香菇多糖的结构将逐渐由三螺旋向单链转变,且浓度在0.05~0.08 mol/L之间时转变发生得非常迅速[33]。此结构的变化是不可逆的并将造成维系香菇多糖三螺旋结构的分子内和分子间氢键的断裂[80]。
5 未来研究趋势
5.1 构效关系的持续研究
以β-(1→3)-D-葡萄糖为主链、β-(1→6)-D-葡萄糖连接为支链的香菇多糖比β-(1→6)-D-葡萄糖为主链的抗肿瘤活性好,且具有生物活性的β-(1→3)-D-葡聚糖分支度在0.20~0.33时活性最强[30,41]。具有三螺旋结构的香菇多糖具有许多生物活性,但一旦此结构破坏而转变为单链后其生物活性将消失[33]。具有中等分子量的香菇多糖具有良好的生物活性,而更大和较小分子量时活性会减小[29]。脱蛋白、脱金属离子和硫化都会影响香菇多糖的生物活性[29,31,79]。然而,结构不同其活性不同的现象发生的原因还未知。例如,脱蛋白后香菇多糖的抗肿瘤效果和抗氧化活性减弱[76],推测的原因可能是脱蛋白的过程中多糖的某些氢键断裂造成糖蛋白空间结构的改变,而脱蛋白导致的活性改变的确切机制还有待研究。构效关系的进一步研究不仅能知晓生物活性应具有的结构特点,而且还可以为稳定活性结构和结构修饰提供理论基础。
5.2 生物活性机制待更深层次机理研究
针对香菇多糖活性机制的研究,现有细胞凋亡理论、细胞周期阻滞理论、调节基因表达、调节免疫细胞和细胞因子表达理论以及活性氧直接杀伤理论。细胞凋亡理论认为香菇多糖作用于癌细胞后,抗凋亡蛋白Bcl-2表达降低,促凋亡蛋白Bax表达增加[56]。另外,香菇多糖可促进caspase-3(半胱氨酸天冬氨酸水解酶中关键执行酶)和p53(抗癌基因)蛋白表达,通过线粒体膜途径起到促进细胞凋亡的作用,抑制肿瘤细胞增殖[38]。细胞周期阻滞理论认为香菇多糖通过抑制细胞周期蛋白B1(cyclin B1)、D1(cyclin D1)把肿瘤细胞分别阻滞在细胞的S周期和G2/M期从而抑制肿瘤细胞的增殖[38,81]。调节基因表达理论认为香菇多糖可以使相关免疫基因、细胞周期调控基因、细胞生长和分化基因和酶类等数十至数百条基因发生差异表达[82]。香菇多糖可提高自然杀伤性(NK)细胞和T细胞(CD3+、CD4+、CD8+)比例[70],增加血清中细胞因子IL-2、IL-6、TNF-α、IFN-γ等的含量[82],从而提升免疫功能并通过细胞因子调控机体免疫网络来抑制肿瘤[76]。直接杀伤作用认为香菇多糖诱发细胞内产生活性氧,导致癌细胞直接死亡,抑制肿瘤生长[83]。
以上香菇多糖活性机制的研究检测了与活性有关的相关因素、因子的变化,在细胞水平上研究了活性作用对应这些因素、因子的增加或减少。但是,活性产生的更深层次机理,在分子水平上的活性机制仍需要进一步研究。
5.3 香菇多糖在人体消化系统内的代谢机制
日常食用香菇获得的香菇多糖是否对人体有生物活性尚没有科学依据,因此,需要研究香菇多糖在人体内消化系统的代谢机制。
5.4 加工因素对香菇多糖结构和功能的影响
香菇在烹饪和加工过程中,许多因素会单独或一起影响香菇多糖的结构和生物活性,这些因素包括高温、酸度、调味品(味精、香辛料、盐等)、淀粉、蛋白等。这些因素对香菇多糖结构和功能的影响有待研究。
6 结论
香菇多糖具有包括抗肿瘤作用在内的多种功能特性,因此一直是研究热点之一。作者对香菇多糖的提取、结构、活性以及影响结构和活性的因素等内容进行了分析总结,并指出了未来的研究趋势。作为香菇的功能性成分,香菇多糖的提取和纯化至关重要;热水浸提法因其工艺过程简单、方便和较高的提取率仍是目前主要的提取方法;现有香菇多糖的分离纯化方法适合于实验室和小规模生产使用,而无法满足规模化生产,香菇粗多糖的纯化技术仍待突破;香菇多糖的单糖组成和初级结构形式基本研究清楚,然而,因为多糖高级结构的复杂性和目前研究手段的局限性,对香菇多糖高级结构的认知仍然有限;香菇多糖具有多种生物活性,而活性也受其本身结构变化的影响,继续深入研究香菇多糖的构效关系和活性机制仍有很大必要;香菇是世界第二大食用菌,作为一种健康食材,研究香菇多糖在人体内的代谢机制和外在加工因素对其功能的影响很有意义,也将为香菇的深加工提供理论基础。
