子宫内膜癌组织中甲状腺激素受体β1和肝癌衍生生长因子的表达与临床生物学行为和预后的关系
2022-11-23许运巧刚小青
许运巧 刚小青 徐 霞
子宫内膜癌(Endometrial cancer)作为常见的妇科恶性肿瘤,已呈现总体发病年龄提前和发病率上升的趋势[1-2]。根据国家肿瘤中心的数据显示,2015年中国新出现子宫内膜癌病例63 400例,死亡21 800例[3]。大多数子宫内膜癌患者在早期被诊断出并能得到及时治疗,但是有少数子宫内膜癌患者被发现已为晚期或发生复发等情况,其治疗疗效以及预后均较差,且缺少特效的治疗方法,其5年生存率只有25%~30%[4-5]。研究表明甲状腺激素受体β1(TRβ1)在多种肿瘤组织中表达均降低甚至完全缺失,推测TRβ1可能是一种抑癌基因,可以抑制肿瘤的发生,但TRβ1在子宫内膜样腺癌组织中的表达研究尚少[6-7]。肝癌衍生生长因子(hepatoma-derivedgrowth factor,HDGF)是一种肝素结合蛋白,不仅能促进多种细胞的增生和血管生成,还与肿瘤的发生、发展密切相关[8-9]。因此本研究分析TRβ1和HDGF水平与子宫内膜癌中的临床病理特征和预后的相关性,旨在为子宫内膜癌确立生物标志物的进一步研究提供数据参考。现报告如下。
1 材料与方法
1.1 研究对象
选取2015年2月至2018年2月本院收治子宫内膜癌患者58例,年龄36~71岁,平均(54.25±6.87)岁。纳入标准:①符合《子宫内膜癌诊治规范》[10]中关于子宫内膜癌的诊断标准,术后病理诊断为子宫内膜癌,且患者行手术治疗;②患者术前未行放、化疗等其他治疗;③患者的临床资料完整;④患者及家属已签署知情同意书。排除标准:①合并患有妇科炎症患者;②合并其他恶性肿瘤;③合并处于妊娠状态患者。
1.2 免疫组化分析TRβ1和HDGF水平
用免疫组织化学检测TRβ1和HDGF表达,以鼠抗人TRβ1和HDGF单克隆抗体为一抗,用已知阳性切片作阳性对照,PBS代替一抗作阴性对照,用苏木精复染细胞核,参考文献标准[7]判断,TRβ1和HDGF阳性产物均位于细胞核,视野中出现粗细一致的棕黄色为阳性染色,无棕色反应为阴性染色。在阳性颗粒密集部位随机选取10个200倍视野,计数每个视野中细胞的染色情况,取平均值。根据阳性细胞占全部细胞数的百分数对其进行分级,阴性为阳性细胞数<10%;阳性为阳性细胞数>10%。
1.3 收集临床资料以及随访资料
收集患者年龄、性别、组织学分级、肿瘤最大径等临床资料。采用电话及门诊或住院复查等方式进行随访3年,了解患者生存情况。随访时间截止2021年2月。根据随访结果将患者分为死亡组(n=22)和生存组(n=36)。
1.4 统计学分析

2 结果
2.1 TRβ1和HDGF与子宫内膜癌患者的临床生物学行为的关系
免疫组化结果显示:TRβ1阳性6例,阴性52例;HDGF表达阳性50例,阴性8例。根据结果发现,TRβ1和HDGF与浸润深度、分化程度无关(P均>0.05),与临床分期以及淋巴结转移有关(P均<0.05),见表1。

表1 TRβ1和HDGF与子宫内膜癌患者的临床生物学行为关系/例
2.2 生存组与死亡组 TRβ1和HDGF表达情况比较
生存组的 TRβ1表达阳性率明显高于死亡组(P<0.05),生存组的 HDGF表达阳性率明显低于死亡组(P<0.05),见表 2。
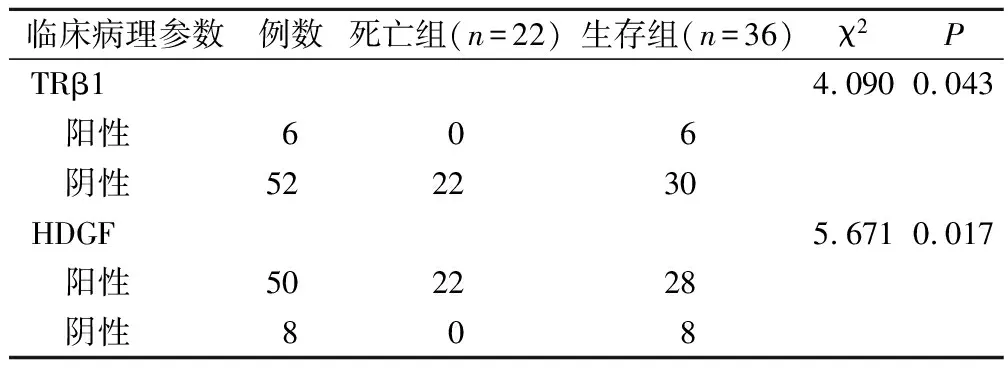
表2 生存组与死亡组 TRβ1和HDGF表达情况比较/例
2.3 影响子宫内膜癌患者预后多因素logistic分析
多因素logistic 回归分析显示,TRβ1和HDGF均为影响子宫内膜癌患者预后的独立危险因素(P<0.05), 见表3。
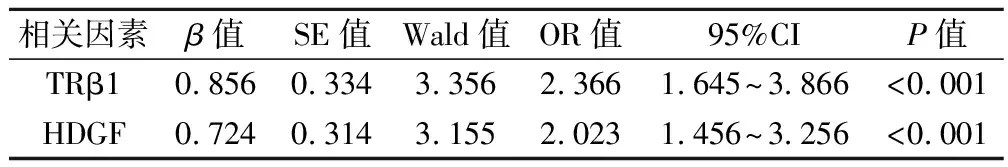
表3 影响子宫内膜癌患者预后的多因素logistic分析
3 讨论
子宫内膜癌是临床常见的女性生殖道恶性肿瘤,发病率在近年来呈不断上升的趋势,一般50~70岁年龄段高发,且有年轻化发展的趋势[11]。在我国,每年子宫内膜癌的发病率为0.634% ,病死率为0.218%[12]。手术为主的综合治疗可提高子宫内膜癌患者生存率,但侵袭或转移者仍预后不良[13]。癌症的发生为多机制、多因素的复杂生物学反应,子宫内膜癌的发生被认为是一个多步骤的过程,涉及激素调节、基因突变、粘附分子和细胞凋亡的协调相互作用,但是目前子宫内膜癌确切的病理机制尚未明确[14-15]。
TRβ1是一种甲状腺激素受体蛋白,在甲状腺和乳腺中均有表达[16]。研究表明突变体TRβ1具有致癌活性,可与p85α持续结合,激活PI3K-AKT-ERK/STAT3信号通路,从而促进细胞增殖和侵袭,抑制细胞凋亡[17-18]。HDGF的基因位于染色体1q21-23上,是一种肝素结合生长因子,最初是从人类肝癌细胞系HuH7条件下的培养基中纯化出来的[19-20]。HDGF在正常组织和肿瘤细胞系中普遍表达[21]。最近的研究报道称,HDGF可作为SREBP1介导的脂肪生成基因转录的共激活剂[22]。HDGF被表征为许多细胞类型的有丝分裂原并定位于细胞核,这是其有丝分裂活性所必需的[23]。 HDGF促进生长、抑制分化和表现出血管生成特性等特征表明其在癌症诱导和肿瘤进展中发挥作用[24]。因此,许多研究关注到HDGF作为预后标志物的重要性,并证明了其对口腔癌、食管癌、胃肠道间质瘤、脑膜瘤、肝细胞癌和子宫内膜癌的影响[25-27]。本研究中TRβ1和HDGF与临床分期以及淋巴结转移有关,TRβ1在抑制子宫内膜癌发生的同时还可以减少淋巴结的转移,HDGF和β-catenin在诱发子宫内膜癌的同时,还可以增强侵袭转移,加快疾病的进展。生存组的TRβ1表达水平明显高于死亡组,生存组的HDGF表达水平明显低于死亡组。TRβ1和HDGF均为影响子宫内膜癌患者预后的独立危险因素。这提示其和子宫内膜癌预后有一定关系,通过测定其表达情况能够辅助预后的评价。
综上所述,子宫内膜癌组织中TRβ1和HDGF的表达失调,能够反映肿瘤的临床生物学行为,可作为子宫内膜癌预后评价的辅助指标。然而本研究存在偏移,首先是中心单一以及样本量偏少,以及随访时间短,因此未来还需要多中心以及更大样本量的前瞻性试验来证实此结果。
