基于群落组成的吲哚代谢菌筛选及特性研究
2022-11-23杨婧,陈卓,赵博,谭佳,吴炜泽,戴春晓,曲媛媛
杨 婧, 陈 卓, 赵 博, 谭 佳, 吴 炜 泽, 戴 春 晓, 曲 媛 媛
( 大连理工大学 环境学院, 辽宁 大连 116024 )
0 引 言
吲哚作为一种典型的氮杂环化合物,广泛存在于自然界中.植物和微生物(大肠杆菌及多种弧菌)可以通过特定的酶合成吲哚.动物肠道内的部分微生物可以转化食物中的色氨酸合成吲哚[1].畜牧业和煤矿业的迅速发展都会产生吲哚废水[2-4].据报道,苯酚和吲哚是焦化废水中主要的有机污染物,分别占61.70%和13.63%[5].焦化废水中吲哚浓度可达(18.60±3.02) mg/L,动物粪便中吲哚浓度可达777.86 mg/L[6-7].较高浓度的吲哚对于动物健康和生态环境有危害[8].在已经报道的焦化废水生物处理反应器中,吲哚等氮杂环化合物的去除率在90%以上[9],说明经过高浓度污染物的长期驯化,活性污泥中的微生物选择性富集能够增强相关代谢功能.这部分微生物对吲哚具有快速降解以及高浓度耐受性.高效菌株资源的筛选和研究也是生物强化处理氮杂环废水的关键问题之一.
1665年,Hooke第一次观察到微生物.从首次对微生物的观测到其纯化分离历时两个世纪.然而,科学家们很快发现环境样品中仅有1%的微生物是可培养的[10].2002年至今,随着测序技术的诞生和不断发展更新,多组学被看作未来微生物研究的关键技术,与微生物群落的相关研究日益增多.现阶段的研究如果结合微生物纯培养技术和组学技术,能更好地理解微生物[11].目前已有从焦化废水活性污泥中筛选降解菌株的相关报道[12-14],但是大部分筛菌过程没有测定对应阶段微生物群落中的菌属组成,也没有考察筛选得到的菌株菌属和微生物群落中优势菌属之间的联系.研究过程中发现能够降解吲哚的菌株资源仍然有限.此外,部分菌株可以利用芳香化合物(如苯酚、萘等)共代谢吲哚生成高附加值产物,如靛蓝等[15-17].相比化学合成,微生物法合成靛蓝较为绿色环保,将吲哚转化为靛蓝类色素也是吲哚废水资源化的一种可能途径[18].
因此,本研究构建运行SBR,污染物浓度梯度增加,在运行的各阶段末期,进行污泥取样,利用高通量测序技术测定微生物群落的物种组成,同时利用纯培养技术在反应器各阶段的活性污泥中筛选菌株,分析菌株的特性,进行对比分析.将组学技术和微生物纯培养技术有机结合,从微生物群落和单菌两个方面揭示废水中吲哚代谢过程的菌属变化,并探索吲哚废水的资源化.
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
(1)污泥来源
本实验用活性污泥取自辽宁省凌源市凌钢焦化废水处理厂二沉池.
(2)实验试剂
实验涉及的主要试剂有吲哚,上海阿拉丁生化科技股份有限公司;苯酚,天津市大茂化学试剂厂;靛蓝,美国Acros Organics公司;其余所有试剂均为分析纯及以上.
(3)溶液配制
反应器模拟废水组成参考文献[9],1 mL/L微量元素[19].吲哚和苯酚根据实验阶段添加.
(4)培养基组成
无机盐培养基:2 g/L (NH4)2SO4,2 g/L KH2PO4,3.3 g/L Na2HPO4·12H2O,0.25 mg/L FeCl3,pH=6.8.1/10 LB培养基:1 g/L NaCl,1 g/L 蛋白胨,0.5 g/L酵母浸粉,pH=7.0.所有培养基121 ℃、20 min灭菌后使用.
1.1.2 实验仪器 本实验主要使用的仪器包括高效液相色谱仪(Primaide,日本Hitachi公司),双光紫外-可见分光光度计(Metash UV-9000,上海元析),液相色谱-飞行时间质谱联用仪(G6244A,美国Agilent公司)及高分辨钨灯丝扫描电子显微镜(FlexSEM1000,日本Hitachi公司).
1.2 实验方法
1.2.1 反应器构建与运行 3个SBR接种相同量的活性污泥,干质量浓度(3.55±0.37) g/L.前期在模拟废水中加入500 mg/L葡萄糖进行污泥驯化1个月达到稳定状态.驯化后,反应器运行实验阶段及吲哚和苯酚投加浓度如图1所示.在各阶段结束时期,取污泥样品测序以及同步纯培养筛菌.

图1 反应器运行流程及筛菌取样点示意图
1.2.2 高通量测序分析
(1)DNA提取及测序
共采集12个活性污泥样本,使用Advanced Soil DNA Kit试剂盒从样本中提取DNA.对于16S rRNA的V4区,使用引物515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACNVGGGTWTCTAAT-3′)PCR扩增[20].扩增产物在广州美格基因生物科技有限公司的Illumina MiSeq平台上进行测序.
(2)测序数据处理
将原始数据利用中国科学院邓晔团队创建的分析平台进行质量控制处理[21](http://mem.rcees.ac.cn:8080)后得到有效数据.使用UPARSE 方法在97%的相似度水平将序列划分为操作分类单元(OTUs).物种注释基于RDP Classifier方法和Green Gene数据库.
1.2.3 菌株分离与鉴定 各阶段末期对污泥取样,在无机盐固体培养基(含100 mg/L吲哚)上进行平板涂布,于30 ℃恒温培养箱培养,挑取生长较快的菌落于1/10 LB液体培养基(含100 mg/L 吲哚和100 mg/L苯酚)中培养.反复进行平板涂布至呈现单一菌落,最后分离得到纯菌株.菌株利用16S rRNA通用引物27F和1492R进行PCR扩增[22],委托上海生工生物工程有限公司完成测序.将测序得到的菌株基因序列与NCBI数据库中其他序列进行同源性比较.系统进化树构建利用ClustalX 1.83和MEGA 5.1软件完成.
1.2.4 菌株特性研究
(1)形态表征和菌体浓度测定
菌株的细胞形态通过扫描电子显微镜(SEM)观察.样品预处理过程参考文献[22].定时取2 mL菌液,利用UV-Vis在660 nm处测定菌体浓度,用吸光度值(OD660)表示.
(2)吲哚及苯酚浓度测定
吲哚和苯酚浓度利用高效液相色谱法(HPLC)进行检测.取菌液,加入等体积乙酸乙酯萃取,使用0.45 μm有机膜过滤后进行分析.实验采用Thermo Hypersil ODS-2(5 μm,250 mm×4.6 mm)色谱柱,样品以50%(体积比)甲醇/水等度洗脱,流速为0.5 mL/min,洗脱时间为15 min,吲哚和苯酚的检测波长分别为265 nm和270 nm.
(3)靛蓝产量测定
将合成的靛蓝产物于8 000 r/min离心8 min,沉淀用二甲基亚砜(DMSO)溶液重悬,超声溶解30 min,离心取蓝色上清液,利用UV-Vis在波长618 nm处测定吸光度.
(4)吲哚降解中间产物测定
利用液相色谱-飞行时间质谱联用(LC/TOF-MS)技术对菌株降解吲哚中间产物进行测定.菌株在1/10 LB培养基中生长,在12 h和24 h时取样,8 000 r/min离心5 min.上清液用乙酸乙酯振荡萃取后,用0.45 μm有机膜过滤等待上机检测.用DMSO溶液对沉淀进行重悬之后再离心,上层有机液体过膜待测.质谱采用ESI源负模式扫描.
(5)合成靛蓝的条件优化
采用响应面法[17]中的中心组合设计方法考察多因素对菌株合成靛蓝的影响,对实验参数进行条件优化.
2 结果与讨论
2.1 高通量测序结果
采用Illumina MiSeq测定各阶段污泥样本得到原始序列1 958 665条,以样本最小序列数(>112 887)标准化重抽后有效序列为1 354 644条.通过UPARSE聚类后得到1 345个OTU.利用RDP分类数据库进行物种注释.共检测到22个细菌门类,6个优势门类(相对丰度>1%).变形菌门Proteobacteria在各阶段样品中占比最高,如图2(a)所示,在阶段Ⅳ相对丰度达到最高(97.32%).在属水平群落组成中,检测到266个菌属,22个优势属,如图2(b)所示.菌属按照相对丰度高低排序,排名前十的菌属相对丰度如表1所示.各阶段最优势菌属均为Comamonas,相对丰度最高达到(63.78±1.98)%.据报道,Comamonas是典型的芳香降解菌属,具有硝化和反硝化能力,有利于含氮有机污染物和酚类物质的代谢[9,23].由于各阶段污泥中均含有较高丰度的Comamonas,因而能有效去除体系中吲哚和苯酚.
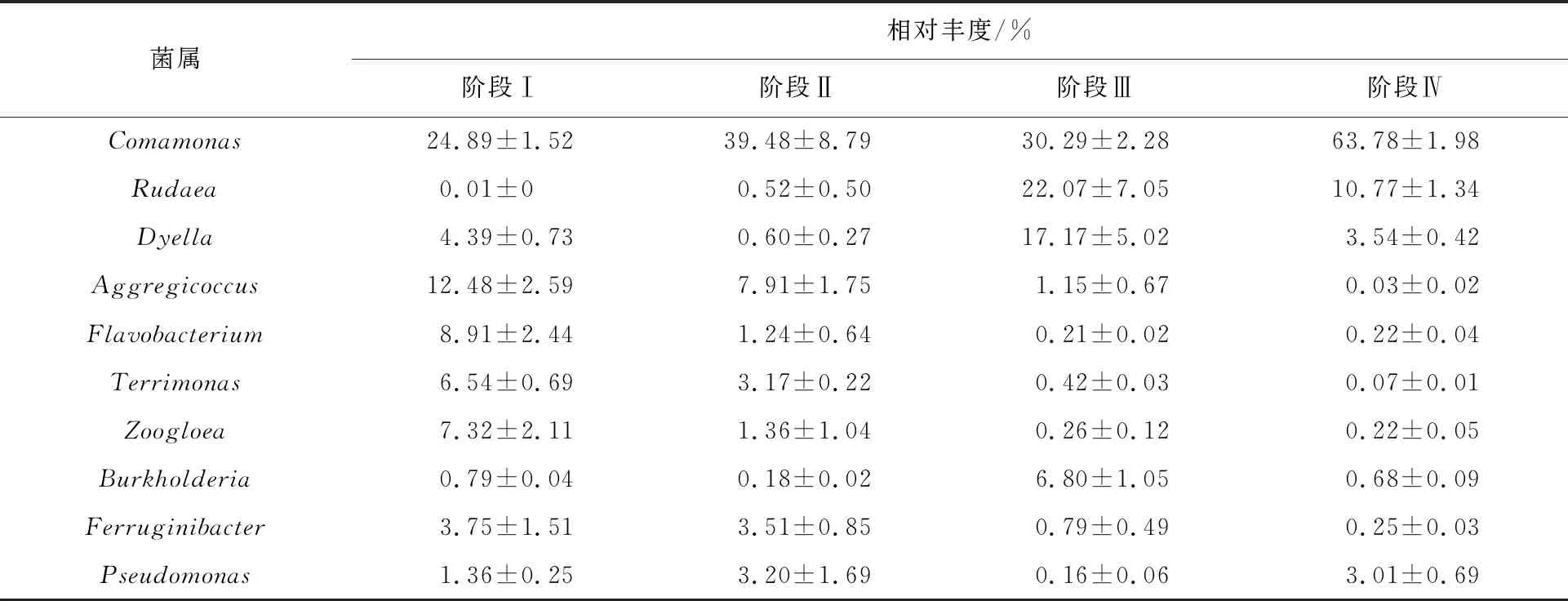
表1 群落中不同阶段排名前十的菌属相对丰度
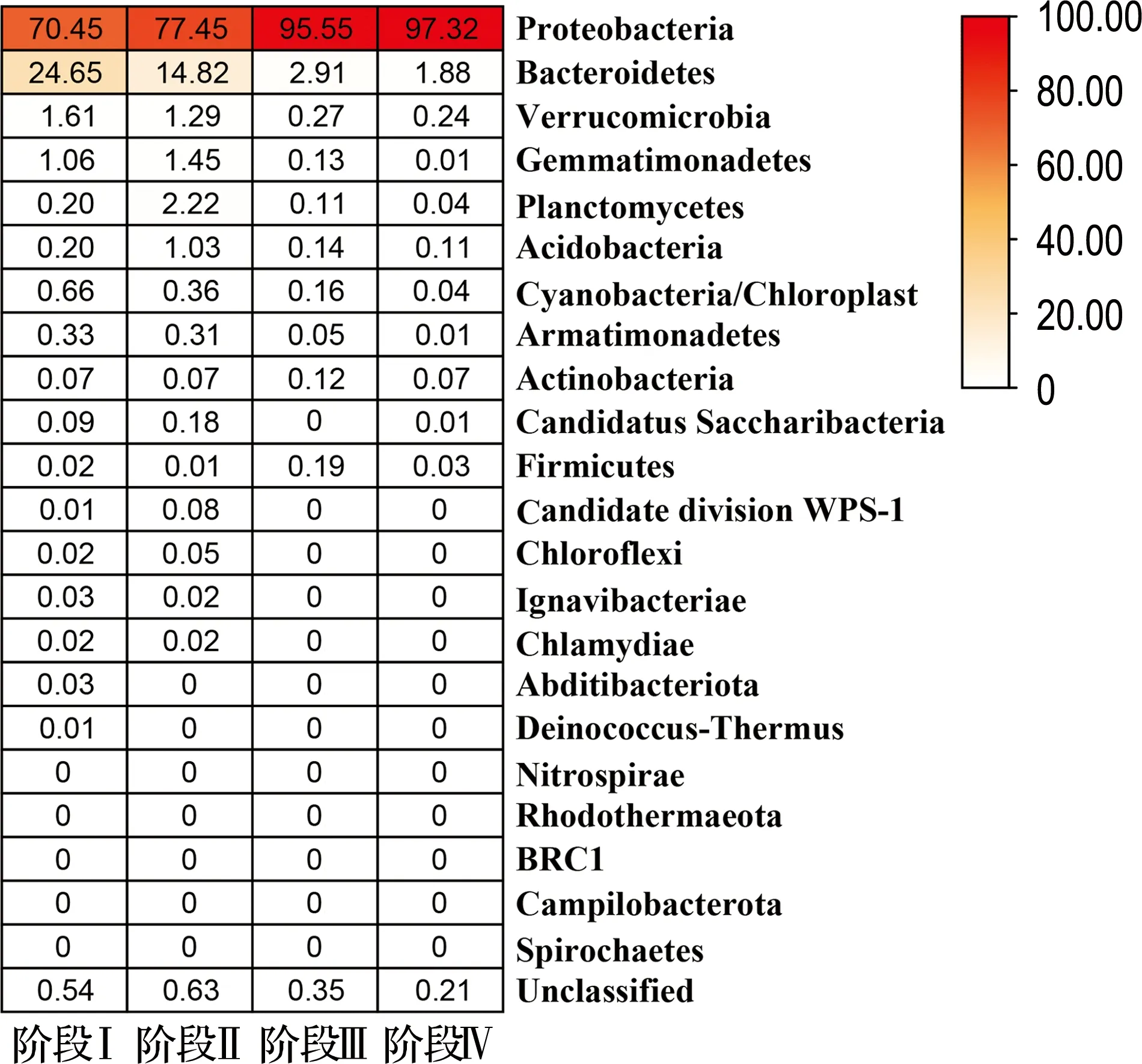
(a) 门水平(%)
2.2 各阶段菌株的分离筛选和鉴定
从反应器4个阶段污泥中一共筛选分离得到8株菌.按照阶段命名,即YJIP-O1、YJIP-O2、YJIP-Tw1、YJIP-Tw2、YJIP-Th1、YJIP-Th2、YJIP-F1、YJIP-F2.将测序得到菌株的16S rRNA序列与GenBank数据库中其他16S rRNA序列进行同源性比对,结果表明菌株YJIP-Tw2、YJIP-Th1、YJIP-F1、YJIP-F2与多个Burkholderia属的菌株相似度高达99%,将这4株菌归类于Burkholderia属.菌株YJIP-O1、YJIP-O2、YJIP-Th2归类于Comamonas属,YJIP-Tw1归类于Dyella属.为进一步确定这几株菌的进化地位,构建系统进化树,如图3所示.图中加圈标注的是本文筛选得到的菌株,除菌株Escherichiacoli(J01859)以外,其他菌株都是已经报道过具有吲哚降解能力的典型菌株,本实验获得的8株菌与之前报道的菌株相比,系统地位相对更近.

图3 吲哚降解相关菌株的系统进化树
2.3 高通量测序与纯培养不同阶段菌属对比
由于这8株菌是在反应器运行的不同阶段分别筛选、分离培养的,因此对纯培养和微生物群落得到的吲哚降解的菌属进行对比.柱状图为各个阶段群落中占比前五的菌属.如图4所示,发现在

(a) 阶段Ⅰ
阶段Ⅰ、Ⅲ筛选得到的4株菌都是这一阶段群落中占比前五的菌属.纯培养得到的Burkholderia菌属的菌株占比50%,尽管Burkholderia在微生物群落组成中丰度不是很高,但它是一个多功能的菌属,在生态环境中发挥着重要的作用,也因其降解有机污染物的能力而闻名[24].实验结果表明,在反应器有机物富集阶段同时进行纯培养筛菌,一定程度上可以获得与微生物群落中优势菌属对应的单菌株.
2.4 菌株特性
2.4.1 8株菌的菌株特性 在两种培养基体系里,分别测定它们在12 h和24 h对吲哚的去除率,如图5(a)和5(b)所示.在无机盐培养基中,以吲哚为唯一碳源,菌株YJIP-F2在12 h吲哚降解率R最高.在1/10 LB培养基中,以吲哚和苯酚共代谢,菌株YJIP-F1在12 h吲哚降解率可达70.14%.两个体系中YJIP-Tw1降解效果都不佳,可能由于YJIP-Tw1是Dyella菌属,因而在降解吲哚过程中可能需要更长的时间,目前有关Dyella菌降解吲哚的研究报道很少见.


(a) 无机盐培养基中吲哚去除率
2.4.2Burkholderiasp. YJIP-F1的形态特征及生长曲线Burkholderiasp. YJIP-F1在固体培养基上的菌落呈现为白色圆点状,表面光滑,边缘整齐.通过SEM观察,菌株为短杆状,长度为1~2 μm,无鞭毛.由菌株的生长曲线可知,在培养过程中菌株有4 h的迟缓期,随即进入对数生长期,在24 h时达到稳定期,见图6.

(a) 菌落形态
2.4.3 吲哚、苯酚降解及靛蓝合成特性曲线Burkholderiasp. YJIP-F1降解吲哚、苯酚以及靛蓝生成曲线如图7所示.结果表明,在整个过程中吲哚被优先降解,100 mg/L吲哚在20 h降解完全;100 mg/L苯酚在36 h降解完全;靛蓝生成从12 h开始,在40 h左右产量基本达到稳定.

图7 Burkholderia sp. YJIP-F1的吲哚、苯酚降解及靛蓝生成曲线
2.4.4Burkholderiasp. YJIP-F1降解吲哚的途径推测 利用液相色谱-飞行时间质谱联用技术(LC/TOF-MS)对菌株降解吲哚过程的中间产物进行测定.与之前报道过的有关吲哚降解文献比较分析[25],检测到质荷比m/z为148.040 4、146.024 9、164.035 2、136.040 4、109.029 3、261.065 6 的分子离子峰分别对应2,3-二羟基吲哚、靛红、靛红酸、邻氨基苯甲酸、邻苯二酚以及靛蓝(图8).
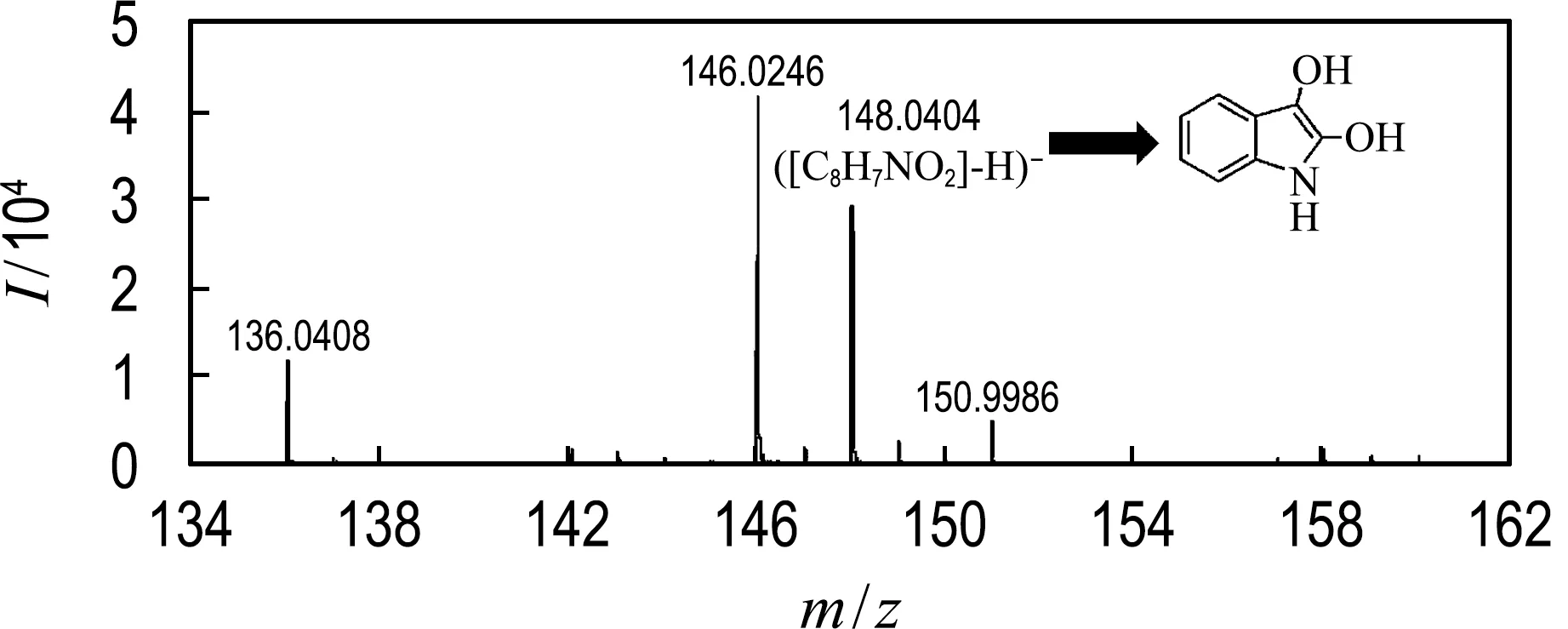
(a) 2,3-二羟基吲哚
根据产物分析结果及相关文献报道[8,22,26],推测Burkholderiasp. YJIP-F1可能的降解途径如图9所示,菌株YJIP-F1将吲哚先羟基化为吲哚酚,吲哚酚经两个分支途径进行代谢.途径Ⅰ是在空气中自发二聚合成靛蓝.因为菌株YJIP-F1在苯酚共基质条件下会产生靛蓝,推测苯酚的刺激可能会诱导菌株内苯酚羟化酶的表达,苯酚羟化酶能够催化吲哚合成靛蓝[27-28].途径Ⅱ是在加氧酶的作用下生成2,3-二羟基吲哚,再转化为靛红.部分靛红水解为靛红酸,其余转化生成邻氨基苯甲酸,再代谢为邻苯二酚,最终进入TCA循环.菌株YJIP-F1降解吲哚途径与Burkholderiasp. IDO3类似[12].

图9 Burkholderia sp. YJIP-F1降解吲哚途径推测
2.4.5 菌株合成靛蓝的条件优化Burkholderiasp. YJIP-F1在苯酚的诱导下能够转化吲哚合成靛蓝.这个过程中吲哚、苯酚以及酵母浸粉可能会对靛蓝的合成产生影响.因此进行了单因素和多因素的优化实验.初始条件是100 mg/L 吲哚、100 mg/L 苯酚及0.5 g/L酵母浸粉.
(1)单因素优化

(a) 吲哚
(2)多因素优化
多次预实验确定多因素的合理优化范围:吲哚0.10~0.15 g/L,苯酚0.1~0.2 g/L,酵母浸粉0.1~0.5 g/L.利用软件Design Expert 8.0.6设计实验,得到相关条件和结果如表2所示.得到回归方程为Y=8.54+1.16A+0.42B-0.57C-0.49AB+0.39AC-0.57BC-0.82A2-0.86B2-0.43C2.其中Y是靛蓝产率,A是吲哚浓度,B是苯酚浓度,C是酵母浸粉浓度.

表2 Burkholderia sp. YJIP-F1转化吲哚合成靛蓝的优化实验设计
进行方差分析,结果见表3.模型的F值为6.74,p值小于0.05,R2为0.86.说明该模型具有显著性以及86%的可信度.此外,A、A2、B2和C的p值均小于0.05,说明在Burkholderiasp. YJIP-F1转化吲哚合成靛蓝时,3种因素均存在显著影响.

表3 响应面模型的方差分析结果
利用软件绘制各因素相互作用的3D响应图,如图11所示.结合单因素和多因素实验,发现在一定范围内,靛蓝产率都会呈现出先升高后降低的趋势.吲哚作为菌株合成靛蓝的作用底物,当浓度在适当范围内增加时,靛蓝产率会增加.但是过量的吲哚对菌株有毒性作用,会影响菌株生长[13].苯酚能够诱导菌株内一些加氧酶的表达,适量的苯酚浓度有利于提高苯酚羟化酶的表达量,进而利于靛蓝合成.同样苯酚过量不利于菌株生长[28].酵母浸粉中富含微量元素、维生素等,一定浓度的酵母浸粉对菌株生长及相关酶的表达有利.当体系存在过多酵母浸粉时,菌株可能会更偏向直接利用酵母浸粉生长,从而影响吲哚的羟基化过程,最终导致靛蓝产率下降.

(a) 吲哚浓度和苯酚浓度
根据以上分析,最终得到Burkholderiasp. YJIP-F1合成靛蓝产率最优条件为吲哚0.14 g/L,苯酚0.17 g/L,酵母浸粉0.16 g/L.在此条件下靛蓝产率为9.07%,与初始条件的产率3.74%相比,提高了1.43倍.与用同种方法优化靛蓝产率的相关文献报道的菌株相比[22,28-29],Burkholderiasp. YJIP-F1合成靛蓝产率处于中等水平.后续可考虑利用组学等技术进一步提高菌株转化吲哚生成靛蓝的产率.
3 结 语
本研究首次探讨了在反应器同一阶段,从活性污泥中筛选得到的菌株菌属和微生物群落组成中优势菌属之间的联系.在有机物富集阶段进行纯培养筛菌,一定程度上可以获得与微生物群落中优势菌属对应的单菌株.此外,综合吲哚降解和靛蓝合成能力,从8株菌中选取Burkholderiasp. YJIP-F1作为后续实验菌株,探究了菌株的基本特性并优化靛蓝合成产率,为生物法合成靛蓝类色素提供了新的菌株资源.
