耐高渗酵母的选育及其在北冰红葡萄酒中的应用
2022-11-23蒋海娇郭建华李永翔史秀
蒋海娇,郭建华,李永翔,史秀
耐高渗酵母的选育及其在北冰红葡萄酒中的应用
蒋海娇,郭建华,李永翔,史秀
(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
:耐高渗酵母菌在浓醪发酵中起着重要的作用。从不同产地的酒曲中筛选耐高渗酵母,选育出具有良好发酵性能的冰酒专用酿酒酵母。结果表明,分离得到的3株酵母菌,编号为J-1,J-2,J-3,均有较好的糖、乙醇、酸和SO2耐受性,能在高糖、高酸的北冰红葡萄汁中发酵良好,对后续冰酒的研究提供参考。
酵母菌;耐高渗;鉴定;浓醪发酵
酵母菌由于细胞结构,会受到一些高盐,高糖等环境因素的影响,过高的渗透压会直接造成酵母菌菌体内部的脱水,死亡,但是有些酵母在高浓度下仍然能够可生存,发酵[1-2]。大量的研究结果表明,酵母菌自身有一套体系,它可以根据渗透压力情况进行适当的调节[3],在现代酿造和发酵技术中,浓醪发酵[4]越来越多地受到人们的青睐,这种浓醪发酵由于其环境特殊,制得的酒精浓度相对比较高,同时醪液中的糖度也高,普通酵母在乙醇浓度达到11%左右时[5-6],发酵就会受到抑制,产酒量达不到标准,如果能筛出一株耐高渗的酵母,将其渗透性质应用到浓醪发酵,就可以很好地为其生产提供服务[7-8]。耐高渗酵母具体应用主要可以大致归结到以下几个方面:(1)生产甘油[9],酵母细胞为了适应在高渗透压的环境,会在细胞内累积甘油用以抵抗高渗透压。(2)固定化酵母生产乙醇[10]。(3)赤藓糖的生产[11],赤藓糖醇是多元糖醇的一种,可以防龃齿,适合糖尿病患者食用,作为功能食品现在正在被人们开发。(4)浓醪发酵,应用到冰酒的酿造和制糖工业中[12]。
1 实验部分
1.1 材料与试剂
广西甜酒曲,福建红酒曲;葡萄糖、蛋白胨、酵母膏,生工生物工程(上海)股份有限公司;L-阿拉伯糖,可溶性淀粉,北京奥博星生物技术有限责任公司;硫酸镁、硝酸铵、氯霉素等均为国产分析纯试剂。
1.2 仪器与设备
恒温培养箱SPX-150II,天津市泰斯特仪器有限公司;紫外分光光度计TU-1810,北京普析通用仪器有限责任公司;全温振荡器JBQ-ZD,常州普天仪器制造有限公司;正置显微镜nikon50i,日本Nikon有限公司;手提式压力蒸汽灭菌器DSX-280B,上海申安仪器有限公司。
1.3 培养基的配制
酵母膏葡萄糖琼脂培养基(g/L):酵母膏10.0g,葡萄糖20.0g,蛋白胨20.0g,琼脂20.0g,121℃灭菌30min。
孟加拉红培养基(g/L):蛋白胨5.0g,葡萄糖10.0g,磷酸二氢钾1.0g,硫酸镁0.5g,孟加拉红0.033g,氯霉素0.1g,琼脂20.0g,121℃灭菌15min。
糖基础培养基(g/L):葡萄糖20.0g,氯化钠5.0g。
水解尿素培养基(g/L):蛋白胨1.0g,NaCl 5.0g,磷酸二氢钾1.5g,酚红0.012g。
产酸培养基(g/L):葡萄糖2.0g,CaCO30.5g,酵母膏1.0g,琼脂2.0g。
1.4 实验方法
1.4.1 酵母菌的分离,纯化
将酒曲磨成粉末状,取1g置于20mL无菌水中,在30℃,180r/min的摇床中培养5h,取出后进行离心。无菌条件下将上清液分别稀释为10﹣2,10﹣3和10﹣4,吸取100µL稀释液用涂布棒均匀的涂抹在培养基上,30℃培养2d。然后在平板上得到形似酵母菌的单个菌落,进行传代直至得到纯种,4℃斜面保藏备用。
1.4.2 菌落形态特征鉴定
菌落形态观察:将菌体分别接种于YPD固体培养基和虎红培养基上,于30℃连续培养2d,观察菌落的大小,形态以及颜色等特征。
细胞形态观察:在载玻片上滴加一滴1%的结晶紫染色液染色后,在显微镜下观察细胞的形态特征。
1.4.3 菌体生长曲线
在YPD液体培养基中接入2%的菌体,每隔2h在无菌环境下取样,以未接种的YPD做空白对照。
1.4.4 产气能力测定
将处于生长对数期的酵母菌接种于含有杜氏小管的培养基中,于30℃恒温静置培养,每隔8h观察1次杜氏小管内的充气情况。
1.4.5 生理生化特征鉴定
根据《酵母菌的特征和鉴定手册》进行糖发酵鉴定,碳源同化实验,氮源同化实验,产酸实验,脲酶实验,类淀粉化合物实验。
1.4.6 耐糖性实验
将实验酵母菌用生理盐水调节菌体浓度为1.0×108个,吸取2mL菌液分别接种于15%, 25%, 35%, 45%, 55%, 65%, 75%的葡萄糖含量的液体培养基中,30℃培养24h,在波长600nm处测其吸光度值并做空白对照。
1.4.7 耐酸性实验
将实验酵母菌分别接种于pH为1.5, 2.0, 2.5, 3.0, 3.5, 4.0的液体YPD中,30℃培养24h,在波长600nm处测其吸光度值并做空白对照。
1.4.8 耐乙醇实验
实验酵母菌分别采用不同的乙醇体积分数6%, 8%, 10%, 12%, 14%, 16%的液体培养基中30℃培养24h,在600nm处测其吸光度值并做空白对照。
1.4.9 耐SO2实验
将实验酵母菌分别采用不同浓度的二氧化硫100, 200, 300, 400, 500mg/L在30℃培养24h,在600nm处测其吸光度值并做空白对照。
1.4.10 北冰红葡萄酒发酵
将筛选出的菌株进行冰酒发酵实验,工艺流程为:新鲜北冰红葡萄→清洗榨汁→冷冻浓缩→接种→控温发酵→中止发酵→陈酿→杀菌→装瓶。在500mL锥形瓶中装入200mL葡萄汁,其pH值为2.8,总糖(以葡萄糖计)400g/L,接种量6%,发酵温度为15℃。
2 结果与讨论
2.1 酒曲中酵母菌的筛选
2.1.1 酵母菌形态及培养特征
分离出的3株菌体,菌落形态和细胞形态如表1和图1所示。由表1和图1可知,菌株J-1,J-2和J-3的菌落形态及细胞形态基本一致,菌落为圆形,凸起,白色或乳黄色,细胞形态为圆形或卵圆形,出芽生殖。根据菌落和细胞形态特征初步筛选出J-1,J-2和J-3为酵母菌。
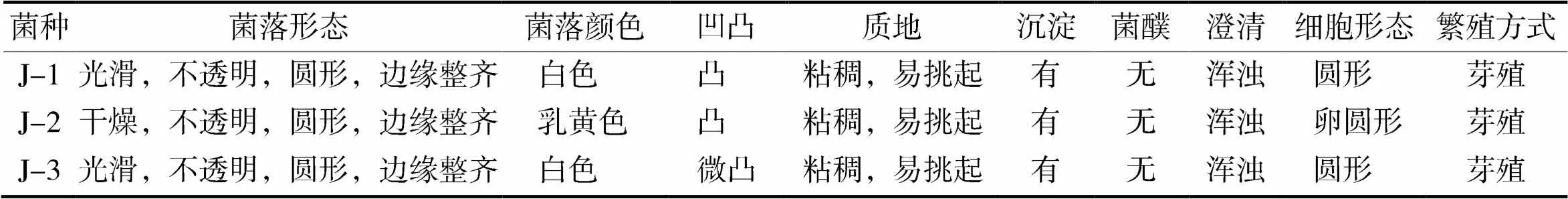
表1 分离菌株的菌落形态和细胞形态
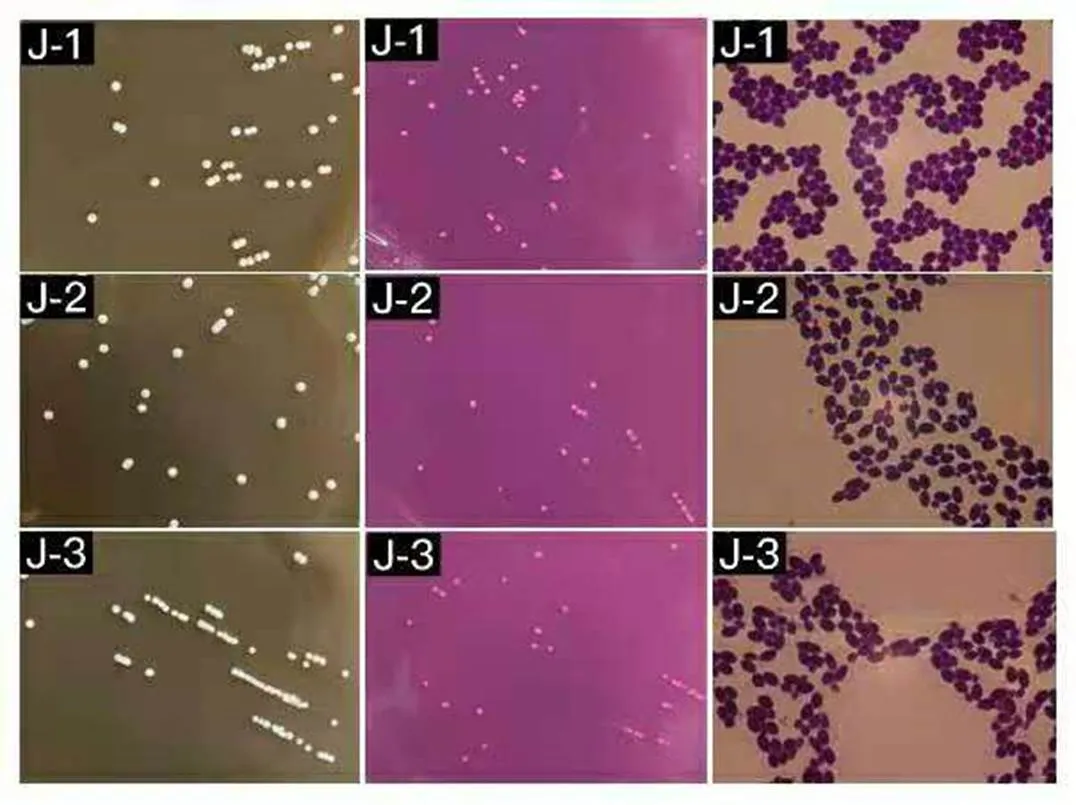
图1 酵母菌在YPD和虎红培养基上菌落形态以及细胞形态(显微镜放大倍数为10×100)
2.1.2 菌体生长曲线
由图2可以看出,酵母菌依次经历了迟滞期、对数期、稳定期3个不同的生长时期。在前4h的菌体浓度并没有显著变化,处于迟滞期,因为微生物的新陈代谢需要足够的时间来适应新环境,在培养4h后呈现明显的指数增长趋势,菌体浓度急剧上升进入对数期,10h以后生长速度逐渐缓慢,进入稳定期,后续的研究中采用6~10h的菌体制备菌悬液。
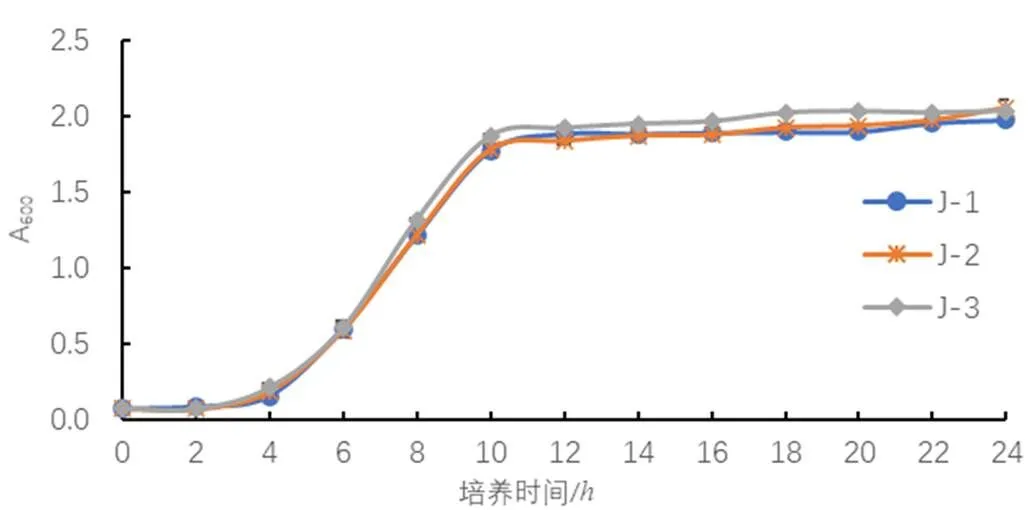
图2 菌体生长曲线
2.1.3 产气能力测试结果
通过酵母菌的产气量可得发酵性能良好且生长旺盛的菌株,据表2可知3株菌株在培养8h时就产生气体,J-1菌株在16h时产气充满杜氏小管,可以看出3株菌都有一定的产气能力且顺序大小为J-1>J-2=J-3据排气量测定结果,J-1产气量更强一些。
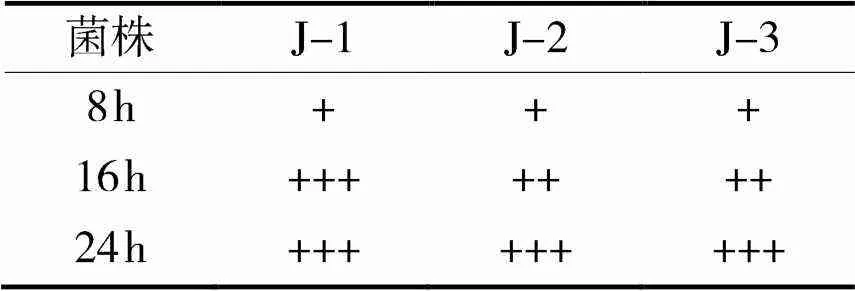
表2 酵母菌产气能力
“+”表示产出的气量小于杜氏管的1/2,
“++”表示产出的气量大于杜氏管的1/2,
“+++”表示产出的气量充满整个杜氏管。
2.1.4 生理生化鉴定结果
通过查询《酵母菌的特征与鉴定手册》,根据表3和表4可知,鉴定J-1,J-2及J-3三株酵母菌均为酿酒酵母属()。

表3 分离菌株生理生化特征
“+”表示可利用;“-”表示不可利用
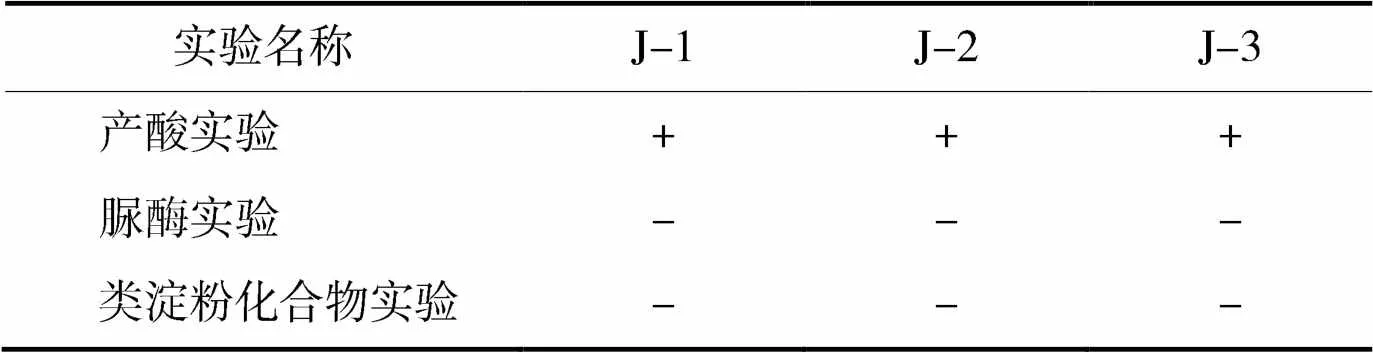
表4 其他生理生化实验
“+”表示阳性;“-”表示阴性
2.1.5 酵母菌的糖度耐受性结果
由图3可知,这3株酵母菌随着培养基内含糖量的增多吸光度值逐渐减小,当培养基含糖量高达75%时,J-2与J-3吸光度值接近零点说明这株酵母菌不再生长,但酵母菌株J-1则可以生长,冰葡萄汁糖度一般在35~42°Brix,所以这3株酵母菌均能在葡萄汁中发酵。
2.1.6 酵母菌的酸性耐受性结果
将筛出的3株酵母菌接种于酸度不同的培养基中,如图4在pH=1.5和2.0的时候,J-1和J-2酵母菌生长受到抑制,菌株J-3的耐酸性最强。
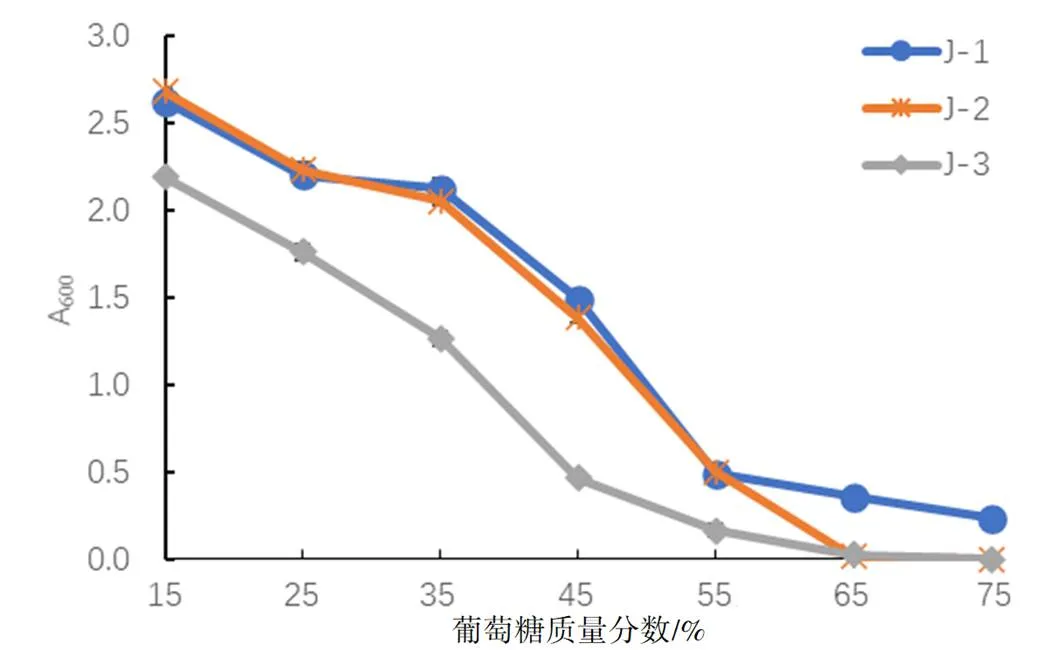
图3 不同葡萄糖质量分数对酵母菌生长情况的影响
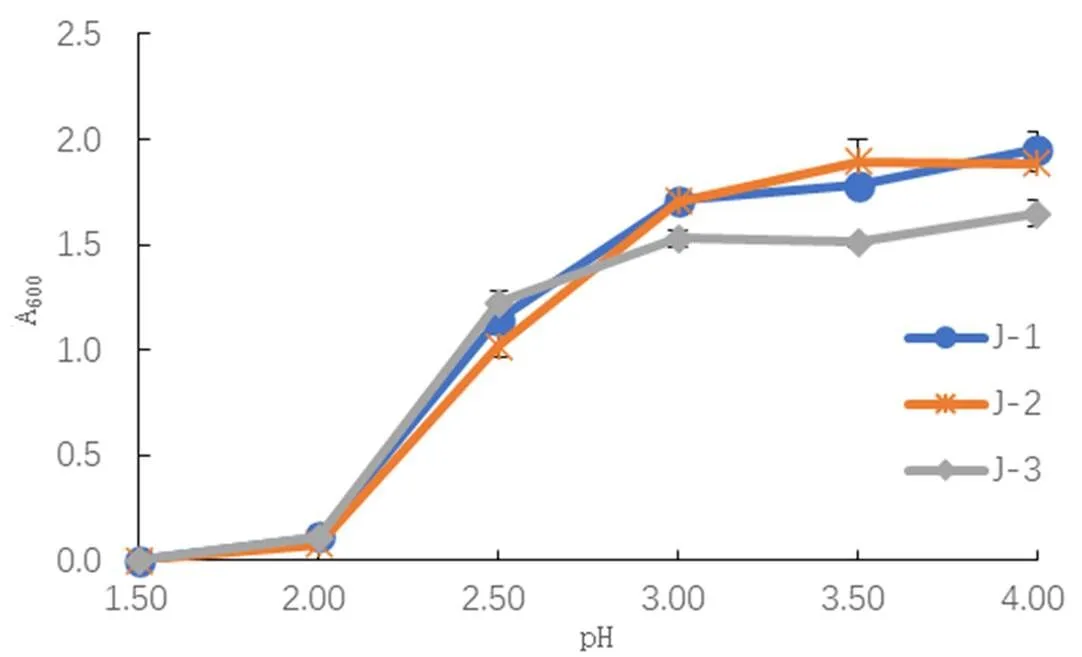
图4 不同酸性含量对酵母菌生长情况的影响
2.1.7 酵母菌的SO2耐受性结果
将纯化后的3株酵母菌直接接种到不同含量二氧化硫的YPD液体培养基中,结果如图5所示,J-1与J-2在不同浓度的二氧化硫作用下影响不大,这3株菌都能够耐受一定浓度的二氧化硫。
2.1.8 酵母菌的乙醇耐受性结果
由图6可知,随着乙醇含量的增加,菌体数逐渐降低,结果表明,菌株均可耐受14%(体积分数)乙醇。通常情况下,冰酒的酒精度(体积分数)在11%左右,因此,在乙醇耐受性方面,J-1,J-2,J-3完全可以满足酿制冰酒的需要。
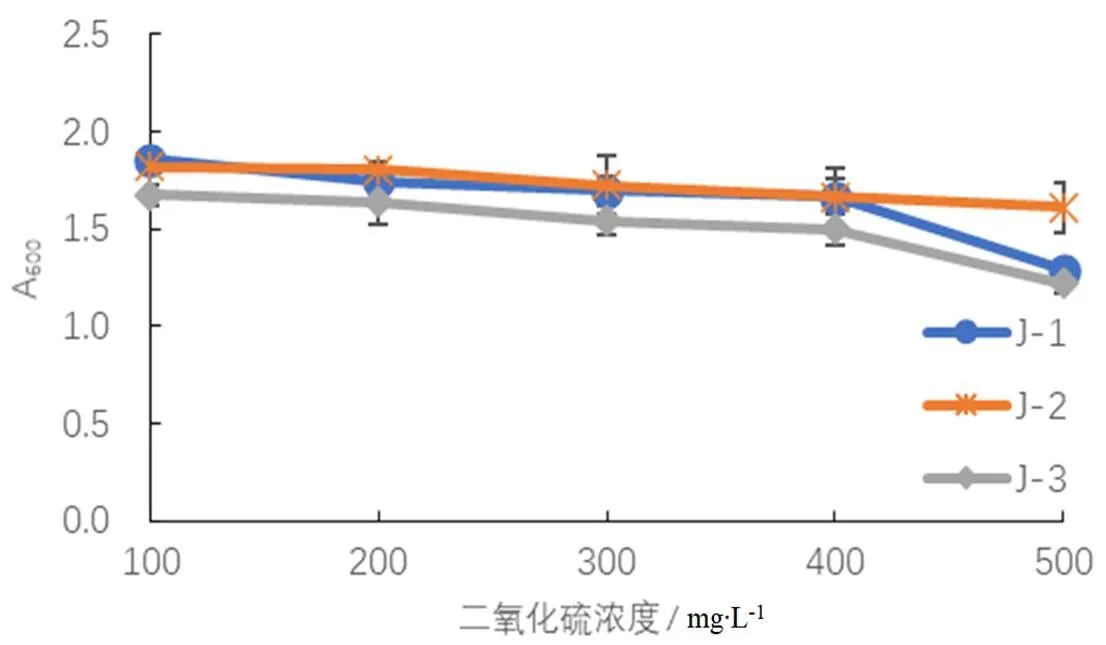
图5 不同的二氧化硫质量浓度对酵母菌活性的影响
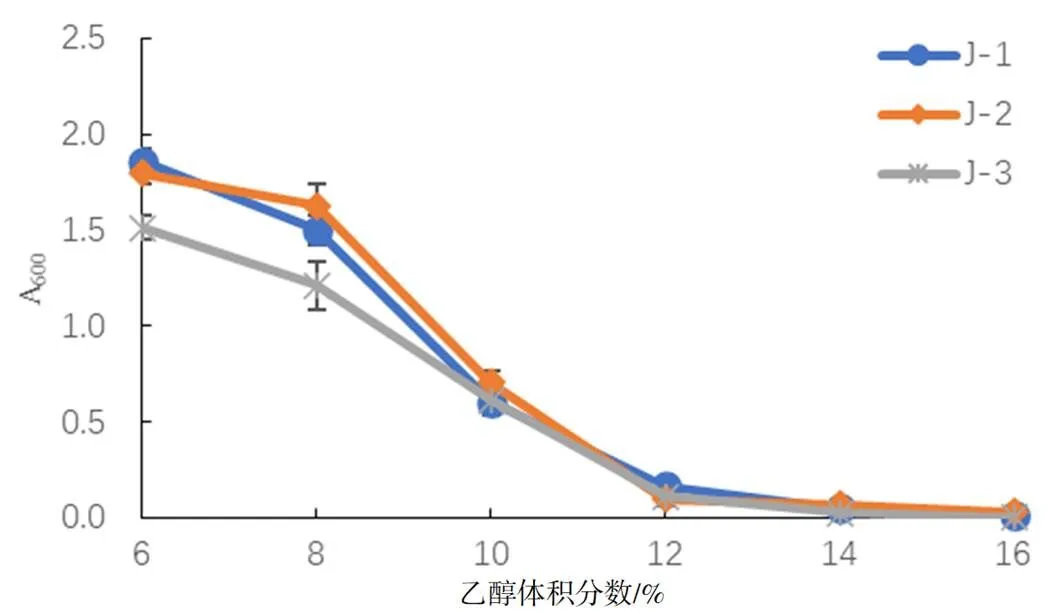
图6 不同酒精含量对酵母菌生长情况的影响
2.2 北冰红葡萄酒发酵实验
将菌株J-1,J-2及J-3分别接种于北冰红葡萄汁中,经24d主发酵过程结束后,检测葡萄酒的酒精度,残糖,总酸以及挥发酸的含量,结果如表6所示,菌株J-1,J-2及J-3发酵的葡萄酒理化指标均符合GB/T 25504-2010《冰葡萄酒》的要求。
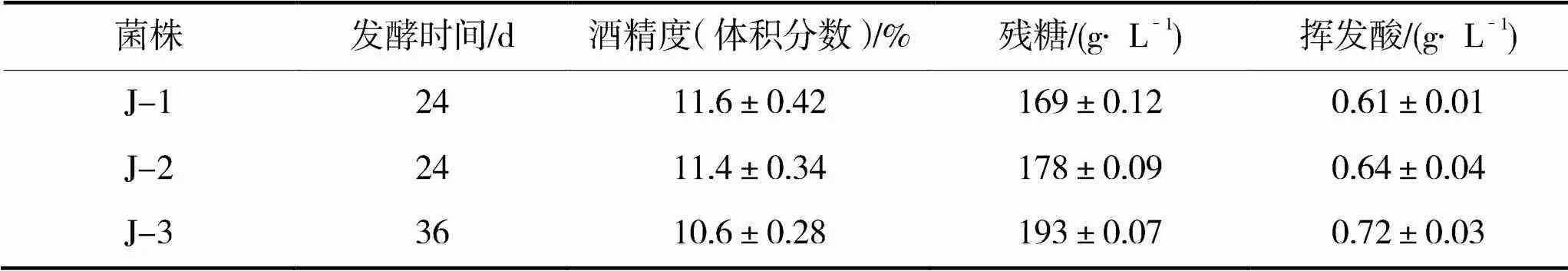
表5 北冰红葡萄酒发酵实验结果
3 结论
本实验从酒曲中经过初筛,复筛,选育出3株耐高渗酵母,并对其发酵特性进行研究。根据菌落形态、细胞形态、生理生化鉴定J-1,J-2,J-3均为酿酒酵母属。耐受性测定结果表明3株菌均可耐受乙醇(体积分数)14%,耐受糖含量550g/L,二氧化硫500mg/L,完全满足北冰红葡萄酒发酵要求,本研究对优化北冰红葡萄酒发酵工艺,提高冰酒风味有重要意义,也可用于工业上浓醪发酵,带来更大经济效益。
[1] 郑美娟,余华顺. 酵母菌耐高渗机理研究[J]. 酿酒科技,2008(10): 37-39, 43.
[2] 赵硕,李平,王卿. 耐高糖酵母菌株的选育及应用[J]. 安徽农业科学,2010, 38(09): 4801-4803.
[3] 覃赵军,彭立新,王晓春,等. 单细胞喇曼光谱分析高渗环境对酵母乙醇发酵代谢的影响[J]. 光子学报,2016, 45(02): 112-119.
[4] LALOU S, CAPECE A, MANTZOURIDOU F T, et al. Implementing principles of traditional concentrated grape must fermentation to the production of new generation balsamic vinegars. Starter selection and effectiveness[J]. Journal of Food Science and Technology, 2016, 53(9): 3424-3436.
[5] 贺东海. 耐高渗酒精酵母的筛选[D]. 济南:齐鲁工业大学,2011.
[6] 赵红梅,刘景武,张伟. 耐高渗酵母的分离、筛选及鉴定[J]. 食品研究与开发,2006, 27(06): 34-37.
[7] 赵硕. 耐高渗(高糖)酵母菌株的选育[D]. 合肥:安徽农业大学,2010.
[8] 张强,袁旭东,卞文治,等. 玉米浓醪酒精发酵工艺的研究[J]. 酿酒科技,2019(07): 36-39, 42.
[9] 余秉琦,诸葛健. 酵母细胞对高渗环境的适应与胞内甘油累积[J]. 中国生物工程杂志,2003, 23(02): 25-28.
[10] 刘晓峰,李莉. 固定化酵母在酒精浓醪发酵中的技术问题[J]. 山东食品发酵,2008(04): 13-14.
[11] 吴燕,陆茂林,杨晓伟. 耐高渗酵母B845产赤藓糖醇的研究[J]. 江苏食品与发酵,2001(04): 7-9.
[12] 樊洁,韩烨,周志江,等. 蜂蜜中耐高渗透压酵母菌的分离与鉴定[J]. 食品工业科技,2014, 35(09): 165-168, 173.
Breeding of hyperosmotic tolerant yeast and its application in Beibing red wine
JIANG Hai-jiao,GUO Jian-hua,LI Yong-xiang,SHI Xiu
(College of Food and Biological Engineering, Qiqihar University, Heilongjiang Qiqihar 161006, China)
High glucose tolerance yeast plays an important role in the fermentation of thick mash. In this paper, the yeast with high permeability tolerance was screened from fermented koji from different producing areas, and the Saccharomyces cerevisiae for ice wine with good fermentation performance was screened. The results showed that the isolated yeast strains, coded as J-1, J-2 and J-3, all had good tolerance to sugar, ethanol, acid and SO2, and could be fermented well in Beibing red grape juice with high sugar and acid content, which provided reference for the research on ice wine in the future.
yeast;resistance to high permeability;appraisal;thick mash fermentation
2021-05-06
黑龙江省省属高等学校基本科研业务费科研项目(YSTSXK201838)
蒋海娇(1996-),女,黑龙江黑河人,在读硕士,主要从事食品科学研究,3292565941@qq.com。
TS262.6
A
1007-984X(2022)01-0076-05
