组织蛋白酶B介导NLRP3小体在砷致小胶质细胞炎症激活中的作用*
2022-11-22张哲昱皮若铮方惠民孙宝飞
张哲昱 皮若铮 刘 吉 方惠民 杨 丹 孙宝飞
(贵州医科大学基础医学院人体解剖学教研室,贵阳 550000)
砷及其化合物广泛存在于自然界中,是目前危害人群健康的主要环境污染物之一。国际癌症研究机构已确认无机砷为人类致癌物[1]。世界卫生组织估计,70个国家的2亿多人的饮用水中无机砷(As)水平超过世卫组织指南和美国环境保护局(EPA)给出的最高污染物水平10 μg/L[2]。长期暴露于有砷的环境下,使砷通过呼吸道、消化道和皮肤接触等途径进入机体,并在体内蓄积,引起砷中毒。长时间的砷暴露会引起严重的疾病,如糖尿病、高血压、心血管疾病、神经系统疾病和癌症。流行病学研究表明,长期接触无机砷可损害记忆、学习能力、智力和认知功能,并诱发神经炎症[3]。在发育时期接触无机砷可导致智力功能下降[4]。已有啮齿类动物实验表明,饮用含50 mg/L亚砷酸钠(NaAsO2)水可导致学习记忆障碍[5],并且这些化合物能够通过血脑屏障[6]。到目前为止,已有证据表明无机砷暴露可诱导部分神经元死亡、脑内胶质细胞凋亡、神经炎症和神经变性[7]。其中,神经炎症是目前神经退行性疾病发病机制中公认的因素之一,并与记忆功能下降和认知功能减退有关[8]。在神经退行性疾病的发生与发展中,观察到脑内存在激活的胶质细胞诱导的炎症反应,其中高反应性的小胶质细胞(microglia)可能导致神经元功能异常和认知缺失。由过度活化的胶质细胞分泌的多种炎症因子积聚于脑内环境中,引发神经元焦亡。有研究表明,结晶体和颗粒状物质被细胞吞噬入胞内后,可致胞内溶酶体破坏,进而其中的组织蛋白酶释放入胞浆[9]。组织蛋白酶B(CTSB)对NLRP3的激活过程有促进作用,激活的NLRP3炎症小体使Caspase-1自身水解活化,活化的Caspase-1切割低活性的pro-IL-1β和pro-IL-18形成性质活跃的IL-18和IL-1β[10]。本实验旨在研究NaAsO2通过提高胞内CTSB的水平,从而激活NLRP3炎症小体,诱导小胶质细胞的炎症反应作用。为进一步探索砷致神经系统损伤提供基础。
1 材料与方法
1.1 材料
1.1.1实验细胞
本研究采用的BV-2小鼠小胶质细胞系购自中国科学院典型培养物保藏委员会昆明细胞库(KCB)。
1.1.2主要试剂
NaAsO2(美国Sigma公司);RPMI1640培养基,胎牛血清(美国Gibco公司,8122013);BCA蛋白质浓度测定试剂盒(中国索莱宝公司,PC0020);Lyso-Tracker Green(中国碧云天公司,C1047S);CTSB(12216-1-AP,1∶200),Caspase-1(22915-1-AP,1∶500),NLRP3(19771-1-AP,1∶300)多克隆抗体(美国Proteintech公司);IL-1β(YT5201,1∶500)、IL-18(YN1926,1∶500)多克隆抗体,山羊抗兔IgG(S0002,1∶5 000)抗体(美国Immunoway公司);anti-β-actin(81115-1-RR,1∶5 000)抗体(美国Proteintech公司),辣根过氧化物酶(美国Millipore公司,WBKLS0100)。
1.1.3主要仪器
5% CO2培养箱,高速离心机购自Thermo公司;96孔板,细胞培养皿购自中国NEST公司;电泳仪购自Bio-Rad公司。
1.2 方法
1.2.1细胞培养
BV-2细胞培养于培养基(20%胎牛血清、1%100 mmol/L青霉素和100 mmol/L链霉素、79%RPMI 1640)中,置37℃、5% CO2细胞培养箱内培养,隔天进行换液,2~3 d传代1次。融合培养采用胰酶消化传代。取处于对数生长期的细胞用于实验。
1.2.2CCK-8实验
取生长状态良好的BV-2小胶质细胞接种于96孔板内,调整细胞密度为5 000个/孔。设置空白对照组(无任何干预处理),4个实验组,每个组包括6个复孔,培养24 h后,分别更换含0、2、4、8、16 μmol/L NaAsO2的培养基继续培养24 h。24 h后弃上清,每孔避光加入100 μl(不含血清的RPMI1640∶CCK-8=9∶1)CCK-8工作液。避光孵育2 h后放入酶标仪中,测定450 nm处每孔A值。
1.2.3溶酶体探针实验
取少量Lyso-Tracker Green按照1∶13 333~1∶20 000的比例加入到细胞培养液或适当的溶液中,配制成工作液并置于37℃温育。取出细胞培养皿,加入胰酶消化到EP管中,弃上清。加入PBS缓冲液,1 200 r/min离心5 min,弃上清,重复2次。加入工作液,与细胞37℃共孵育15 min。孵育结束,1 200 r/min离心5 min,弃上清。加入PBS缓冲液,1 200 r/min离心5 min,弃上清,重复两次。加入PBS与管内剩余细胞充分混匀,使用流式细胞仪检测。
1.2.4蛋白质免疫印迹实验
取出细胞培养皿,弃去培养基,加入预冷的PBS清洗,并弃去清洗液,再用移液枪吸取200 μl裂解液(RIPA∶PMSF=100∶1)加入到培养皿中。10 min后用细胞刮刮取皿底的贴壁细胞,吸取皿中的混液到EP管中,离心。完成后,吸取上清液到新的EP管中,取部分用于定量,其余加入5×Loading Buffer缓冲液,加入量为EP管中蛋白质体积的1/4,放入沸水中加热5~10 min取出,冷却,可用于蛋白质免疫印迹实验。进行BCA蛋白质定量,根据蛋白质定量数据,上样,电泳。完成后,200 mA、2 h条件进行转膜,50 g/L脱脂奶粉封闭过夜,孵育一抗,洗膜,孵育二抗,洗膜,曝光显影,凝胶成像仪上进行蛋白质条带检测和灰度分析。
1.3 统计学处理
采用SPSS 26.0和GraphPad Prism 8.4.3软件进行统计分析,正态性检验采用Shapiro-Wilk检验。正态分布资料以±s表示,多组间比较采用单因素方差分析,两两间多重比较采用LSD-t检验。多组比较采用Kruskal-Wallis H检验,两两比较采用Mann-Whiteny U检验。实验至少重复3次,P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度NaAsO2对BV-2小胶质细胞细胞活力的影响
不同浓度(0、2、4、8、16 μmol/L)NaAsO2作用BV-2小胶质细胞24 h,细胞活力总体差异有统计学差异(F=72.71,P<0.01)(图1)。组内两两多重比较显示,与对照组(0 μmol/L)比较,2、4、8、16 μmol/L组 均 有 统 计 学 差 异(P2μmol/L=0.034,P4μmol/L<0.01,P8μmol/L<0.01,P16μmol/L<0.01)。表明2、4、8、16 μmol/L浓度的NaAsO2可以导致细胞活力下降,16 μmol/L浓度的NaAsO2导致细胞活力显著下降,对细胞毒作用较强。参考CCK-8结果及其他文献,后续研究采用2,4,8 μmol/L作为NaAsO2的实验浓度。
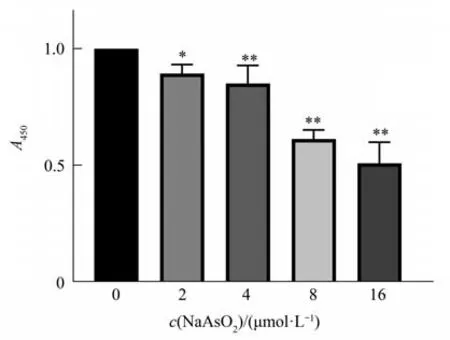
Fig.1 Effects of different concentrations of NaAsO2onBV-2 cell viability
2.2 不同浓度NaAsO2对BV-2胞内溶酶体水平的影响
不同浓度(0、2、4、8 μmol/L)NaAsO2作用BV-2小胶质细胞24 h,对照组(0 μmol/L)与2 μmol/L、4 μmol/L和8 μmol/L NaAsO2组的细胞内溶酶体水平总体差异有统计学意义(F=7.385,P<0.01),实验重复3次(图2)。组内两两多重比较显示,与对照组(0 μmol/L)比较,2 μmol/L、4 μmol/L和8 μmol/L组的细胞内溶酶体减少,差异有 统 计 学 意 义(P2μmol/L=0.030,P4μmol/L=0.025,P8μmol/L<0.01)。
2.3 不同浓度NaAsO2对小胶质细胞胞内CTSB水平的影响
对照组(0 μmol/L)和2 μmol/L、4 μmol/L和8 μmol/L NaAsO2组细胞内CTSB水平总体差异有统计学意义(F=11.84,P<0.01),实验重复3次(图3)。组内两两多重比较显示,与对照组(0 μmol/L)比较,2 μmol/L、4 μmol/L和8 μmol/L组 细 胞 内CTSB的 水 平 均 升 高(P2μmol/L=0.031,P4μmol/L<0.01,P8μmol/L<0.01),差异有统计学意义。
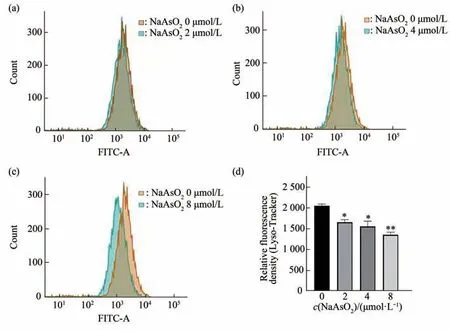
Fig.2 Effects of different concentrations of NaAsO2 on the level of intracellular lysosomes in BV-2
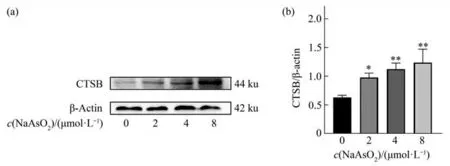
Fig.3 Effects of different concentrations of NaAsO2 on the level of intracellular CTSB in BV-2
2.4 不同浓度NaAsO2对小胶质细胞胞内NLRP3炎症小体和Caspase-1水平的影响
对照组(0 μmol/L)和2 μmol/L、4 μmol/L和8 μmol/L NaAsO2组细胞内NLRP3和Caspase-1水平总体差异有统计学意义(FNLRP3=20.75,PNLRP3<0.01;FCaspase-1=41.13,PCaspase-1<0.01),实验重复3次(图4)。与对照组(0 μmol/L)比较,4 μmol/L和8 μmol/L组细胞内NLRP3和Caspase-1的水平均升高(P<0.01)差异有统计学意义。

Fig.4 Effects of different concentrations of NaAsO2 on the level of intracellular NLRP3,Caspase-1 in BV-2
2.5 不同浓度NaAsO2对小胶质细胞胞内IL-1β和IL-18水平的影响
对照组(0 μmol/L)和2 μmol/L、4 μmol/L和8 μmol/L NaAsO2组细胞内IL-1β和IL-18水平总体差异有统计学意义,(FIL-1β=31.19,PIL-1β<0.01;FIL-18=76.86,PIL-18<0.01),实验重复3次(图5)。与对照组(0 μmol/L)比较,4 μmol/L和8 μmol/L组 细 胞 内 的IL-18水 平 均 升 高(P4μmol/L=0.018,P8μmol/L<0.01)差 异 有 统 计 学 意 义,与 对 照 组(0 μmol/L)比较,2 μmol/L、4 μmol/L和8 μmol/L组 细 胞 内 的IL-1β水 平 均 升 高(P2μmol/L=0.036、P4μmol/L<0.01,P8μmol/L<0.01)。
2.6 CA074-Me干预小胶质细胞对胞内CTSB水平的影响
根据上述实验结果发现,与对照组(0 μmol/L)比较,8 μmol/L组的小胶质细胞胞内CTSB水平上升较显著,所以选择在8 μmol/L NaAsO2培养细胞的基础上加入5 μmol/L或10 μmol/L CTSB抑制剂CA-074Me干 预。对 照 组(8 μmol/L NaAsO2)、5 μmol/L CA074-Me干预组、10 μmol/L CA074-Me干预组,CTSB蛋白表达(F=53.66,P<0.01)差异有统计学意义,实验重复3次(图6)。组内两两多重比较显示,与对照组(8 μmol/L NaAsO2)相比,5 μmol/L CA074-Me组和10 μmol/L CA074-Me组细胞内CTSB的表达下降,差异有统计学意义(P5μmol/L=0.018,P10μmol/L<0.01)。
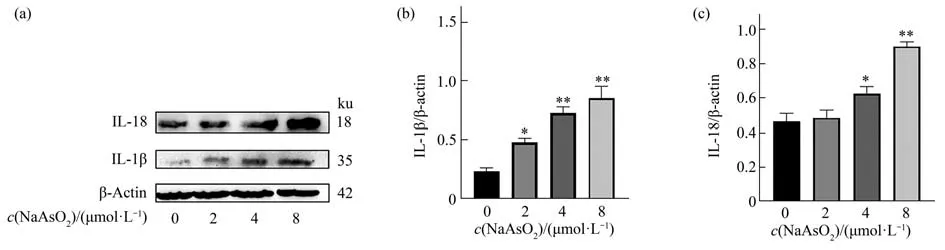
Fig.5 Effects of different concentrations of NaAsO2 on the level of intracellular IL-1β,IL-18 in BV-2

Fig.6 Effects of co-culture with 8 μmol/L NaAsO2 and different concentrations of CA074-Me on the level of CTSB in microglia
2.7 抑制剂干预小胶质细胞对胞内NLRP3炎症小体水平的影响
对照组(8 μmol/L NaAsO2)、5 μmol/L CA074-Me干 预 组、10 μmol/LCA074-Me干 预 组,胞 内NLRP3和Caspase-1浓度差异有统计学意义(FNLRP3=20.16,PNLRP3<0.01;FCaspase-1=41.75,PCaspase-1<0.01),实验重复3次(图7)。组内两两多重比较,与对照组(8 μmol/L NaAsO2)比较,加入CA074-Me的组NLRP3表达下降,差异有统计学意义(P5μmol/L=0.0253,P10μmol/L<0.01)。与 对 照 组(8 μmol/L NaAsO2)比较,加入CA074-Me的组Caspase-1表达下降,差异有统计学意义(P5μmol/L<0.01,P10μmol/L<0.01)。
2.8 抑制剂干预小胶质细胞对胞内IL-1β和IL-18水平的影响
对照 组(8 μmol/L NaAsO2)、5 μmol/L CA074-Me干预组、10 μmol/L CA074-Me干预组,IL-18和IL-1β差 异 有 统 计 学 意 义(FIL-1β=45.11,PIL-1β<0.01;FIL-18=23.99,PIL-18<0.01),实验重复3次(图8)。组内两两多重比较,与对照组(8 μmol/L NaAsO2)比 较,5 μmol/L CA074-Me干 预 组 和10 μmol/L CA074-Me干预组细胞内的IL-1β表达量下降,差异有统计学意义(P5μmol/L<0.01,P10μmol/L<0.01)。与 对 照 组(8 μmol/L NaAsO2)比 较,5 μmol/L CA074-Me干预组和10 μmol/L CA074-Me干预组细胞内的IL-18表达量下降,差异有统计学意义(P5μmol/L<0.01,P10μmol/L<0.01)。

Fig.7 Effects of co-culture with 8 μmol/L NaAsO2 and different concentrations of CA074-Me on the level of Caspase-1 and NLRP3 in microglia
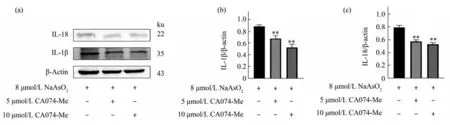
Fig.8 Effects of co-culture with 8 μmol/L NaAsO2 and different concentrations of CA074-Me on the level of IL-1β and IL-18 in microglia
3 讨 论
小胶质细胞是脑组织内一类重要的免疫效应细胞,作为中枢系统内唯一的巨噬细胞,具有免疫防御功能,主要有分枝状和阿米巴样两种形态,前者为静息状态,后者为激活状态[11]。小胶质细胞被激活后,在细胞的形态发生改变的同时,迁移、吞噬、增殖和抗原呈递功能也显著加强[12]。在分子水平上,激活后的小胶质细胞释放大量的IL-1、IL-6、TNF-α、TGF-β、活性氧(ROS)、NO和谷氨酸盐等炎性细胞因子和神经毒性物质[13],影响突触强度和可塑性,引起神经元焦亡,从而损伤中枢神经系统。小胶质细胞的活化在有关学习记忆功能的损伤中起突出作用,亦是脑内神经炎症的标志[14]。在过去的几年里,研究人员认为小胶质细胞与神经退行性疾病有关,小胶质细胞的活化在阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS)等神经退行性疾病中起重要作用[15]。
在NLRP3炎症小体的激活过程中,有CTSB的参与[16]。组织蛋白酶是一类蛋白水解酶,在结构和/或功能上表现出多样性。溶酶体组织蛋白酶家族可分为天冬氨酸组织蛋白酶(D和E)、丝氨酸组织蛋白酶(A和G)和半胱氨酸组织蛋白酶(B、C、F、H、K、L、O、S、V、X和W)3个亚组[17]。本研究表明,一定浓度的NaAsO2可致小胶质细胞内溶酶体的膜稳定性下降,由此可能导致溶酶体中的CTSB释放,进而使胞内的CTSB水平上升。值得注意的是,CTSB可以根据其在不同pH范围内作为内肽酶或外肽酶的活性与组织蛋白酶家族成员区分开来[17]。在细胞内,CTSB调节多种功能,包括细胞因子胞吐、溶酶体内的蛋白质裂解和诱导细胞死亡[18-19]。在实验环境中,溶酶体内或胞浆中的CTSB激活被认为可以促进NLRP3-炎症体的激活和IL-1β的产生[20]。
炎症小体是多蛋白质复合物,由胞内模式识别受体参与组装,其中包括受体分子NLRP3、效应蛋白pro-Caspase-1和含CARD的调亡相关斑点样接头蛋白(ASC,炎症体的主体接头蛋白)。NLRP3的寡聚化可以诱导PYD功能区在NLRP3的活性反应过程中聚合,使同源的PYD功能区与ASC之间相互作用[21]。作为NLRP3炎性小体其中的支架蛋白,ASC还同时具有连接作用,其中的CARD和PYD结构域募 集 下 游pro-Caspase-1的CARD结构域,相互作用产生具有生物活性的Caspase-1,进一步与下游的pro-IL-1β和pro-IL-18作用,促使这部分促炎性因子从不具活性的前体蛋白成熟为具有活性的促炎因子IL-1β、IL-18,并以成熟的形式释放到胞外[22]。
IL-1β又称淋巴细胞刺激因子,由活化的单核巨噬细胞产生。在细胞内,活化的Caspase-1可以切割无活性的pro-IL-1β和pro-IL-18,进而转化为具有活性的促炎因子IL-1β和IL-18[23]。IL-1β对神经系统的影响较为广泛,如促进ROS自由基生成,加剧氧化损伤;促进其他炎症因子分泌,加重炎症反应[24];加速细胞钙离子内流,导致钙超载。IL-18与IL-1β有相似之处,研究发现,IL-18可以中枢合成,其受体亚基在神经元中广泛表达[25]。在过度活跃的小胶质细胞和星形胶质细胞中,IL-18和IL-18R的表达分别上调[26]。有研究发现,大鼠脑缺血再灌注损伤损害后脑组织,引起经脂多糖(LPS)诱导活化的小胶质细胞内活化的IL-1β、IL-18水平均升高[27-28]。本研究表明,NaAsO2诱导小胶质细胞胞内IL-1β和IL-18的水平上升。但其是否被释放到胞外,从而作用于周围其他胶质细胞和神经元而引发中枢神经系统炎症尚存疑问[29]。虽然有部分IL-1β和IL-18在测定前已经释放至胞外,但是由于组间的培养情况相同,砷暴露的时间相同,与对照组比较可消除其释放至胞外所造成的差异。至于是否与NaAsO2存在剂量效应关系,还需要进一步实验验证。
而用化学抑制剂抑制CTSB可降低NLRP3炎症的激活[30]。有研究表明,使用CA074-Me抑制CTSB是适当和合理的,因为它具有高质膜通透性和快速转化为其非甲基化形式CA074的特性,已证明其非甲基化形式CA074可以特异性地干扰CTSB活性[31]。同时,本研究使用CTSB的选择性化学抑制剂CA-074Me干预砷作用的小胶质细胞的结果显示,抑制剂干预的组与对照组相比胞内CTSB水平和NLRP3炎症小体的水平都有所下降,以浓度为10 μmol/L抑制剂干预的组下降较明显。
综上所述,本实验证实了砷可通过破坏溶酶体,促使溶酶体内CTSB释放,致小胶质细胞内的CTSB水平上升,进一步诱导NLRP3炎症小体的组装,胞内活化的Caspase-1含量增加。大量活化的Caspase-1切割pro-IL-1β和pro-IL-18,形成活性较高的IL-1β和IL-18。CTSB选择性抑制剂CA074-Me对小胶质细胞的干预令这一现象有明显改变,进一步揭示了CTSB在砷诱导的BV-2小胶质细胞胞内的炎症因子水平上升中起着重要作用。
4 结 论
NaAsO2通过诱导小胶质细胞内CTSB水平的上升,介导NLRP3炎症小体激活小胶质细胞,促其释放炎性因子,致神经系统损伤。
猜你喜欢
杂志排行
生物化学与生物物理进展的其它文章
- 42℃热疗抑制U251细胞增殖并诱导凋亡*
- The Differing Fortunes and miRNA Clusters Between Human Astrocytes and Neurons After Endoplasmic Reticulum Stress With Downregulation of EIF2B5*
- The Dynamic Changes and Clinical Significance of Serum Neuroglobin Levels in Patients With Acute Ischemic Stroke
- TMEM163变异致髓鞘形成低下患者随访两例及iPSC构建*
- 一个白质消融性白质脑病家系新基因突变及临床表型研究
- 第五版《世界卫生组织中枢神经系统肿瘤分类指南》下成人胶质瘤诊断及预后*
