第五版《世界卫生组织中枢神经系统肿瘤分类指南》下成人胶质瘤诊断及预后*
2022-11-22郑淑荣柴睿超
郑淑荣 庞 波 柴睿超
(北京市神经外科研究所,北京 100070)
胶质瘤是常见的恶性原发性颅内肿瘤,约占颅内所有肿瘤的80%[1]。近年来,分子病理的快速发展使得人们可以更为精准地对胶质瘤进行分类。因此,2021年发布的第五版《世界卫生组织中枢神经系统肿瘤分类指南》(简写为:WHO2021版),在组织学诊断的基础上,纳入了更多的分子指标来指导胶质瘤的分类和分级[2]。对于胶质瘤恶性度级别的诊断,新版指南建议以阿拉伯数字(1~4)取代原来的罗马数字(I~IV)。鉴于WHO2021版指南纳入了更多的分子指标,且分类框架也发生了调整,原本依据2016年发布的《世界卫生组织中枢神经系统肿瘤分类指南》(简写为:WHO2016版)恶性级别诊断为II/III级胶质瘤,其WHO2021版诊断的最终分类和恶性级别均会发生调整[1-2]。但更多分子指标的加入也对临床应用新版指南带来了一定挑战,很多单位目前尚无法依据新版指南对胶质瘤进行诊断及分级,目前仍在依据上一版的指南对胶质瘤进行分类和分级[3]。因而,在临床队列中直接比较最新版指南和上一版指南对胶质瘤诊断和分级的差异,并对这些差异病例的预后等临床特征进行分析显得尤为必要。本研究应用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,系统比较了512例WHO 2016版诊断为II/III级的胶质瘤的WHO2016版诊断和WHO2021版诊断差异,并对两版指南中恶性度级别发生变化的成人型胶质瘤的预后进行了解析,以期为临床实践活动中新版指南的应用提供数据参考和依据。
1 材料与方法
1.1 病例资料收集
回顾性纳入了TCGA数据库中组织学诊断为II/III级,且拥有IDH突变状态和染色体1p/19q联合缺失状态信息的512例胶质瘤。同步收集了这些样本的CDKN2A纯合缺失、TERT启动区突变、EGFR扩增、染色体7p扩增、染色体7q扩增、染色体10p缺失、染色体10q缺失,及对应患者的总生存期等信息。
1.2 WHO2016版诊断
依据2016年发布的《世界卫生组织中枢神经系统肿瘤分类指南》,结合组织学诊断、IDH突变和染色体1p/19q联合缺失状态定义了样本的WHO2016版诊断;包括137例弥漫性星形细胞瘤,IDH突变型,II级;113例间变性星形细胞瘤,IDH突变型,III级;21例弥漫性星形细胞瘤,IDH野生型,II级;73例间变性星形细胞瘤,IDH野生型,III级;94例少突胶质细胞瘤,IDH突变伴1p/19q联合缺失型,II级;74例间变性少突胶质细胞瘤,IDH突变伴1p/19q联合缺失型,III级(图1a)。
1.3 WHO2021版诊断
依据2021年发布的第五版《世界卫生组织中枢神经系统肿瘤分类指南》,通过组织学诊断、结合IDH突变、染色体1p/19q联合缺失、CDKN2A纯合缺失、TERT启动区突变、EGFR扩增、染色体7p扩增、染色体7q扩增、染色体10p缺失及染色体10q缺失状态,对512例样本进行WHO2021版诊断。
1.4 统计分析
采用Graphpad prism8.0软件进行Kaplan-Meier进行生存曲线绘制,并进行了中位总生存期计算和生存差异分析,通过使用Log-rank进行生存差异的分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 WHO2016版诊断为II/III级胶质瘤的WHO2021版诊断
首先,本文详细地比较了512例入组样本的WHO2016版诊断和WHO2021版诊断,它们的CDKN2A纯合缺失、TERT启动区突变、EGFR扩增、染色体7p扩增、染色体7q扩增、染色体10p缺失及染色体10q缺失状态(图1a)。结果显示,512例样本中362例样本的级别诊断没有发生变化,125例样本的级别在WHO2021版中被诊断为4级,这些样本至少携带了CDKN2A纯合缺失、TERT启动区突变、EGFR扩增、染色体7号获得联合10号缺失中的一项,25例样本由于缺乏足够的分子指标在WHO2021版的指南中难以给出级别诊断。
随后进一步详细解析了这些样本的WHO2016版诊断和WHO2021版诊断的对应关系(图1b)。结果显示,所有少突胶质瘤细胞瘤的诊断分级均未发生变化。在IDH突变的星形细胞瘤中,113例和81例WHO2016版诊断分别为“弥漫性星形细胞瘤,IDH突变型,II级”和“弥漫性星形细胞瘤,IDH突变型,III级”的样本,WHO2021版诊断针分别为“星形细胞瘤、IDH突变型,2级”和“星形细胞瘤、IDH突变型,3级”;21例WHO2016版诊断为“弥漫性星形细胞瘤,IDH突变型,II级”的样本,WHO2021版诊断为“星形细胞瘤、IDH突变型,4级”;32例WHO2016版诊断为“弥漫性星形细胞瘤,IDH突变型,III级”的样本,WHO2021版诊断为“星形细胞瘤、IDH突变型,4级”;3例WHO2016版诊断分别为“弥漫性星形细胞瘤,IDH突变型,II级”和样本由于缺乏CDKN2A拷贝数变异的信息,其WHO2021版诊断为“星形细胞瘤、IDH突变型,NOS”,不能明确其潜在级别。
所有WHO2016版诊断为II/III级的IDH野生型的样本,WHO2021版诊断均发生了大的变化,其中10例WHO2016版诊断为“弥漫性星形细胞瘤,IDH野生,II级”的样本,WHO2021版诊断为“胶质母细胞瘤、IDH野生型,4级”;62例WHO2016版诊断为“弥漫性星形细胞瘤,IDH野生,III级”的样本,WHO2021版诊断为“胶质母细胞瘤、IDH野生型,4级”;22例样本由于缺乏足够的分子信息不能给出明确的WHO2021版诊断。
2.2 WHO2021版诊断对WHO2016版诊断为II/III级胶质瘤的预后影响
鉴于WHO2016诊断为II/III级的IDH突变型和野生型中都存在部分胶质瘤在WHO2021版诊断中会升级为4级。本文系统分析了WHO2021版诊断对WHO2016版诊断为II/III级胶质瘤的预后影响。
在WHO2016版诊断为II/III级的247例IDH突变型中,分别有113例、81例、53例样本被诊断为星形细胞瘤,IDH突变型的2、3、4级,且它们的预后间存在显著的差异(图2a)。其中,4级肿瘤的生存显著比2级(P﹤0.000 1)和3级(P=0.011 4)差,而3级肿瘤的生存呈现出比2级的胶质瘤更差的趋势(P=0.066 5)。在WHO2016版诊断中为II级的肿瘤中,WHO2021版诊断为4级的21例样本的生存显著差于诊断为2级的113例肿瘤(P=0.001 12,图2b)。WHO2016版诊断中为III级的肿瘤中,WHO2021版诊断为4级的32例样本的生存显著差于诊断为3级的81例肿瘤(P=0.004 4,图2c)。
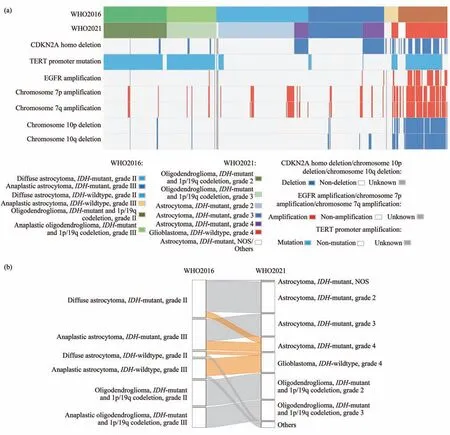
Fig.1 The diagnosis and molecular features of cases used in this study
在WHO2016版 诊 断 为II/III级的94例IDH野生型胶质瘤中,发现72例在WHO2021版诊断中会升级胶质母细胞瘤,IDH野生型,4级的肿瘤预后显著差于其余22例未能完成明确诊断的肿瘤(P=0.007 4,图3a)。在WHO2016版诊断中为II级的肿瘤中,WHO2021版诊断为4级胶质母细胞瘤的10例样本的生存较诊断未明确的11例肿瘤生存呈现出更差的趋势,但是差异不显著(P=0.347 2,图3b)。WHO2016版诊断中为III级的肿瘤中,WHO2021版诊断为4级的62例样本的生存显著差于诊断未明确的11例肿瘤(P=0.015 3,图3c)。
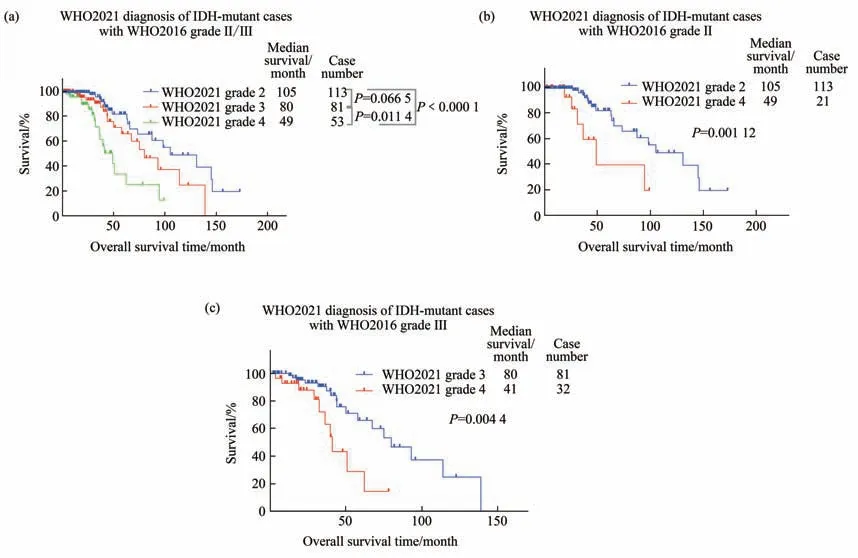
Fig.2 The impact of WHO2021 on the prognosis of IDH-mutant gliomas
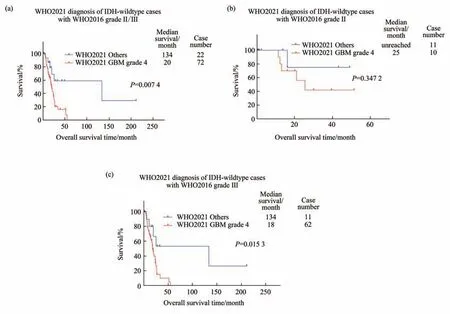
Fig.3 The impact of WHO2021 in the prognosis of IDH-wildtype gliomas
3 讨 论
目前,弥漫性胶质瘤即使经过手术、放疗或化疗、肿瘤电场治疗等综合治疗,预后仍不佳。超过60%的弥漫性胶质瘤为胶质母细胞瘤,这种恶性程度最高的中枢神经系统肿瘤的平均总生存期约为14~16个月[2,4-6]。在过去的15年里,胶质瘤预后的改善非常有限,这在很大程度上归因于胶质瘤独特的解剖位置、生物学特征、发育、遗传、表观遗传学和微环境特征使它们对传统和新治疗产生耐药性[6-8]。改善胶质瘤的治疗效果很大程度上依赖于对胶质瘤进行精准诊断和分型,然而,传统仅根据组织学特征对弥漫性胶质瘤进行的分类,也无法为临床医生提供足够的信息来针对性对患者制定个性化的管理方案[1,9-10]。近年来,分子病理的快速发展给弥漫性胶质瘤的精准诊断带来了希望。本研究明确了从2016版的《世界卫生组织中枢神经系统肿瘤分类指南》到2021版的《世界卫生组织中枢神经系统肿瘤分类指南》,随着越来越多分子指标的纳入胶质瘤诊断的变化情况。
依据2021年的新版指南和专家共识,IDH野生型星形细胞瘤如果伴有EGFR扩增、染色体7号获得/10号缺失或者TERT启动子突变(胶质母细胞瘤的典型分子特征),即使缺乏坏死和/或微血管增生,也诊断为“胶质母细胞瘤,IDH野生型,WHO 4级”;而IDH突变型胶质瘤,在缺乏坏死和/或微血管增生的情况下,如果携带CDKN2A/B纯合性缺失,也需被诊断为“星形细胞瘤,IDH突变型,WHO 4级”[2,11-12]。为了更好地明确最新版WHO指南对胶质瘤诊断、预后分层地影响,本研究系统地对512例2016版诊断为II/III级胶质瘤进行了2021版诊断,并通过一一对应分析,对这些病例的诊断变化情况进行了详细阐述,结果表明部分2016版诊断为II/III级的胶质瘤在2021版诊断中会升级为4级,提示这部分胶质瘤后续的治疗和临床管理均应按照4级胶质瘤来开展,凸显了新版指南的临床价值和意义。
肿瘤的诊断分级应该对其预后评估起到指导作用,考虑到4级胶质瘤的预后会更差[7,13],本研究还重点关注了在2021版诊断中级别升高的胶质瘤的预后情况。结果表明,在2021版诊断级别升级为4级的胶质瘤患者的预后确实显著变差,该结果表明2021版诊断可较2016版诊断进一步对患者的预后进行分层。与此同时,在WHO2016版诊断为II级的IDH野生型星形细胞瘤中,WHO2021版诊断级别是否升高未能起到对预后显著分层的效果。导致该结果潜在因素包括多个方面:首先,这组样本的数量相对较少可能导致了统计学差异不显著;其次,当前组织学级别对肿瘤的预后影响尚不能完全排除,近期的其他研究成果也提示,在IDH野生型胶质瘤中,仅依据分子指标诊断为4级但缺乏组织学4级特征的肿瘤预后要好于组织学诊断为4级的肿瘤[14];最后,近期也有研究对TERT启动子区突变以外其他指标单独作为诊断4级依据的可靠性提出了质疑[6]。这也提示仍需继续通过更多地队列分析及相关研究来明确该问题。
4 结 论
综上所述,本队列研究成果提示,WHO2021版诊断具有进一步分层WHO2016版诊断为II/III级胶质瘤的能力,在有条件的情况下应该尽快完成WHO2021版诊断来对胶质瘤进行精准分层,但对于WHO2016版诊断为II的IDH野生型胶质瘤在WHO2021版诊断升级为4级的胶质瘤仍需进一步关注其确切生存。
