甘草酸配伍TG治疗CIA降低血液系统毒性的研究
2022-11-22孙杨婷周子阳刘亿鼎严曼琦张洋清陈欣雨孟丹
孙杨婷,周子阳,刘亿鼎,严曼琦,张洋清,陈欣雨,孟丹
(嘉兴学院 医学院,浙江嘉兴 314001)
雷公藤多苷(tripterygium glycosides,TG)是由植物雷公藤去皮根部提取的总苷,有“中草药激素”之誉.[1]作为雷公藤的重要有效成分之一,TG具有抗炎、抗肿瘤、免疫调节等作用,临床上常用于治疗风湿免疫性疾病且疗效显著.但因其对肝、肾和血液系统等具有毒副作用,临床应用受到一定限制.研究表明,TG对血液系统有显著毒性,且存在明显的量-毒和时-毒关系,不仅具有抑制骨髓造血功能,导致有核细胞生成严重减少,粒、红二系细胞增生受阻,非造血细胞明显增加等毒副作用,而且可能导致再生障碍性贫血的发生,并且有效治疗量与最小中毒量较接近,治疗安全范围较窄,因此,临床用药时常与甘草、地黄和三七等中药配伍使用,以期起到减毒增效作用.[2-4]
甘草性平、味甘,在中药中有“国老”之称.甘草酸(glycyrrhizic acid,GA)是甘草的主要成分,GA可阻止Fas抗体介导的细胞凋亡,促进骨髓造血功能恢复,临床常用于治疗再生障碍性贫血.[5]但是对于GA能否改善TG所致的血液系统毒性,目前尚无相关研究.因此,本研究拟建立胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠模型,使用临床治疗类风湿关节炎(rheumatoid arthritis,RA)的常用药物雷公藤多苷片(tripterygium polyglycosides tablets,TPT),采用临床等效剂量口服给药的方式,并设立配伍(TG+GA)组,研究GA是否能够降低TG所致的Wistar大鼠的血液系统毒性,且提高RA治疗效果,为临床减少TG治疗所致的血液系统毒副作用提供实验依据和用药参考.
1 材料和方法
1.1 材料
1.1.1 实验动物
选用SPF级雌性3周龄Wistar大鼠40只,体质量为100±10 g,购于浙江维通利华实验动物技术有限公司桐乡分公司,合格证号SCXK(浙)2021-0006,动物饲养于嘉兴学院医学院动物实验中心,适应性喂养1周后进行实验.
1.1.2 药物与试剂
药物:雷公藤多苷片(浙江得恩德制药股份有限公司,国药准字Z33020422,10 mg)、甘草酸(上海联硕生物科技有限公司,CAS号为1405-86-3,规格5 g).试剂:牛Ⅱ型胶原、0.1%冰醋酸、完全弗氏佐剂(complete Freund's adjuvant,CFA)、4%多聚甲醛、10%乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)、10%水合氯醛、OCT(Optimal Cutting Temperature Compound)包埋剂、苏木素-伊红染色剂、Giemsa染色液(上海碧云天生物技术有限公司,批号为C0131-100,100 mL)、Masson染色液(沈阳万类生物科技有限公司,货号为WLA045a,4×10 mL)、白细胞稀释液、红细胞稀释液(安徽弘慈医疗科技有限公司,100 mL)、0.9%生理盐水.
1.1.3 仪器
Cell Counter model R1细胞自动计数仪(日本olympus公司)、CM1950冷冻切片机(德国Leica公司)、Caliper Life Science活体成像仪、正置荧光显微镜(日本olympus公司,型号为BX53).
1.2 实验方法
1.2.1 CIA模型制备和动物分组
将牛Ⅱ型胶原置于0.1%冰醋酸中充分搅拌溶解,浓度为2 g/L,4 ℃避光保存.再将等体积完全弗氏佐剂与胶原溶液混合,冰上充分乳化,制成牛Ⅱ型胶原乳剂.在大鼠左足、尾根部处注射0.3 mL胶原乳剂,初次免疫7天后,于左足处再次注射胶原乳剂0.1 ml加强免疫诱发炎症反应,建立CIA大鼠模型并进行关节炎指数评分,[6]累积评分大于4即为造模成功,本次实验成模率75%,符合预期.将CIA大鼠随机分为CIA模型组、TG组、配伍(TG+GA)组,同时设立对照组,每组各8只.
1.2.2 药物处理
TG组给予雷公藤多苷40 mg/(kg·d)、配伍组[7]给予雷公藤多苷40 mg/(kg·d)配伍甘草酸60 mg/(kg·d),每日1次,连续6周;对照组与CIA模型组均给予等量生理盐水.
1.3 取材与指标检测
1.3.1 血液指标检测
给药后,于第42 d腹腔注射10%水合氯醛麻醉大鼠后进行解剖,腹主动脉取血、EDTA-K2抗凝,血液样本经红细胞稀释液、白细胞稀释液处理后置于Cell Counter model R1细胞自动计数仪,检测血液中红细胞、白细胞参数值.
1.3.2 骨髓造血干细胞检测
采血完成后,腹主动脉放血处死大鼠,钝性分离出股骨,用生理盐水冲洗干净,断开股骨干骺端后,以尖头镊子小心夹取骨髓放入预装有2 ml胎牛血清的试管中,移液枪反复抽吸充分混匀,取上清液制成多份骨髓涂片,放于Giemsa染色显微镜下对比观察各组大鼠成熟红细胞及骨髓细胞形态和数量增减变化情况.
1.3.3 脾脏组织病理学观察
处死大鼠后,取出脾脏,经过多聚甲醛固定、梯度蔗糖脱水、OCT包埋、液氮冷冻,制作8 μm冷冻切片;经常规HE染色(冷冻切片吹干→冷丙酮15 min→蒸馏水5 min→苏木素2 min→水10 min→1%盐酸酒精→水10 min→80%酒精→伊红15 s→5%酒精10 s→95%酒精10 s→无水乙醇Ⅰ1 min→无水乙醇Ⅱ1 min→二甲苯Ⅰ2 min→二甲苯Ⅱ2 min),中性树胶封片后在显微镜下观察脾脏组织红、白髓及病理变化情况.
1.3.4 踝关节病理观察
10%水合氯醛麻醉大鼠后,置于Caliper Life Science活体成像仪拍摄大鼠左后足X线片,处死大鼠后分离取出大鼠后肢,保留完整踝关节,4%多聚甲醛固定,10%乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)脱钙直至关节软化后,OCT包埋制作冷冻切片.踝关节组织切片分别进行HE染色与Masson染色(冰冻切片吹干→蒸馏水洗2 min,3次→核染液2 min→蒸馏水3 min→1%盐酸酒精分化1 s→自来水返蓝5 min→浆染液1 min→蒸馏水洗2 min,3次→分色液3 min→复染液5 min→蒸馏水5 min),中性树胶封片后在显微镜下观察关节软骨细胞增生变化情况.
1.4 统计学处理
用 SPSS20.0统计软件进行单因素方差分析检验,评判GA配伍对TG所致的血液系统毒性的影响是否显著,所得数据均以均数±标准差(Mean±SD)表示,P≤0.05表示差异具有统计学意义.
2 结果
2.1 大鼠外周全血红、白细胞计数变化的情况比较
大鼠经灌胃给药6周后,收集腹主动脉血进行血细胞计数,模型组红细胞计数为5.76±0.28(×1012/L),TG组红细胞计数为4.86±0.38(×1012/L),与模型组比较,TG组红细胞计数显著下降(P<0.05),表明TG对大鼠血液系统有显著损害;配伍组红细胞计数为7.61±0.94(×1012/L),白细胞计数为9.14±1.51(×109/L),TG组红细胞计数为4.86±0.38(×1012/L),白细胞计数为4.65±2.48(×109/L),配伍组与TG组相比,红细胞计数及白细胞计数均显著增加(P<0.05),提示GA配伍对TG所致的血液系统毒性起到了一定的减毒保护作用,见表1.

表1 各组大鼠红、白细胞计数
镜下观察血涂片发现,TG组视野中红细胞数量显著减少,并可见红细胞破裂变形,见图1.
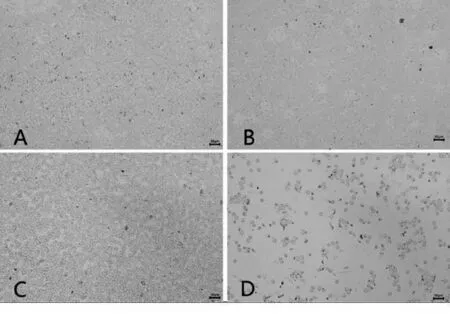
A.对照组;B.模型组;C.配伍组;D.雷公藤组图1 各组大鼠血涂片(Giemsa染色 ×400)
2.2 大鼠股骨内骨髓细胞检测情况
Giemsa染色后高倍镜下观察骨髓涂片,经各实验组组内及组间比较发现,对照组骨髓细胞均匀分布,可见红系、粒系细胞数目及形态正常;CIA模型组骨髓涂片可见明显成熟红细胞;而TG组观察到粒细胞受损变性,成熟红细胞数量减少,并出现部分非造血细胞;配伍组较TG组有核细胞增多,可见成熟红细胞,见图2.
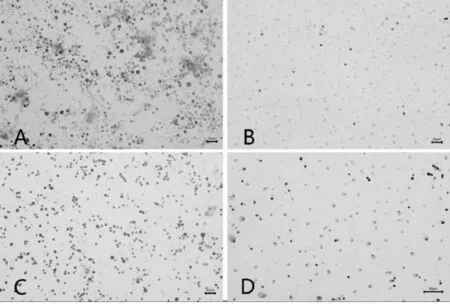
A.对照组;B.模型组;C.配伍组;D.雷公藤组图2 各组大鼠骨髓涂片(Giemsa染色×100)
2.3 脾脏组织病理学观察
HE染色后高倍镜下观察,对照组大鼠脾脏结构清晰,红、白髓分界较明显,未见充血,动脉周围淋巴鞘细胞未见增生,脾小体结构清晰;CIA模型组大鼠红髓增生充血,脾小体结构模糊,动脉周围淋巴鞘细胞密度较对照组明显增大,淋巴小结和淋巴母细胞中心均多于对照组;TG组与配伍组脾脏组织红髓充血情况均稍有改善,脾脏结构较清晰,但两组间无显著差异,见图3.

A.对照组;B.模型组;C.配伍组;D.雷公藤组图3 各组大鼠脾脏病理切片 (HE染色 ×100)
2.4 踝关节治疗情况
灌胃给药治疗6周后,对各实验组大鼠左后足进行X线成像.X线片显示,对照组大鼠踝关节内关节软骨完整,关节面平整未见缺损;CIA模型组大鼠关节周围软组织肿胀,关节面粗糙缺损;TG组及配伍组大鼠踝关节周围未见明显软组织肿胀及关节面缺损,关节面较平整,见图4.

A.对照组;B.模型组;C.配伍组;D.雷公藤组图 4 各组大鼠左后足跖X线片
2.5 踝关节软骨病理情况的变化
踝关节脱钙固定包埋后制成冷冻切片,进行HE及Masson染色观察.HE染色结果显示,对照组大鼠踝关节软骨表面光滑,组织结构正常,软骨层厚,软骨细胞排列整齐且数目较多,滑膜细胞无增生;CIA模型组大鼠踝关节软骨表面粗糙,软骨层薄且细胞数量少,可见明显炎细胞浸润,滑膜细胞存在异常增生;TG组与配伍组大鼠踝关节软骨组织较厚,软骨细胞数量增多,炎细胞浸润情况有所改善.比较两组结果,配伍组软骨层厚度更为明显,炎细胞浸润相对较少,抗炎效果优于TG组,见图5.

A.对照组;B.模型组;C.配伍组;D.雷公藤组图5 各组大鼠踝关节病理切片(HE染色 ×200)
Masson染色结果显示,对照组大鼠关节软骨呈均匀蓝色着色,向骨关节方向着色有所加深,软骨与软骨下骨分界清晰;CIA模型组大鼠关节软骨表面粗糙,出现部分染色缺失,软骨与软骨下骨分界不清;TG组和配伍组大鼠踝关节软骨染色较均匀,软骨表面无明显缺失,软骨与软骨下骨分界较明显,配伍组软骨结构完整度及软骨细胞分布情况趋于正常,对软骨损伤的保护效果优于TG 组,见图6.
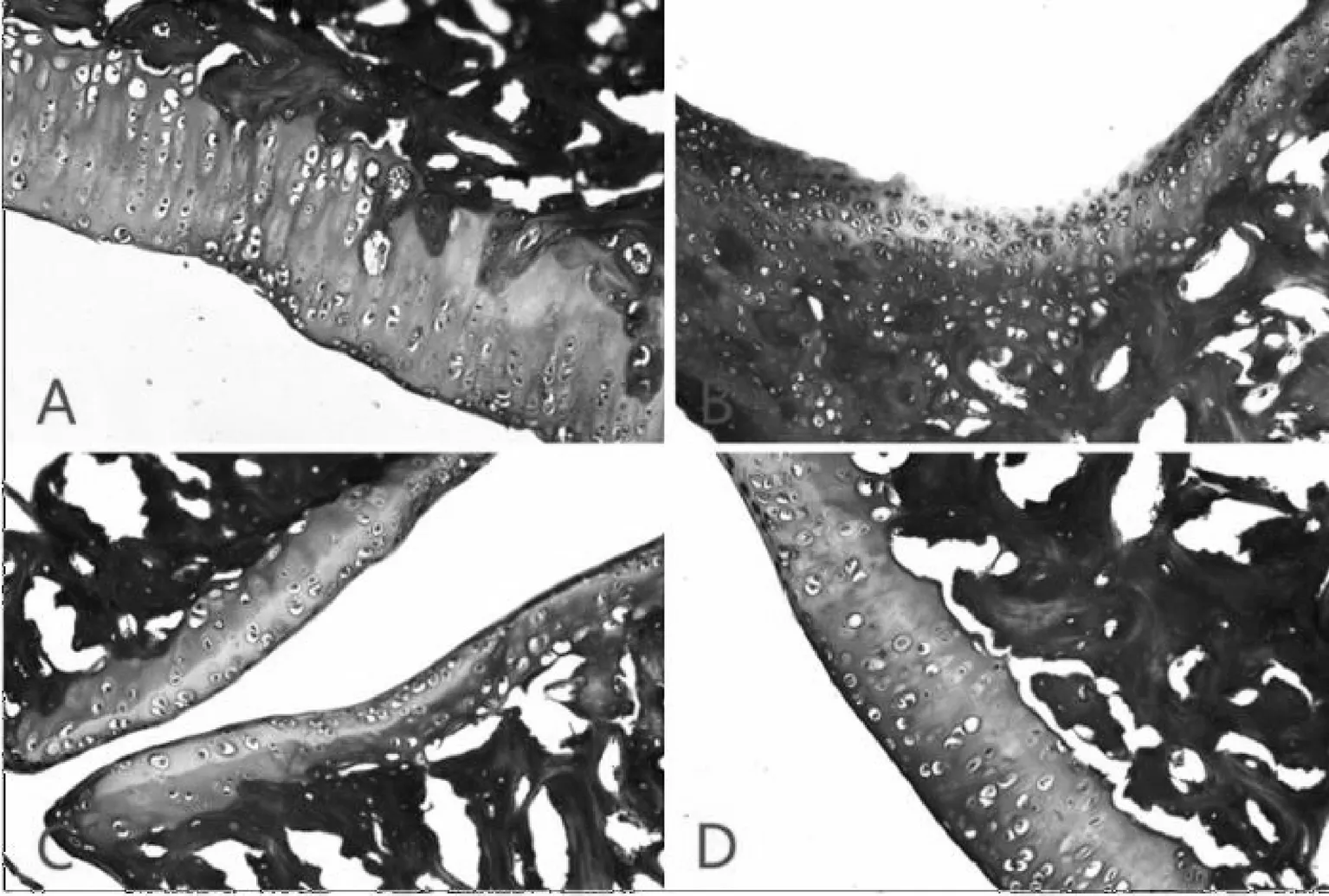
A.对照组;B.模型组;C.配伍组;D.雷公藤组图6 各组大鼠踝关节病理切片(Masson 染色 ×200)
3 讨论
实验结果显示,对于雷公藤多苷治疗类风湿关节炎所致的血液系统毒性,甘草酸在产生明显的减毒效果的同时,起到了补脾益气、行血生津的功效,避免CIA大鼠在疾病后期由于脾肾两虚导致的贫血情况.显著改善了大鼠的骨髓抑制情况,增加粒系、红系细胞数量,提高了血液中红、白细胞计数,且均具有统计学意义,这一现象可能与甘草酸抑制了免疫细胞过度激活、减轻对骨髓造血祖细胞的损伤有关,[7]或由于甘草酸通过促进骨髓间充质细胞增殖,诱导其向多潜能细胞转化,[9]改善了药物所致的骨髓抑制,但GA减轻TG所致血液系统毒性的具体机制仍有待进一步实验验证.
同时,本实验还发现甘草酸配伍雷公藤多苷能够提高关节炎治疗效果,减轻关节软骨炎细胞浸润、关节面破坏及关节周围软组织肿胀程度.甘草素有缓急止痛、调和解毒的功效,现代药理学研究已证明其具有抗炎调节免疫、抗菌抗氧化等多方面作用,[8]中医认为风寒湿是关节炎发生的重要原因,而甘草有益气解毒、缓急止痛之功效,能够祛除湿邪,通过调节机体的清浊代谢从而提高关节炎的治疗效果.根据现代药理学分析,这一现象可能与甘草酸通过抑制PI3K/AKT/NF-κB通路、减轻胶原诱导性关节炎发展有关,[10]或与甘草酸抑制炎症关节组织PGE2生成有关.[11]但对于CIA大鼠脾脏的炎性变化,如红髓充血肿胀等情况,甘草酸配伍治疗较之雷公藤多苷单独治疗并无明显增益现象,可能与雷公藤类药物本身就具有导致脾脏充血增大、淋巴细胞坏死这一副作用有关.[12]
根据目前采用本疗法的临床数据显示,作为类风湿关节炎的常用中医治疗处方,甘草配伍雷公藤复方煎剂有着祛湿活血之功效,可降低患者关节肿胀指数、提高双手平均握力,明显改善临床症状,治疗总有效率较单用雷公藤提高10.2%.[13]而本疗法在用于治疗类风湿关节炎合并贫血的患者时,不仅可减轻关节肿胀、弊阻不通等类风湿关节炎症状,还可发挥益气补血、补益肝肾等作用,显著改善并发于关节炎的贫血症状.[8]除此之外,甘草酸在治疗过程中产生的不良反应也极少,在疗效显著的同时用药副作用小,综合本实验结果与已有临床治疗手段及相关文献,可以推论甘草酸作为雷公藤多苷的配伍药物,在用于临床治疗关节炎及防治相关不良反应方面有较大发展空间.
