EZH2抑制剂(GSK-126)对小鼠肝纤维化的保护作用
2022-11-22刘志丹王金丽金胜洁王俏铃韩娇娇金倩仪阮群超郑永霞
刘志丹,王金丽,金胜洁,王俏铃,韩娇娇,金倩仪,阮群超,郑永霞
(嘉兴学院 医学院,浙江嘉兴314001)
肝纤维化是所有慢性肝脏疾病形成的共同病理反应过程,它是肝脏损伤与修复反应失衡的结果,可导致肝硬化.它的特征是肝组织内细胞外基质成分过度增生与沉积.临床认为:在适当手段干预下,肝纤维化是可以逆转的,但患者一旦发展到肝硬化阶段,则很难治愈.肝纤维化的中心环节是肝星状细胞的活化,[1]肝星状细胞活化后获得了成纤维细胞的表型,使其由储存维生素A的储脂细胞转化为肌成纤维细胞,它具有强大的增殖、收缩和纤维化发生的能力.
果蝇Zeste基因增强子人类同源物2(EZH2)是一种组蛋白甲基转移酶,使组蛋白H3的第27位赖氨酸发生三甲基化修饰 (H3K27me3),[2]H3K27me3是一类重要的转录抑制性标记.近年来研究发现:EZH2具有调节肌成纤维细胞的转化并参与多个组织的纤维化,包括肾纤维化、肺纤维化等,[3]目前EZH2与肝纤维化的关系也逐渐得到证实.研究显示,EZH2可通过提高Wnt通路的活性促进肝星状细胞的活化和肝纤维化.[4-5]EZH2抑制剂(下文简称GSK-126)作为S-腺苷甲硫氨酸(SAM)的竞争性抑制剂,对EZH2的选择性比其他20种人甲基转移酶高1000多倍,[6]且GSK-126在2014年已进入I期临床试验,用于治疗晚期实体瘤或者B细胞淋巴瘤.[7-9]尽管已有研究显示:GSK-126可调节肝细胞的可塑性和改善肝衰竭小鼠的疾病严重程度,然而在肝纤维化方面的研究尚未见诸报道.
为了探讨GSK-126在肝纤维化保护中的作用,本文利用不同剂量(5mg/kg和15mg/kg)的GSK-126(EZH2的抑制剂)处理CCl4诱导的小鼠肝纤维化模型,并从病理染色、肝功能等方面来观察GSK-126对肝纤维化保护的作用.
1 材料与方法
1.1 材料
SPF级Balb/c小鼠(24只),由嘉兴学院动物实验中心培育,体重21±3.5 g,雌雄各半;GSK-126(上海陶素生化科技有限公司)、CCl4(上海联试化工试剂有限公司)、花生油(益海粮油工业有限公司)、苏木精及伊红(南昌雨露实验器材有限公司)、天狼猩红染液(北京雷根生物技术有限公司)、酶标仪(上海沛欧分析仪器有限公司)、小鼠ALT酶联免疫分析试剂盒(上海远慕生物科技有限公司)、Masson染色试剂盒(北京索莱宝生物有限公司)、天狼猩红染色试剂盒(北京索莱宝生物有限公司).
1.2 CCl4诱导小鼠肝纤维化
将小鼠分为4组,每组6只,实验周期为20天.
1)正常对照组:按5mL/kg的剂量皮下注射食用油,每3天1次,共注射6次;
2)肝纤维化组:按5 mL/kg的剂量皮下注射体积分数为20% 的CCl4油剂溶液(CCl4∶橄榄油=1∶4),每3天1次,共注射6次;
3)CCl4+ GSK-126 5mg/kg组:按5 mL/kg的剂量皮下注射体积分数为20% CCl4的油剂溶液(CCl4∶橄榄油=1∶4)的同时,按5mg/kg的剂量皮下注射GSK-126,每3天1次,共注射6次;
4)CCl4+GSK-126 15 mg/kg组:按5mL/kg的剂量皮下注射体积分数为20% CCl4的油剂溶液(CCl4∶橄榄油=1∶4)的同时,按15 mg/kg的剂量皮下注射GSK-126,每3天1次,共注射6次.
20天培养周期结束后,腹腔注射5%水合氯醛溶液麻醉,心脏取血,解剖取出小鼠的肝脏,称重并记录.同时观察小鼠肝脏的大体形态,将取出的肝脏组织放置在甲醛溶液中固定,用于制作石蜡包埋块,血清则于冰箱内保存备血清指标检测.
1.3 血清谷丙转氨酶(ALT)的测定
用1.5 mL 5%的水合氯醛对小鼠进行腹腔注射,小鼠麻醉后,打开胸腔,暴露心脏,用针头刺入右心室,吸取0.5~0.6 mL血液,置于含有肝素的试管中,静置30 min,离心,取上清.谷丙转氨酶的测定按照小鼠丙氨酸氨基转移酶(ALT)ELISA试剂盒说明书进行操作:在包被板上进行标准品孔、空白孔以及待测样品孔的设置与加样;然后用封板膜封板后置37 ℃温育30 min;洗涤,加酶,置37 ℃温育30 min,洗涤;加显色剂后避光显色15 min后,终止反应.以空白孔调零,450 nm波长依序测量各孔的吸光度(测定应在加终止液后15 min以内进行).计算:以标准物的浓度为横坐标、吸光值为纵坐标,做标准曲线,计算其直线回归方程式,然后根据样品值用标准曲线方程算出浓度,再乘以稀释倍数,即为样品的实际浓度.
1.4 组织病理分析
对肝脏组织切片进行HE染色、Masson染色、天狼猩红染色并在光镜下观察.
1.4.1 HE染色
取新鲜肝脏组织块(厚度0.5 cm)投入10%福尔马林中固定12 h后,依次将其放入 60%乙醇(1 h)→70%乙醇(1h)→80%乙醇(1 h) →90%乙醇(45 min)→95%乙醇(30 min)→95%乙醇(15 min)→100%乙醇(15 min)→100%乙醇(15 min)→二甲苯溶液(15 min)→二甲苯溶液(15 min)→60 ℃石蜡I (1.5 h) →60 ℃石蜡II(2 h);然后将已透明的组织块置于已溶化的石蜡中,待石蜡完全浸入组织块后进行包埋,并切成4μm厚的切片;再将切片依次放入二甲苯(I)25 min→二甲苯(Ⅱ)25 min→100%酒精 2 min→95%的酒精 2 min→80%酒精 2 min→75%酒精2 min→蒸馏水洗2 min,脱去切片中的石蜡;再放入苏木素染色5 min,自来水冲洗;盐酸酒精分色10 s;流水缓慢冲洗15 min后分别放入70%和90%酒精中各脱水10 min;伊红溶液染色2~3 min;用常规梯度酒精进行脱水后再用二甲苯透明,最后用中性树脂封片即可.
1.4.2 Masson染色
先将肝组织切片(4 μm)、脱腊;用Weigert铁苏木素染色8 min,酸性乙醇分化,蒸馏水洗;再用Masson丽春红酸性复红液染色5~10 min;以2%冰醋酸水溶液浸洗片刻,1%磷钼酸溶液分化3~5 min;不经水洗,直接用苯胺蓝或光绿液染5 min.以0.2% 冰醋酸水溶液浸洗片刻;再用95%酒精、无水酒精、二甲苯透明、中性树胶封固.
1.4.3 天狼猩红染色
用10%的福尔马林固定肝脏组织,常规脱水包埋,切成6μm厚的切片;用二甲苯脱蜡,梯度酒精脱水,蒸馏水浸泡;weigert铁苏木素染色液染色10~20 min;用自来水洗5~10 min,蒸馏水洗1次;天狼猩红染色液滴染1 h,流水冲洗,去除切片表面的天狼猩红染色液,再常规脱水至透明,最后用中性树胶封固.
1.5 统计学处理

2 结果
2.1 肝脏形态图
为了观察GSK-126对小鼠肝纤维化的影响,我们基于CCl4诱导的小鼠肝纤维化模型,[10]观察不同剂量的GSK-126对肝脏形态的影响.结果显示:正常对照组(图1A)小鼠肝脏体积正常,表面光滑质软,肝组织红润、呈红褐色,边缘锐利;肝纤维化模型组(图1B)小鼠肝脏体积明显增大,表面粗糙,失去光泽,有较多灰白色小结,质地变硬,边缘钝圆,表明其肝纤维化模型成功.GSK-126 5 mg/kg组(图1C)和15 mg/kg组(图1D)相比,小鼠肝脏体积有不同程度的缩小,色泽得到一定恢复、质地变软、边缘变薄,但仍存在病变现象,且GSK-126 15mg/kg组小鼠肝脏状态较好.该结果提示,GSK-126可能具有减轻肝纤维化的作用.

A.对照组
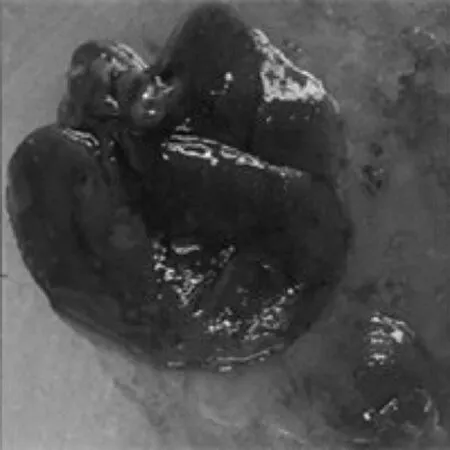
B.CCl4处理组

C.GSK-126 5mg/kg组

D.GSK-126 15mg/kg组
2.2 肝重指数
模型组与对照组相比较,采用t检验,差异有统计学意义(t=3.304,p=0.0298),模型组的肝重指数(5.94±0.449)明显高于对照组(4.59±0.547),说明CCl4诱导小鼠发生了肝纤维化.利用方差分析的方法对GSK-126 5 mg/kg组、GSK-126 15 mg/kg组以及模型组的肝重指数进行分析,结果显示:GSK-126 5 mg/kg组、GSK-126 15 mg/kg组的肝重指数与模型组的肝重指数存在显著差异(F=8.443,p=0.0073),GSK-126低、高剂量组的肝重指数均低于模型组(p<0.05),由此说明,GSK-126对肝纤维化的发生具有一定的抑制作用.

表1 肝重指数 (x±s)
2.3 谷丙转氨酶(ALT)测定结果
由表2可知,模型组小鼠的ALT活性显著升高,可见肝纤维化小鼠模型造模成功;利用方差分析的方法对GSK-126 5 mg/kg组、GSK-126 15 mg/kg组以及模型组的ALT活性进行分析,结果显示:GSK-126 5 mg/kg组、GSK-126 15 mg/kg组的ALT活性与模型组存在显著差异(F=8.443,p=0.0073).GSK-126 5 mg/kg组、GSK-126 15 mg/kg组的肝重指数均低于模型组(p<0.05),由此说明,GSK-126对肝纤维化的发生具有一定的抑制作用.

表2 血清谷丙转氨酶的活性(x±s)
2.4 HE染色图
HE染色能较直观地发现小鼠肝脏细胞的损伤情况,进而判断GSK-126在肝纤维化进程中是否能够改善肝细胞损伤.[11-12]由HE染色图谱(图2)可见,对照组(图2A)小鼠肝细胞形态正常,排列整齐,较少出现肝细胞结构异常,无病变或坏死.模型组(图2B)小鼠肝脏局部灶性坏死,细胞核溶解,伴有脂肪变性及炎症细胞浸润现象.GSK-126 5 mg/kg组(图2C)小鼠肝细胞排列较为整齐,肝细胞结构异常少见,轻度肝细胞水肿,肝细胞病变或坏死症状少见.GSK-126 15 mg/kg组(图2D)小鼠肝细胞形态、排列接近对照组小鼠,无明显病变现象,仅存在轻度的水肿现象,说明GSK-126对肝纤维化有一定的保护作用.
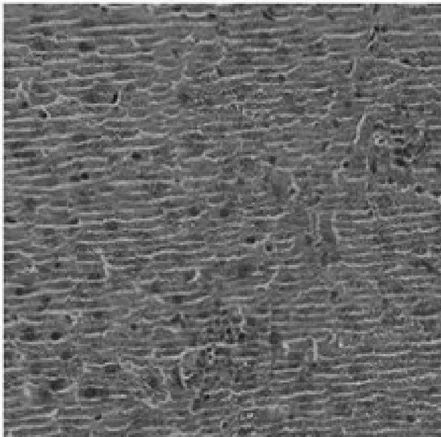
A.对照组

B.CCl4处理组

C.GSK-126 5mg/kg组

D.GSK-126 15mg/kg组
2.5 Masson染色图
Masson染色可直接显示汇管区周边纤维增生情况,经Masson染色后所得的图片显示,对照组(图3A)小鼠的肝脏组织基本无纤维化现象;而模型组(图3B)小鼠的肝纤维化程度严重,血管与血管之间存在明显的交联;GSK-126 5 mg/kg组(图3C)小鼠的肝纤维化程度相对于模型组来说明显降低;GSK-126 15 mg/kg组(图3D)小鼠的纤维化程度较GSK-126 5 mg/kg组改善更加明显,说明GSK-126对改善小鼠肝纤维化确实有作用.

A.对照组

B.CCl4处理组
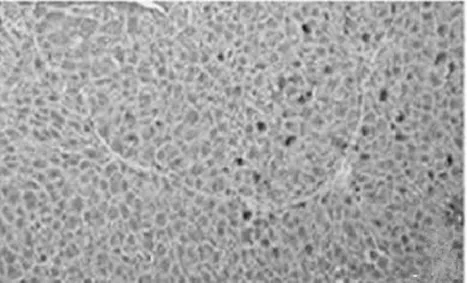
C.GSK-126 5mg/kg组

D.GSK-126 15mg/kg组
2.6 天狼猩红染色图
天狼猩红染色是将小鼠的肝脏组织中的胶原纤维染成红色,细胞核染成蓝色,由此判断小鼠的肝纤维化程度.[13]在各组小鼠的天狼猩红染色结果中我们发现,对照组(图4A)小鼠的肝脏中几乎无胶原纤维分布,仅静脉区域有少量的胶原纤维分布.模型组(图4B)小鼠的肝脏在静脉与静脉之间形成明显的胶原纤维,并且将肝脏平面分割开来,同时伴有严重的坏死症状.GSK-126 5 mg/kg组(图4C)、GSK-126 15 mg/kg(图4D)组能明显看见胶原纤维增生现象,但相对模型组来说,症状明显减轻,并且GSK-126 15 mg/kg组症状最轻,因此,GSK-126对肝纤维化具有较好的保护作用.

A.对照组
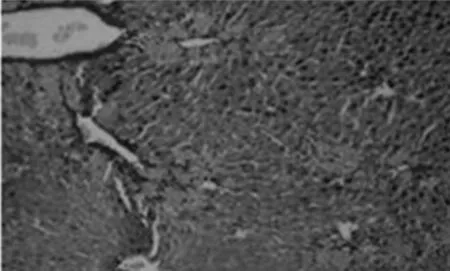
B.CCl4处理组
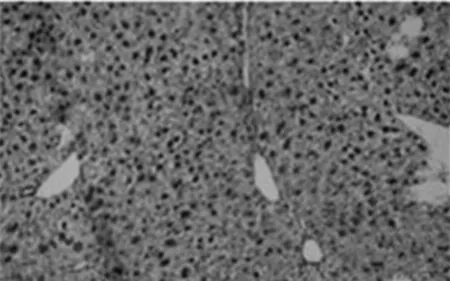
C.GSK-126 5mg/kg组
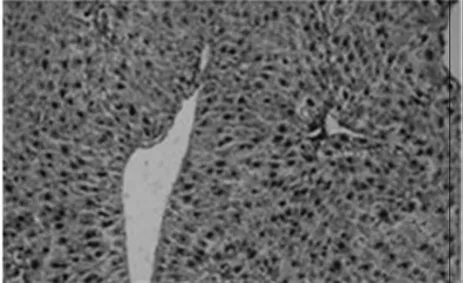
D.GSK-126 15mg/kg组
3 结语
本文就GSK-126对CCl4诱导的小鼠肝纤维化模型是否具有保护作用进行了探究,通过病理学、HE染色、天狼猩红染色及Masson染色等分析肝脏形态变化。结果发现,模型组存在较严重的病变现象,表明其肝损模型建立成功.而GSK-126低、高剂量组小鼠在GSK-126干预下其病变结构较少见,各项指标均有不同程度的好转,GSK-126 15 mg/kg组保护效果更佳.该结果与DNZep抑制肝纤维化的结论是一致的,而DNZep以SD大鼠为模型,DNZep的药物浓度是2 mg/kg,本研究中GSK-126的浓度是5 mg/kg,且15 mg/kg的GSK-126有更好的保护效果.因此,DNZep和GSK-126的剂量还值得进一步研究.
本实验中GSK-126是预防性用药,在CCl4诱导肝纤维化过程中就同时给药GSK-126,而GSK-126作为治疗性用药治疗肝纤维化的研究仍需要探讨其剂量、给药方式以及联合用药的方案,由于GSK-126已用于治疗肿瘤的临床试验,因此具有一定的安全性.
