白细胞介素-6基因多态性与腰椎间盘突出症及腰椎退变程度的相关性
2022-11-22黄向业张茜孙方利李金光赵静
黄向业 张茜 孙方利 李金光 赵静
济宁医学院附属济南市章丘人民医院 1.骨关节科;2.宣传科;3.超声医学科;4.临床实验室,山东 济南 250200
腰椎间盘突出症(lumbar disc herniation,LDH)是临床常见病,病因复杂。以往认为,腰椎间盘病变是由生理性退变、椎间盘损伤、脊柱过度负荷、吸烟等多种因素引起[1-2]。近年来的研究发现遗传因素在椎间盘病变发生、发展中可能扮演着重要的角色[3-4]。有研究显示,人类在近20岁时椎间盘开始持续退变,并且随年龄的增长不断加重[5]。众多国内外研究人员一致认为腰椎间盘的退变与LDH的发病联系紧密[1],是其基本病因。随着分子生物学和分子免疫学的迅速发展以及细胞因子研究的深入,炎性细胞因子在椎间盘退变中的作用越来越受到重视,它可能在椎间盘退行性变的病理生理过程中发挥重要作用[6-7]。IL-6作为重要的促炎因子,在突出的椎间盘组织及周围组织中均有较高的表达活性,且与其他细胞因子和化学介质关系密切,与LDH的发生、发展关系密切[8]。虽然IL-6部分基因位点的基因多态性与LDH的相关性已有学者进行了相关研究,但是IL-6的基因多态性与腰椎退变程度的关系较少有相关文献报道。本研究主要观察IL-6的基因多态性与LDH及腰椎退变程度的关系。
1 资料与方法
1.1 病例资料
选择2018年10月至2020年9月在济宁医学院附属医院和章丘区人民医院骨科住院的患者682例,根据其临床症状、体征、实验室和影像学检查、手术中的发现,分为病例组(LDH组)321例和对照组(非LDH组)361例。
病例组(LDH组)病例纳入标准:①确诊为LDH的患者;②年龄18~60岁;③近三代直系亲属均为汉族。病例排除标准:①合并肝肾疾病、心脑血管、呼吸系统或精神病患者;②合并血液病、糖尿病、自身免疫性疾病、肿瘤等;③体质量指数(body mass index,BMI)<18.5 kg/m2或>28.0 kg/m2。诊断标准参照胥少汀[9]主编的《实用骨科学》第3版。
对照组(非LDH组)纳入标准:汉族,年龄18~60岁,既往无腰腿痛病史,家族中无腰腿痛病史,无骨性关节炎、风湿、类风湿病、红斑性狼疮等结缔组织病,多以外伤骨折、肌腱血管损伤等诊断为主而住院者。病例排除标准:既往有LDH病史,家族中有腰椎间盘突出症病史者,肿瘤患者。
该项研究经医院伦理委员会批准进行,并取得了所有患者知情同意。
1.2 标本收集方法
抽取两组患者外周静脉血作为检测样本。所有研究对象抽血前空腹8 h后,均于早上抽取外周血3~5 mL作为检测样本,然后注入含抗凝剂的真空管中混匀,置于4℃冰箱保存待用。
1.3 主要仪器与试剂
高速离心机(EBA 12,Hettich Germany),紫外分光光度计(上海复日科技有限公司),7500实时荧光定量PCR仪(美国ABI公司),全血DNA抽提试剂盒(QIAamp Blood Kit,德国Qiagen公司),Ex Taq DNA聚合酶(日本TAKARA公司),等位基因分型试剂(美国ABI公司)。
1.4 基因多态性分析
检测指标包括IL-6启动区基因-572C/G和-174G/C,利用TaqMan探针技术对其进行基因多态性检测并进行基因分型。基因多态性分析主要步骤:①DNA的提取:采集含有抗凝剂的外周血2.0 mL,使用全血DNA抽提试剂盒获取基因组DNA,操作按照说明书进行。取DNA样本2µL,用紫外分光光度计检测DNA的纯度和浓度,将DNA检测合格的样本置于-80℃冰箱保存备用。②引物合成:采用7500实时荧光定量PCR仪随机软件Primer Express3.0进行引物和探针的设计。针对每一个基因位点设计2条探针,分别采用VIC和FAM进行荧光标记。所有引物均由invitrogen公司合成。③位点SNP分型:实验反应体系为10µL,其中2×TaqMan等位基因分型预混液5 µL,40×引物探针混合液0.25µL,DNA 2µL,dd H2O2,75µL。反应条件为95℃10 min,95℃10 s,60℃1 min,共40个循环。仪器自动收集荧光信号,软件分析给出SNP分型结果。
1.5 主要观察指标
记录两组患者的基本情况、患者体质量指数、吸烟指数(smoking index,SI)及IL-6基因多态性分布情况和椎间盘退变程度。
1.5.1 吸烟指数 按平均每天吸烟支数乘以吸烟年限评价,参考Battie等方法划分为不吸烟和吸烟两个等级,不吸烟指从未吸过烟和SI<100的个体,吸烟指吸过烟而且SI≥100的个体。由3位经过培训的课题调查员通过问卷调查后提出分类意见。
1.5.2 BMI采用国际通用方法,超重、肥胖判定标准根据国际生命科学会中国办事处中国肥胖问题工作组对中国成人体质量指数分类的推荐意见中建议标准分为过轻、超重、肥胖及正常体质量4个等级。其中BMI<18.5 kg/m2为体重过轻,24 kg/m2≤BMI≤28 kg/m2为超重,BMI>28kg/m2为肥胖,18.6 kg/m2≤BMI≤23.9 kg/m2为正常体质量。由3位经过培训的课题调查员测量研究对象的身高、体质量并将计算结果同以上相应数据进行比较归类。
1.5.3 椎间盘退变程度 病例组均行腰椎MRI检查,应用GE超导型1.5T磁共振成像系统行腰椎矢状位扫描和L1-S1椎间盘横轴位扫描,均在正中矢状面MRI图像上根据T2加权像椎间盘信号强度判定腰椎间盘退行性变的程度,具体参考Gibson等标准划分为5个等级。0级:强信号;1级:较强信号;2级:中等强度信号;3级:较弱信号;4级:无信号。其中0级为正常椎间盘,1~2级分别为轻度、中度退变椎间盘,3~4级为重度退变椎间盘。退变程度取突出节段及相邻椎间盘退变均值。由3位资深MRI诊断医师盲法阅片并提出分类意见。
1.6 统计学分析
以Hardy-Weinberg平衡检查样本是否具有群体代表性。IL-6基因型及等位基因频率采用频率计数法计算,研究对象基因型与等位基因频率的比较均采用χ2检验,两组均数比较采用独立样本t检验,比值比(OR)计算采用Logistic回归分析,各基因型间的MRI分级差异性采用Kruskal-WallisH检验。所有数据均应用SPSS 22.0统计学软件进行分析,检验水准α=0.05。
2 结果
2.1 受试者数量分析
纳入对象病例组321例、对照组361例均进入结果分析,无中途退出者。
2.2 受试者基线资料
两组患者的年龄、性别、体质量指数、吸烟指数比较,差异无统计学意义(P>0.05),见表1。
表1 受试者基线资料[±s,n(%)]

表1 受试者基线资料[±s,n(%)]
基本资料年龄(岁)性别(男/女)BMI(kg/m2)SI≥100病例组43.89±9.21 208/113 24.28±1.08 122/38.12对照组42.51±10.03 230/131 24.31±1.95 146/40.32 t/χ2 1.866 0.087-0.256 0.423 P 0.062 0.768 0.798 0.515
2.3 IL-6基因多态性分析
经Hardy-Weinberg遗传平衡检验,病例组(χ2=1.674,P=0.433)和对照组(χ2=5.255,P=0.072)的基因位点-572C/G基因型均满足Hardy-Weinberg遗传平衡,并且病例组和对照组总体基因型(χ2=4.78,P=0.091)也满足Hardy-Weinberg遗传平衡。IL-6基因型、等位基因分布频率的比较,见表2~5。
IL-6-572C/G基因型频率的差异性分析结果显示,病例组和对照组的基因型CC、CG、GG频率比较,差异有统计学意义(χ2=16.066,P<0.001),等位基因C/G频率的差异性分析结果显示,病例组和对照组的基因型频率比较,差异有统计学意义(χ2=13.700,P<0.001)。
IL-6-572C/G基因型频率的相对风险分析发现,CG基因携带者患LDH的风险是CC基因型的1.545倍(95%CI:1.128~2.117,P=0.007);GG基因携带者患LDH的风险是CC基因型的4.426倍(95%CI:1.730~11.321,P=0.002)。等位基因G携带者患LDH的风险是C患者的1.617倍(95%CI:1.252~2.087,P<0.001)。见表2。
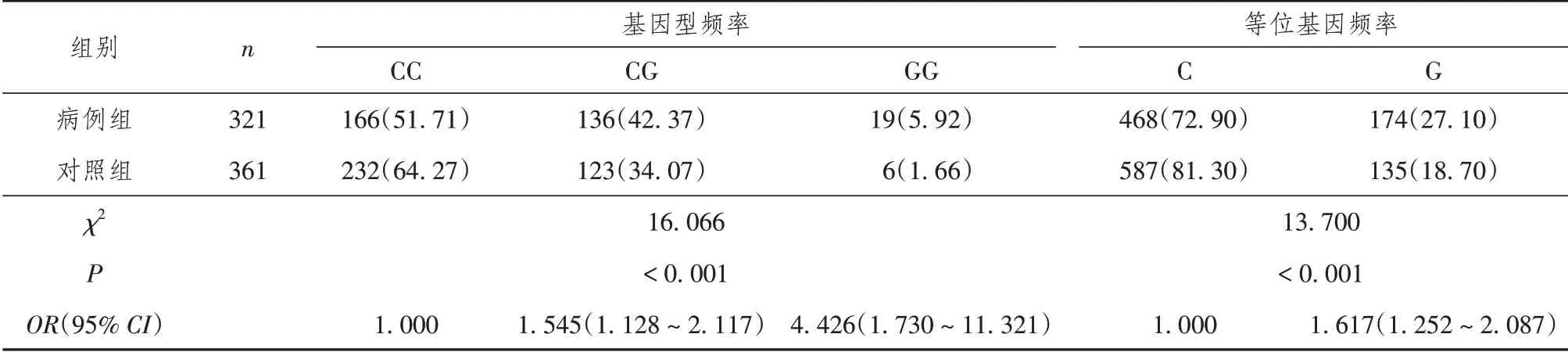
表2 病例组与对照组IL-6-572C/G基因型、等位基因分布频率差异性和相对风险分析[n(%)]
IL-6-174 G/C位点有GG、CG 2种基因型,以GG型为主;经Hardy-weinberg遗传平衡检验,对照组(χ2=0.937,P=0.626)和病例组(χ2=0.484,P=0.785)的基因位点-174G/C基因型均满足Hardy-Weinberg遗传平衡,并且对照组和病例组总体基因型(χ2=1.417,P=0.492)也满足Hardy-Weinberg遗传平衡。
IL-6-174 G/C基因型频率的差异性分析结果显示,病例组和对照组的GG/CG基因型频率差异无统计学意义(χ2=1.058,P=0.304),等位基因频率的差异性分析结果显示,病例组和对照组的基因型频率差异无统计学意义(χ2=1.011,P=0.315)。
IL-6-174 G/C基因型频率的相对风险分析发现,CG基因与GG基因携带者患LDH的风险比较,差异无统计学意义(P=0.305);等位基因G携带者与C携带者患LDH的风险比较,差异无统计学意义(P=0.316)。见表3。
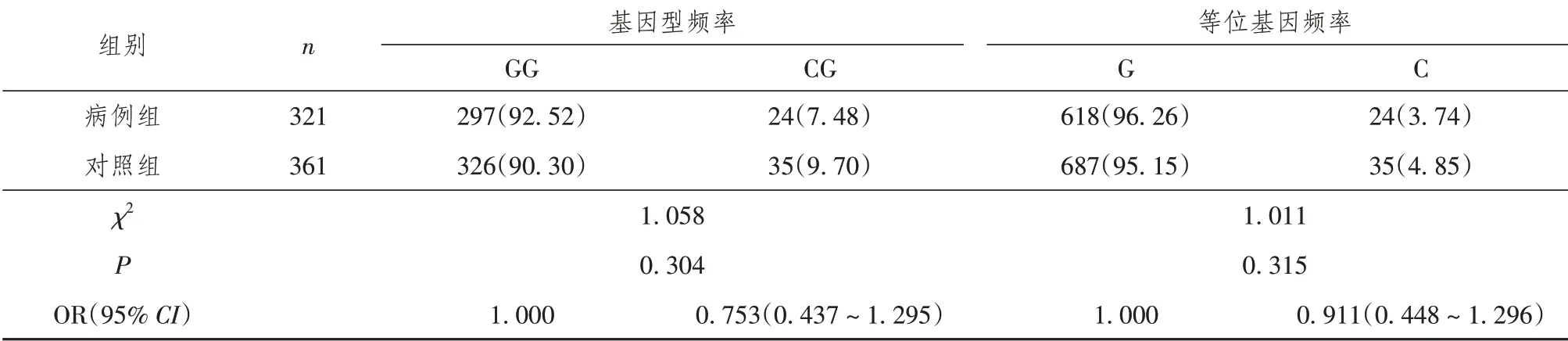
表3 病例组与对照组IL-6-174 G/C基因型、等位基因分布频率差异性和相对风险分析[n(%)]
2.4 IL-6基因多态性与LDH椎间盘退变的关系
321例LDH患者均行MRI检查,并根据Gibson分级判定LDH患者的腰椎退变程度。IL-6-572C/G基因多态性分布与MRI分级有相关性:经Kruskal-WallisH检验,IL-6-572C/G各基因型间的MRI分级有统计学差异(χ2=11.803,P=0.003)。具体见表4。
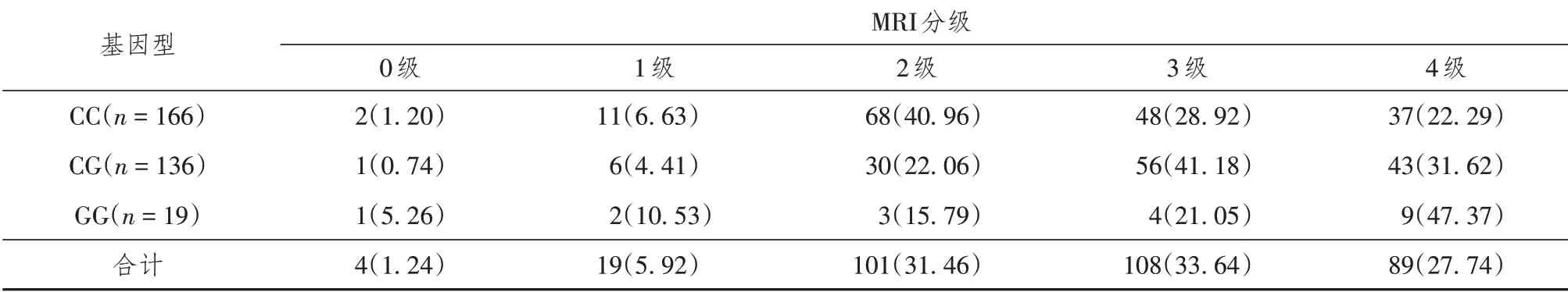
表4 321例腰椎间盘突出症患者IL-6-572C/G基因多态性与椎间盘退变程度的关系[n(%)]
IL-6-174 G/C基因多态性分布与MRI分级无相关性:经Kruskal-WallisH检验,IL-6-174G/C各基因型间的MRI分级无统计学差异(χ2=0.007,P=0.953)。具体见表5。

表5 321例患者IL-6-174G/C基因多态性与椎间盘退变程度的关系[n(%)]
3 讨论
LDH的好发年龄为20~50岁,是导致腰腿痛的最常见的原因。有研究表明,各种炎症因子在腰椎间盘退变和神经根性疼痛中扮演着重要的角色[7],它既是椎间盘退变的结果,又是重要的炎性促进剂,进一步加剧了椎间盘的退变[10],形成恶性循环。腰腿痛由炎性反应引起,其主要机制为各种生物化学因子引起基质金属蛋白酶家族的活性变化,加快椎间盘细胞外基质的降解进程,最终引起椎间盘的退变;而慢性炎症主要是由炎性因子引起,它包括促炎因子和抗炎因子,这两种因子决定着炎症的发展变化趋势。促炎因子和抗炎因子的基因多态性与其自身表达水平有关,因此二者的基因多态性在慢性炎症的形成过程中也具有重要的作用[11]。
IL-6是一种由184个氨基酸组成的糖蛋白,它是由激活的炎症细胞如淋巴细胞和巨噬细胞产生的重要的促炎症细胞因子。IL-6基因启动子区的基因变异,可导致个体间IL-6基因转录与表达的差异,从而影响到个体产生IL-6的水平和相关性疾病的易感性,进而成为一些疾病发生发展的遗传相关因子[12]。IL-6-572基因对IL-6的基因转录有调控功能,其多态性可能影响IL-6的水平;并且多项研究表明,该多态性可以影响健康个体的骨密度水平、代谢特点以及肾移植患者的存活率、糖尿病肾病患者的严重程度[13]。本研究发现,IL-6-572GG基因型及G等位基因频率均高于对照组,而CC基因型频率低于对照组,差异均具有统计学意义(P<0.01);提示IL-6启动区基因-572C/G多态性可以影响中国汉族人群腰椎间盘突出症的发病易感性,G等位基因可能是该人群腰椎间盘突出症发生的遗传危险因素和易感因子。有研究表明,IL-6基因启动子区域-174位点存在G/C单核苷酸多态性,直接影响转录的效率[14]。将其他种族和地区人群IL-6基因多态性研究结果与本研究结果综合分析发现,不同种族间基因分布及等位基因频率均存在显著差异。由于IL-6-174位点突变率很低,在我国LDH的发病机制中不是主要危险因素。
遗传因素在LDH发病中的作用受到国内外众多学者的重视。Videman等[3]通过对孪生子的观察指出,遗传因素是椎间盘退变过程中不可或缺的重要因素。国内外众多研究显示,成人和青少年LDH患者都有明显的家族聚集性,比如父母、子女均发病或者兄弟姊妹均发病等[4]。并且炎症因子、基质金属蛋白酶组织抑制、肿瘤坏死因子(TNF-α)、转化生长因子-β等基因多态性与腰椎间盘退变有关[15]。本研究发现,携带IL-6-572C/G基因GG基因型和CG基因型者椎间盘退变程度较携带CC基因型者严重,携带IL-6-174 G/C基因CG和GG基因型者椎间盘退变程度无明显差异,说明IL-6-572C/G基因其G等位基因可能参与了椎间盘的退变过程。
综上所述,我们认为IL-6-572C/G多态性可能是中国北方地区汉族人群腰椎间盘突出症发病的遗传危险因素之一,其G等位基因可能参与了椎间盘的退变进程。此研究结果为进一步开展腰椎间盘突出症的病因学以及遗传学研究提供了实验依据。由于IL-6的分泌在遗传水平受到多方面因素的影响,并且腰椎间盘突出症和慢性炎症是一种多基因及多因素联合作用的复杂病理过程,因此有待于进行更大样本量、前瞻性、多种族的病例-对照研究,寻找更多的证据加以验证。
利益冲突所有作者均声明不存在利益冲突
