血清转化生长因子-β、白细胞介素-33与急性心肌梗死患者介入治疗预后的相关性
2022-11-22李鹏程建新
李鹏,程建新
(河南科技大学第一附属医院 a.影像中心介入手术室;b.心内科,河南 洛阳 471000)
急性心肌梗死(acute myocardial infarction,AMI)具有发病急、病死率高、预后差等特点,患者典型症状为突发的、长时间的心前区憋闷感或压榨性疼痛,需及时接受有效治疗[1]。经皮冠脉介入术(percutaneous coronary intervention,PCI)是目前临床治疗AMI最有效的方法,可开通阻塞血管,缓解临床症状,但仍有部分患者经PCI后出现多种不良心血管事件,影响预后[2]。因此,积极探寻可预测AMI患者PCI预后的相关指标尤为重要。相关研究表明,PCI可引起血管内膜炎症反应,而炎症反应可参与血栓形成、斑块破裂的过程,是多种心血管事件的主要病理基础[3]。转化生长因子-β(transforming growth factor-β,TGF-β)是一种经典的抑炎因子,具有多种生物功能,可调节免疫细胞功能和炎症反应[4]。白细胞介素(interleukin,IL)-33是IL-1细胞因子家族成员之一,在炎症反应的发生、发展过程中发挥重要作用。因此,推测血清TGF-β、IL-33水平可能与AMI患者PCI预后存在一定关系。鉴于此,本研究旨在观察血清TGF-β、IL-33水平在AMI患者中的表达,并分析二者与AMI患者PCI预后的关系。
1 资料与方法
1.1 一般资料选取河南科技大学第一附属医院2020年3月至2021年3月接收的130例AMI患者作为研究对象。其中男80例,女50例;年龄50~68(59.63±2.49)岁;PCI治疗前Killip心功能分级[5]Ⅰ级32例,Ⅱ级61例,Ⅲ级25例,Ⅳ级12例;发病至接受治疗时间4~8(6.05±0.51)h。患者或家属均已签署知情同意书。(1)纳入标准:AMI符合《内科学》(第9版)[6]中诊断标准,且经影像学检查确诊;②为初次确诊患者,且发病至手术时间<12 h;③于河南科技大学第一附属医院接受PCI;④接受1 a随访;⑤患者及家属依从性良好,可配合完成本次研究调查。(2)排除标准:①既往存在PCI、静脉溶栓、冠脉旁路移植术等治疗史;②合并恶性肿瘤;③合并免疫功能障碍、血液性疾病;④合并先天性心脏病、心肌炎等;⑤伴有严重感染;⑥伴有精神异常,依从性较差。
1.2 研究方法
1.2.1AMI患者PCI预后评估及分组 AMI患者出院后均接受定期随访,以门诊随访为主,电话随访为辅,患者需在出院后3周返院进接受第1次复诊,之后每3个月复诊1次。随访期间,观察并记录患者靶血管再次血运重建、非致命性心肌梗死、非致死性卒中、再发心绞痛、严重心力衰竭等不良心血管事件发生情况,将发生上述情况的患者纳入预后不良组,反之纳入预后良好组。随访1 a,截至2022年3月。
1.2.2血清TGF-β、IL-33水平检测 采集患者入院时清晨空腹肘静脉血5 mL,以3 000 r·min-1离心10 min,离心半径15 cm,取上清液;采用酶联免疫吸附法测定检测血清TGF-β、IL-33水平,试剂盒均购自上海晶抗生物工程有限公司,所有操作严格按照试剂盒说明书执行。
1.2.3一般资料统计分析 由研究人员设计一般资料填写表,询问并记录患者相关资料,内容包括:性别(男、女)、年龄、长期饮酒(是、否;评估标准:饮酒次数每周≥2次,持续1 a以上)、长期吸烟(是、否;评估标准:每日吸烟≥1支,持续1 a以上)、合并糖尿病(是、否)、合并高血压(是、否)、合并高脂血症(是、否)、PCI治疗前Killip心功能分级(Ⅰ~Ⅱ级、Ⅲ~Ⅳ级)、发病至接受治疗时间、PCI治疗前血清TGF-β、IL-33水平。
2 结果
2.1 AMI患者PCI预后情况130例患者PCI后经1 a随访,预后不良有32例,占24.62%(32/130);预后良好有98例,占75.38%(98/130)。
2.2 预后不良组与预后良好组患者一般资料比较预后不良组PCI治疗前血清TGF-β水平低于预后良好组,IL-33水平高于预后良好组,差异有统计学意义(P>0.05);两组性别、年龄、长期饮酒、长期吸烟、合并糖尿病、合并高血压、合并高脂血症、Killip心功能分级、发病至接受治疗时间等其他一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 预后不良组与预后良好组患者一般资料比较
2.3 血清TGF-β、IL-33水平与AMI患者PCI预后的相关性经点二列相关性检验,结果显示,血清TGF-β水平与AMI患者PCI预后呈负相关(r=-0.513,P<0.001),血清IL-33水平与AMI患者PCI预后呈正相关(r=0.391,P<0.001)。
2.4 血清TGF-β、IL-33水平与AMI患者PCI预后的关系logistic回归分析将表1中差异有统计学意义的一般资料(PCI治疗前血清TGF-β、IL-33水平)作为自变量(均为连续变量),将AMI患者PCI预后情况作为因变量(预后不良=1,预后良好=0)。经logistic回归分析,结果显示,PCI治疗前血清TGF-β水平低表达、血清IL-33水平过表达是AMI患者PCI预后不良的风险因子(OR>1,P<0.05)。见表2。
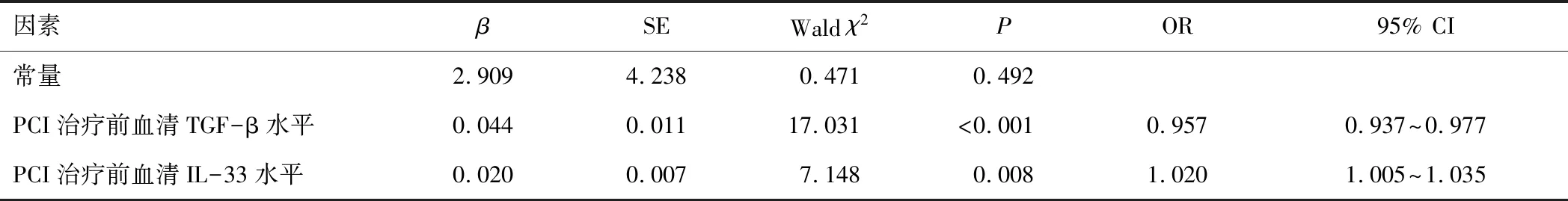
表2 血清TGF-β、IL-33水平与AMI患者PCI预后的关系logistic回归分析
3 讨论
AMI多发于中老年人群,随着人口老龄化加剧,AMI患者数量也逐年增加,已成为心血管类疾病高住院率和高病死率的代表性疾病,如不尽早采取有效治疗,可诱发恶性心律失常、多脏器栓塞等并发症,危及患者生命安全[7]。PCI是治疗AMI主要方案,具有血管再通率高、适应证广、安全性高等特点,可有效控制疾病进展,但仍有部分患者经PCI后出现心绞痛、严重心力衰竭等不良心血管事件,导致预后不良,增加患者痛苦,加重家庭和社会负担[8]。钟晶等[9]研究结果表明,169例AMI患者随访1 a发生不良心血管事件41例,发生率为24.26%。本研究结果显示,130例AMI患者PCI后经1 a随访,预后不良发生率为24.62%,与上述研究无明显差异,说明AMI患者PCI后预后不良风险较高。因此,积极寻求能够预测AMI患者PCI预后的相关指标至关重要,以便早期发现预后不良患者,尽早采取有效措施,从而降低不良心血管事件和改善患者预后。
TGF-β属于转化生长因子超家族的多功能细胞因子,由血小板、中性粒细胞等分泌,可调节炎症过程,在T细胞调节、分化过程中也起到重要作用,其水平失控,可能引起炎症、免疫性疾病等多种病理。相关研究表明,TGF-β参与了心肌细胞重塑的整个过程,也是参与冠状动脉粥样硬化斑块发生发展的重要细胞因子[10]。IL-33是一种双效型蛋白,具有转录调节功能和促炎功能,可通过不同的作用机制参与炎症反应过程。陈继舜等[11]研究表明,PCI术后患者体内高水平炎症反应与预后不良密切相关。因此,推测血清TGF-β、IL-33水平可能与AMI患者PCI预后存在一定关系。
本研究结果显示,预后不良组PCI治疗前血清TGF-β水平低于预后良好组,PCI治疗前IL-33水平高于预后良好组,且经logistic回归分析结果显示,PCI治疗前血清TGF-β水平低表达、血清IL-33水平过表达是AMI患者PCI预后不良的风险因子。由此说明血清TGF-β、IL-33水平与AMI患者PCI预后存在一定关系,且血清TGF-β低表达、IL-33高表达提示AMI患者PCI预后不良发生率较高。分析原因在于,Smad3可抑制巨噬细胞活化,诱导T细胞耐受,抑制T细胞介导的炎症反应。而TGF-β可影响Smad3信号通路水平,导致Smad3磷酸化基团降低,使得Smad无法从细胞膜受体中脱离,刺激平滑肌细胞合成间质胶原,增加斑块的稳定性,且TGF-β还可联合IL-16促进Th17细胞分化,分泌更多的IL-17,增加抑炎因子表达,减少促炎因子的释放,能够通过减轻机体炎症反应起到保护心肌、抗动脉粥样硬化的作用[12-13]。AMI患者血清TGF-β水平降低说明机体抗动脉粥样硬化能力降低,从而增加了PCI预后不良风险。IL-33是重要的促炎细胞因子,通过与其受体ST2结合,可激活有丝分裂原活化蛋白激酶和核转录因子-kb,诱导IL-4、IL-5等Th2细胞因子释放,增强炎症反应。当机体炎症反应增高时,可诱导ST2表达,激活IL-33/ST2信号通路,IL-33被释放到细胞外,导致血清IL-33水平升高[14]。因此,临床可通过检测血清TGF-β、IL-33水平预测AMI患者PCI后预后不良情况,并采取针对性的干预措施以改善患者预后。此外,本研究仍存在不足处,研究所选取的血清TGF-β、IL-33水平容易受到其他因素的影响,得出的数据可能存在一定偏倚,未来仍需进一步研究,通过寻求其他检测方式联合检测,以提高数据的准确性。
综上所述,血清TGF-β、IL-33水平与AMI患者PCI预后存在一定关系,且血清TGF-β低表达、IL-33高表达提示提示AMI患者PCI预后不良发生率较高。
