弥漫性中线胶质瘤46例临床病理分析
2022-11-22张红燕胡培珠崔黎武笑宇秦慧
张红燕,胡培珠,崔黎,武笑宇,秦慧
(郑州大学第一附属医院 病理科,河南 郑州 450052)
弥漫性中线胶质瘤(diffuse midline gliomas,DMGs)是2016年WHO中枢神经系统肿瘤分类[1]中提出的一种新的独立肿瘤类型。WHO对DMGs的定义为中线部位弥漫浸润性生长高级别胶质瘤,伴有星形细胞分化并发生H3F3A或HIST1H3B/C基因上K27M的突变。伴有H3K27M突变的DMGs无论组织学分级为几级,预后均较差,均应视为WHO 4级的高级别胶质瘤。但这种联合基因检测的整合性诊断给传统的基于形态学的病理学诊断带来很大挑战,极易引起误诊。随着研究的不断深入,陆续报道的如毛细胞星形细胞瘤、节细胞胶质瘤或室管膜瘤等非浸润性神经上皮肿瘤亦可伴H3K27M突变,但此类肿瘤的预后目前尚不明确。因此,2018年发表的cIMPACT-NOW第2更新版[2]中对DMGs有了更严格的定义,即肿瘤应该具有弥漫性生长、位于中线部位、具有胶质瘤形态学改变、且同时具有H3K27M的突变,必须同时具备这些条件,才可诊断为DMGs。DMGs最常见的中线部位为脑干、丘脑和脊髓,也可见于下丘脑、松果体、三脑室等其他少见中线部位。DMGs较常发生于儿童,但也可发生于成人。组织学上,多数可见核分裂象的存在,但并不是诊断所必需的条件;部分可观察到微血管增生和坏死;肿瘤浸润性生长,可累及相邻和远处的脑组织。DMGs一般预后差,2 a生存率<10%。在临床工作中,对DMGs患者的准确诊断对临床及预后判断有显著意义,且DMGs患者在疾病进展、治疗和预后等方面均存在差异,为此本研究探讨了46例DMGs伴有H3K27M突变患者的年龄、发病部位、临床特征、病理学特征、免疫表型及分子遗传学特征,旨在为此类患者的准确诊断及规范化、个体化精准治疗提供更多的数据参考。
1 材料与方法
1.1 病例资料收集2017年2月至2022年2月郑州大学第一附属医院病理科数据库里确诊为DMGs的46例病例,由2位病理学专家重新调阅切片。收集46例患者年龄、性别、临床表现、既往病史等信息,并查阅其相关检查资料(MRI、CT)及治疗信息。
1.2 HE染色46例DMGs患者标本中37例患者进行了手术全切或者部分切除,9例为开颅活检或者定向穿刺活检所获取,经体积分数为10%的中性福尔马林固定,常规脱水,石蜡包埋,HE染色。
1.3 免疫组织化学染色采用罗氏Benchmark Ultra全自动免疫组织化学机器进行染色。所用抗体GFAP购自福州迈新生物技术有限公司,ATRX购自北京中杉金桥生物技术有限公司,H3K27M、H3K27me3、Oligo-2均购自上海杰浩生物技术有限公司,Ki-67购自上海基因科技股份有限公司。
1.4 分子病理检测采用Sanger测序的方法检测IDH、H3F3A及HIST1H3B/C基因。
2 结果
2.1 临床特征及病史46例患者中男24例,女22例,年龄分布在3~63岁,中位年龄14岁。46例患者中15例(32.6%,15/46)以头痛为首发症状入院;7例(15.2%,7/46)以头晕为首发症状入院,部分同时伴有恶心、呕吐等症状;11例(23.9%,11/46)以肢体无力、走路不稳为首发症状入院;6例(13.0%,6/46)以视力模糊为首发症状入院;2例(4.3%,2/46)以言语不清入院;1例(2.2%,1/46)以昏迷入院;1例(2.2%,1/46)以面部麻木入院,1例(2.2%,1/46)以上肢麻木入院;1例(2.2%,1/46)以颈部疼痛入院;1例(2.2%,1/46)为会诊病例,缺乏入院资料。46例患者中21例(45.7%,21/46)位于脑干,20例(43.5%,20/46)位于丘脑,3例(6.5%,3/46)位于脊髓,2例(4.3%,2/46)位于松果体区。其中1例(2.2%,1/46)病例呈多发病灶,病变涉及颞叶、海马、岛叶以及基底节区,其余均为单发病灶。46例患者均为首发病例。
2.2 影像学资料46例患者均行头颅MRI检查,影像学显示大部分病变位置较浅,靠近脑膜表面,主要为团块状混杂性长T1长T2信号或混杂性长短T1长短T2信号,部分呈囊实性改变,瘤周可见水肿带,增强后肿瘤可见强化,主要显示为不均匀强化(见图1)。
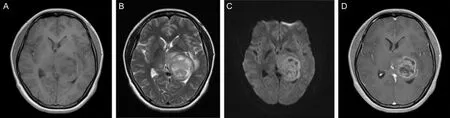
A为轴位T1WI示左侧丘脑类圆形肿块,呈不均匀低信号影,中线结构轻度右移;B为轴位T2WI示病变呈混杂高信号,病变内可见囊变坏死区呈更高信号,灶周可见片状水肿;C为DWI(b=1 000)示病变弥散受限呈稍高信号,病变内囊变坏死区弥散不受限呈低信号影;D为增强扫描示病变不均匀强化,囊变坏死区不强化呈相对低信号影。图1 弥漫性中线胶质瘤的MRI表现
2.3 病理学检查结果
2.3.1大体检查 46例患者中37例(80.4%,37/46)患者进行了手术全切或者部分切除,9例(19.6%,9/46)进行了开颅活检或者定向穿刺活检,切除标本均为较破碎的灰白灰黄色质软组织,活检标本为米粒大小碎组织,或条状组织数条,标本均经全部取样包埋。
2.3.2病理学特点 46例患者形态学表现为高级别胶质瘤形态,组织学多为WHO 3~4级,肿瘤细胞弥漫浸润性生长,无明显界限,瘤细胞密度较高,形态较单一,体积较小,多呈星形细胞分化,可见病理性核分裂象,部分病例伴有坏死及微血管的增生;一部分病例中肿瘤细胞出现少突胶质细胞形态或多形性瘤巨细胞。3例形态学表现为低级别胶质瘤的形态,肿瘤弥漫浸润生长,胶质细胞较稀疏,形态温和,核分裂少见,不伴坏死及微血管增生(见图2)。

A为肿瘤细胞弥漫浸润性生长;B为肿瘤细胞大小较一致,体积较小,呈星形细胞分化,未见明显坏死及微血管增生;C为高倍镜下,肿瘤细胞核呈圆形、卵圆形,可见数个病理性核分裂象;D为肿瘤细胞,细胞质空亮,呈少突细胞分化,可见明显微血管增生;E为肿瘤细胞间可见明显坏死;F为肿瘤细胞弥漫分布,其间可见多形性瘤巨细胞;A~F图像均为HE染色,A为40×,B为100×,C~F为200×。图2 弥漫性中线胶质瘤的病理组织学特点
2.3.3免疫组化特点 免疫组织化学结果显示,46例患者中均弥漫表达GFAP(100%,46/46)、Oligo-2(100%,46/46);其中,40例患者ATRX表现核的阳性(87.0%,40/46),6例患者ATRX表达缺失(13.0%,6/46);46例患者H3K27M均呈弥漫性核强阳性表达(100%,46/46),H3K27me3表达丢失或者下调。Ki-67增殖指数2%~70%,多数患者Ki-67增殖指数较高(见图3)。
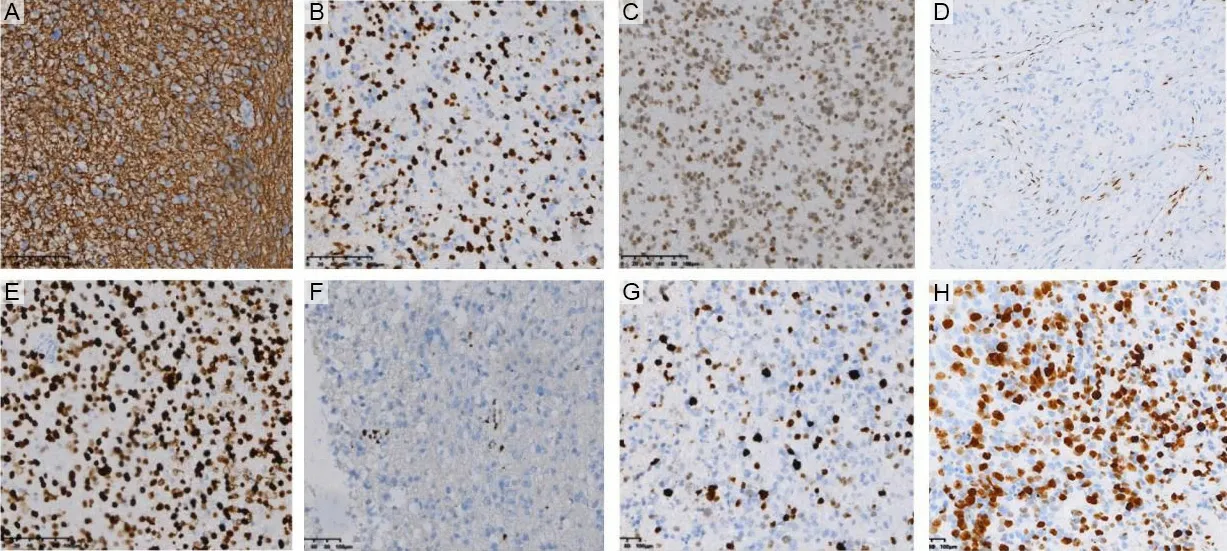
A为肿瘤细胞GFAP弥漫阳性;B为肿瘤细胞Oligo-2阳性;C为肿瘤细胞表达ATRX;D为肿瘤细胞ATRX阴性表达,肿瘤内血管内皮阳性表达;E为肿瘤细胞H3K27M呈弥漫核强阳性表达;F为肿瘤细胞H3K27me3阴性表达,肿瘤内血管内皮阳性表达;G为肿瘤细胞Ki-67增殖指数约20%;H为肿瘤细胞Ki-67增殖指数约50%;图A~H均为罗氏Benchmark Ultra全自动免疫组织化学机器进行染色(200×)。图3 弥漫性中线胶质瘤的免疫组化特点
2.3.4分子病理检测 46例患者均行IDH基因及H3F3A基因检测,个别患者加做HIST1H3B基因检测。其中IDH基因均为野生型(100%,46/46),45例患者检测到H3F3A基因K27M突变(97.8%,45/46),1例患者检测到HIST1H3B(H3C2)基因K27M突变(2.2%,1/46)。
3 讨论
DMGs是2016年中枢神经系统肿瘤分类中新增加的一种独立肿瘤类型,其伴有H3K27M的突变,这类肿瘤包括了旧版的脑干胶质瘤和弥漫性内生型桥脑胶质瘤。H3F3A基因突变首次在2013年首次在儿童脑肿瘤中报道[3],随着研究的不断深入,发现H3F3A在儿童中线部位突变频率较高,且与较差的预后相关[4]。H3K27M突变主要是指组蛋白H3第27位点赖氨酸突变为甲硫氨酸(K27M)。H3K27M突变后可以抑制H3K27M三甲基化(H3K27me3),导致H3K27me3的表达明显降低[5]。组蛋白有2个重要的变体,组蛋白H3.3(H3A)和组蛋白H3.1(组蛋白H3B),主要由H3F3A基因和HIST1H3B/C基因编码。在H3K27M突变的DMGs中大部分肿瘤是由H3F3A所编码,约占肿瘤比例的75%,少部分是由HIST1H3B/C基因编码,约占肿瘤比例的25%。文献报道,伴有H3F3A突变的DMGs生存期通常较短[6],即使运用放化疗,也不能很好改善患者预后。
DMGs主要发生于儿童和青少年,少部分成人也可发生。本研究中大部分患者为儿童或者较年轻的成人,有13例患者为大于30岁的成人,与文献报道[4]基本相符。组织病理学上,DMGs的形态学较广泛,多数表现为形态较单一的,伴星形分化的特点,但也有报道肿瘤形态学类似少突胶质细胞瘤样、室管膜瘤样、节细胞胶质瘤样、上皮样细胞及形态怪异的瘤巨细胞等特点。H3F3A基因及HIST1H3B/C基因也在DMGs的诊断中起着至关重要的作用。但H3K27M的突变并不是DMGs疾病所特有的,文献报道,室管膜瘤[7]、毛细胞型星形细胞瘤[8]、节细胞胶质瘤等其他类型的脑肿瘤中都检测到了H3K27M的突变,并且在这些肿瘤中发生H3K27M的突变对预后的影响尚不明确。有文献报道伴有H3K27M突变的毛细胞星形细胞瘤中,患者生存期长达10 a[8]。
免疫组化的运用在DMGs中有着重要意义。在中线部位的弥漫性胶质瘤中,联合使用免疫组化H3K27M和H3K27me3能有效鉴别出DMGs,一般H3K27M呈现弥漫的核的阳性表达,而H3K27me3表达缺失。本研究病例中H3K27M均呈阳性,但H3K27me3在部分病例肿瘤细胞中完全阴性,但在一些病例中,肿瘤细胞仅表现为部分缺失或者少量阴性。H3K27me3免疫组化不具有特异性,只能作为DMGs诊断的辅助免疫组化指标,不能单独用于DMGs的诊断,必须联合H3K27M使用才具有诊断价值。基因检测在DMGs诊断中起着决定性作用。本研究病例全部进行IDH基因及H3F3A基因检测,结果显示所有病例均未见IDH基因的突变,45例患者呈现H3F3A基因K27M位点突变,1例患者未见H3F3A基因突变,但免疫组化显示H3K27M核强阳性表达及H3K27me3的表达缺失。基于免疫组化支持DMGs的诊断,遂加做HIST1H3B/C基因检测,发现HIST1H3B(H3C2)基因K27M突变。部分文献报道,DMGs可同时伴有P53及ATRX的突变[8],有研究认为H3K27M是恶性胶质瘤的初始启动突变,单纯的H3F3A突变可能不足以导致肿瘤发生,需与其他基因突变联合改变,最终导致肿瘤发生[9]。此外,DMGs伴有H3K27M突变的患者中还可同时伴有PDGFRA、MET等基因的改变[10]。
DMGs伴有H3K27M突变的患者预后均较差[11-12]。传统的胶质瘤的治疗方案是以手术切除肿瘤后再辅以放化疗,但即使临床给予该病一些治疗干预,预后仍然较差。越来越多的研究把DMGs的治疗转向了靶向治疗[13],以期能为患者带来更好的预后。例如运用一些反向改变H3K27M突变的试剂[14]。
综上所述,DMGs伴有H3K27M突变是2016版WHO中枢神经系统肿瘤中的新的疾病类型,是WHO首次将基因改变与组织学改变联合来命名的一种疾病,是一种组织学及分子的整合诊断性诊断。传统的只基于形态学的诊断已不能满足该病的诊断,即使形态学上显示为低级别的胶质瘤,也可能属于该病,也具有较差的预后,需要临床给予更多的重视。所以,正确鉴别DMGs具有重要的临床意义。免疫组化H3K27M及H3K27me3的联合使用在筛查该病中起着关键性作用。如免疫组化支持该病,可进一步基因检测来确诊该疾病。目前,尚无很好的治疗方法能有效改善DMGs的预后,靶向治疗可能会对该病有益,但仍然需要更多的临床资料的积累。
