8种肉类线粒体DNA的提取及貂源性成分PCR检测方法的建立
2022-11-21艾金霞李明成孙丽媛高丽君苑广信张丽华
艾金霞,周 童,李明成,孙丽媛,高丽君,夏 薇,苑广信,张丽华
(1.北华大学医学技术学院,吉林 吉林 132013;2.北华大学药学院,吉林 吉林 132013;3.吉林市雷博科技有限公司,吉林 吉林 132013)
饲养貂和狐狸通常是为了获得其皮毛,貂肉、狐狸肉则被处理掉,为谋取利益,不法商贩低价收购貂肉、狐狸肉冒充牛羊肉出售.由于养殖户在貂的饲料中添加了一些药物及生长激素,貂肉牛羊肉未经检测流入市场存在安全隐患.因此,建立一种能快速、灵敏、特异鉴别肉类的方法已成为食品安全领域亟须解决的问题.
目前,质检部门对肉类鉴定方法主要是蛋白质鉴定和核酸鉴定.蛋白质鉴定肉类品种方法有很大局限,因蛋白质经蒸煮、煎炸、高压等加工处理后结构发生改变而无法精确鉴定,但核酸结构不会改变,因此,以PCR为基础的分子生物学技术已成为食品中肉源性成分鉴别的主流技术.
高等动物线粒体DNA(mitochondrial DNA,mtDNA)编码效率高,进化速度快,尤其是其多态性特点,即使是亲缘关系很近的动物,其mtDNA在分子大小及结构上也有差异,这些特点使mtDNA 成为目前研究动物起源、进化及群体遗传分化的理想研究对象,而mtDNA 的制备是进行这些研究的前提条件[1].我们科研团队完成了貂心组织线粒体DNA及细胞色素b的鉴定[2],并开展了人参、龟甲、蕲蛇和乌梢蛇等中药材基因特异性鉴定研究[3-6].运用DNA分子技术在中药材与易混品种鉴别方面已有很多研究,但用DNA分子标记技术鉴别貂源性成分,国内外文献尚未见报道.本研究通过两种不同方法提取肉类mtDNA,根据细胞色素b(cytochrome b,cytb) 基因独特的优势,设计出貂特异性引物,并运用PCR技术检测貂源性成分.
1 材料、仪器与和试剂
1.1 材 料
试验用牛、羊、猪、鸡、鸭、驴鲜肉(吉林地区不同超市和食品市场);鹿肉(吉林市龙潭山鹿业公司);貂肉(长春市左家貂养殖基地).
1.2 仪 器
GL-20G-Ⅱ型变速冷冻离心机(上海安亭科学仪器厂);UV2550 岛津紫外分析仪(岛津国际贸易上海有限公司);JY-600C型双稳定时电泳仪(北京君意东方电泳设备有限公司);9700型PCR扩增仪(ABI公司,美国);UVWHITE-2020D 紫外凝胶成像自动分析仪(Cold Spring公司,美国).
1.3 试 剂
改良SDS碱变性法的动物组织DNA提取试剂盒为20次用量,其中,P1、P2、P3是细胞消化液,P4、P5是DNA沉淀剂,P6是DNA洗涤剂,P7是DNA溶解液.
DNase、SDS、RNase、Taq DNA Polymerase(华美生物工程公司);化学试剂均为国产分析纯.
2 方 法
2.1 肉类mtDNA的提取
将采集的样品进行分类标记,取0.05 g左右样品放入无菌小烧杯中,加10 mL冷生理盐水溶液浸泡20 min;去除盐水,样品置于EP管中,加入1.5 mL生理盐水,用小型组织匀浆机点式研磨;4 ℃ 10 000 r/min离心5 min,弃上清液.
2.1.1 改良SDS碱变性法[7]
取2.1处理的样品0.02 g,置于离心管中;加入P1溶液500 μL、P2溶液30 μL、P3溶液15 μL混匀,置于56 ℃水浴振荡1 h;取出后加入P4溶液500 μL,充分混匀10 min,10 000 r/min离心10 min;取上清液,加入等体积P5溶液,-20 ℃放置1 h;取出后10 000 r/min离心10 min;弃去上清液,沉淀中加入P6溶液200 μL,混匀,11 000 r/min离心10 min(重复1次);弃去上清液,沉淀,室温晾干后分别加入P7溶液100 μL溶解DNA,混匀,作为供试品DNA溶液.
2.1.2 盐析法[8]
取2.1处理的样品0.05 g,置于乳钵中,加65 ℃预热的DNA提取试剂250 μL,在液氮中研磨;磨碎溶液转入离心管56 ℃水浴振荡1 h,4 ℃ 12 000 r/min离心10 min,上清液转入离心管,加250 μL氯仿/异戊醇(24∶1),室温8 000 r/min离心10 min,上清液转入离心管,加预冷的异丙醇200 μL,-20 ℃冷冻1 h;4 ℃ 12 000 r/min离心5 min,弃上清液,晾干,加70%乙醇200 μL清洗,室温12 000 r/min离心3 min,弃去乙醇;干燥后加100 μL TE(pH 8.0)或双蒸水,放入-20 ℃冰箱中备用.
2.2 mtDNA的纯度和浓度的检测
将两种方法提取的DNA适当稀释,用紫外分光光度仪分别测定吸光度A260、A280,以A260/A280的比值鉴定mtDNA的纯度,并计算DNA 的浓度.
2.3 mtDNA琼脂糖凝胶电泳检测
制备0.8%琼脂糖凝胶(内含GelRed),将两种方法提取的mtDNA与适量6倍上样缓冲液混匀后点样,3 V/cm凝胶电泳2 h,应用紫外灯观察并拍照.
2.4 肉类中貂源成分PCR检测
2.4.1 引物设计
在GenBank中下载紫貂(KF824765.1)基因序列,应用Premier5.0软件设计貂特异性引物,利用NCBI中的在线软件Primer-BLAST 对设计的引物进行评估,上游引物:5′TCCACCCATACTACACCA TC3′;下游引物:5′ATCATGCCTCGTTGTTTTGA3′.引物由上海生工生物工程技术服务有限公司合成.
2.4.2 PCR扩增反应体系
将分别用两种方法提取的样品DNA作为模板进行PCR扩增.PCR反应体系:PCR反应管总体积为20 μL,含有Master Mix混合酶10 μL,上下游引物各1 μL,模板DNA1 μL,余为双蒸馏水.经PCR扩增后将引物加入反应管中,PCR反应按下列程序进行:94 ℃预变性5 min,94 ℃ 变性30 s,退火温度58 ℃ 30 s,72 ℃延伸 30 s,30个循环,72 ℃延伸10 min,4 ℃保存.
2.4.3 PCR产物检测
制备1.5%琼脂糖凝胶,将PCR产物混匀后点样,3 V/cm凝胶电泳90 min,应用紫外分析仪检测OD值,并拍照.
2.5 特异性试验
取已制备的貂、牛、羊、猪、驴、鹿、鸡、鸭等8种动物肉的DNA各0.1 μg作为模板,加入体系中进行PCR扩增,同时设阴、阳性对照,并应用电泳鉴定其特异性.
2.6 敏感性试验
将制备的貂肉的DNA模板依次2倍递增稀释,每个稀释度各取1 μL作为模板进行PCR扩增,同时设阴、阳性对照,并应用电泳鉴定其敏感性.
3 结 果
3.1 8种肉类mtDNA的提取
分别使用改良SDS碱变性法和盐析法提取8种肉类mtDNA,结果显示两种方法均成功提取了8种肉类的mtDNA.改良SDS碱变性法提取的mtDNA条带较盐析法更清晰,泳道背景没有出现拖尾现象.结果见图1.

M.DL23kbp DNA Marker;1、9.紫貂;2、10.牛肉;3、11:羊肉;4、12.猪肉;5、13.驴肉;6、14.鹿肉;7、15.鸡肉;8、16.鸭肉.图1肉类样品mtDNA琼脂糖凝胶电泳图谱Fig.1Agarose gel electrophoresis of mtDNA in meat samples
3.2 mtDNA浓度及纯度
两种方法提取的8种肉类DNA浓度和纯度比较见表1.由表1可知,改良SDS碱变性法和盐析法提取肉类mtDNA处于同一数量级,均能保证后续的PCR实验要求.

表1 两种方法提取肉类DNA浓度和纯度Tab.1 Purity and concentration of DNA by two kinds of extraction methods
3.3 特异性试验结果
通过反复梯度PCR试验筛选出最佳退火温度为58 ℃.用8种目标肉类mtDNA作为模板,对设计的貂肉引物进行特异性验证.结果显示,用该引物仅在貂肉mtDNA模板上能扩增出大小约为289 bp的目的片段,与预期片段大小一致;其余7种生肉则无扩增目的片段,呈阴性,证明本研究成功建立了一种生肉中貂源性成分鉴定的PCR方法.结果见图2.

M.DNA Marke;1.紫貂;2.牛肉;3.羊肉;4.猪肉;5.驴肉;6.鹿肉;7.鸡肉;8.鸭肉;9.阴性对照.图2貂引物对8种肉类PCR鉴定结果Fig.2Identification results of Martes zibelliza primers for PCR in 8 kinds of meat samples
3.4 敏感性试验结果
将制备的貂肉DNA模板依次做2倍递增稀释,再进行PCR扩增,结果发现,当反应体系中含貂源性成分DNA6.25 ng/μL时,经过30个循环的扩增、电泳后可在紫外灯下观察到明显的目的条带.结果见图3.
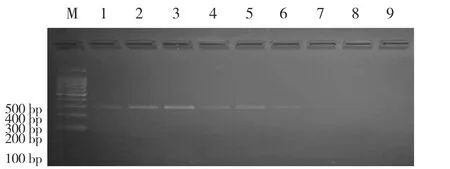
M.DNA Marke;1.100 ng/μL;2.50 ng/μL;3.25 ng/μL;4.12.5 ng/μL;5.6.25 ng/μL;6.3.13 ng/μL;7.1.57 ng/μL;8.0.79 ng/μL;9.阴性对照.图3貂源性成分PCR扩增灵敏度结果Fig.3Agarose gel electrophoretogram of PCR for the sensibility experiment
4 讨 论
我国在貂、狐狸、貉等动物养殖方面一直处于领先地位[9],但国内的毛皮动物养殖方式主要以个体农户养殖为主,因此,在流通上缺乏统一规范的监督管理.貂是经济价值较高的毛皮动物,我国貂主要产地为河北、山东、吉林、辽宁、黑龙江和内蒙古等地[10].貂肉、狐狸肉成本低廉,获得渠道广,肉量充足,一只成年的貂重6~10 kg[11],据中国皮革协会发表貂、狐、貉取皮数量统计,2016年我国水貂皮数量2 616万张[12],而其动物尸体的流向却很少得到关注.一些不法企业和个人收购貂肉冰存,做成羊肉卷和火腿肠等食品,而从肉眼上经加工处理后的貂肉无法与牛羊肉辨别.
物种特异性PCR方法具有操作简单、对样品要求低、特异性强和灵敏度高的特点,该方法的使用极大改善和方便了食品中动物源成分的检测[13].应用分子遗传学标记技术鉴定貂源性成分的关键是提取出一定数量和质量足够好的DNA.现有的DNA 提取方法有SDS碱变性法、密度梯度离心法、盐析法、酶消化法、柱层析法等[14].本研究采用两种不同方法提取了8种生肉的mtDNA.为获得高纯度的mtDNA,我们对SDS碱变性法进行了优化,研制出动物组织mtDNA提取试剂盒.改良SDS碱变性法所用试剂均为分子生物学实验常用试剂,应用差速离心去除细胞碎片及杂质,再利用SDS能溶解核膜的特点破碎核膜,碱变性去除蛋白及DNase 酶消化黏附在线粒体外膜的核DNA,以排除核DNA的干扰.本研究提取的mtDNA浓度和纯度测定的结果显示,两种方法提取的mtDNA均能达到PCR要求,但SDS碱变性法不需分离和纯化线粒体,可以从完整的细胞直接分离mtDNA,方法简单快速,对实验室设备和试剂要求不高,提取时间短,成本低廉,DNA结构完整,因此,本方法提取动物组织mtDNA完全可以用于常规分子生物学和分子遗传学研究工作.
以PCR为基础的DNA检测技术已逐步成为肉类种属鉴定的核心方法,多以线粒体的细胞色素b、12S rRNA和D-Loop区域为靶序列,检测方法的灵敏度一般都能达到1%或更低,远远超过现实的检测需求[15].CHEN Y等[16]报道了马、驴、鹿、骆驼等成分的PCR检测方法,多重PCR技术也被广泛应用于食品中牛、羊、猪、鸡、鸭等常见肉多种成分的检测.HE W L等[17]应用引物多重PCR法快速鉴别食品中猪肉、牛肉、羊肉和鸡肉成分;MATSUNAGA J等[18]应用一次PCR同时对食品中的6种肉的mtDNA进行检测,根据DNA片段的长度来鉴别混合肉制品的动物源性;GIRISH PS等[19]应用PCR-RFLP法在12S rRNA区段设计引物扩增出片段鉴别肉制品中种属特异性成分.近年来,实时荧光PCR技术的发展提高了食品中物种鉴别的效率和灵敏度,并使肉类含量的定量溯源成为可能[20].虽然DNA检测技术目前在国内外有一些报道,但仍处于理论研究阶段,特别是动物食品DNA检测试剂的开发和应用方面国内外未见深入研究,线粒体DNA在肉类产品中貂源性成分鉴定方面的文献中还未见报道.
设计出貂mtDNA细胞色素b特异性引物是鉴别貂源性成分的另一个关键.查找近年来用于鉴别貂产品文献,从GenBank中下载紫貂和水貂位于mtDNA的基因序列,设计一对特异性引物.经反复试验摸索,通过优化PCR反应条件,确定退火温度为58 ℃,在该温度下289 bp的目的条带最清晰,其他7种肉类均无PCR反应,此结果显示引物特异性很强.PCR反应敏感性试验结果显示,当反应体系中含貂mtDNA仅为6.25 ng/μL时,经过扩增、电泳后仍可观察到明显的目的条带.
本研究是国内首次设计的貂源性引物,通过比较不同肉类mtDNA序列差异进行貂源性成分鉴定,与目前常见的多重PCR、PCR-RFLP、荧光定量PCR等方法比较,本方法灵敏度高,特异性强,PCR反应体系更简单可靠,试剂仪器普通实验室均具备,成本低廉,检测时间短,可满足普通实验室肉类品种鉴定,并可在质检部门应用推广.
本研究的后续工作将针对加工肉类制品如肉串、火腿肠、丸类等的组分进行分析,并探讨荧光定量PCR技术对纯肉、肉卷等肉类的检测.
