小麦PR5Ks 蛋白家族鉴定与分析
2022-11-21马秋颖耿怀民崔钟池申松松王海燕刘大群
马秋颖,耿怀民,崔钟池,申松松,王 菲,王海燕,刘大群
(河北农业大学 植物保护学院/河北省农作物病虫害生物防治技术创新中心,河北 保定 071000)
为抵御各种逆境造成的损害,植物体进化出大量能够识别外界刺激的潜在免疫受体,当植物体受到胁迫时,受体通过一系列反应将信号传递到植物体内,从而激发植物的防御过程[1]。其中类受体蛋白激酶(Receptor-like protein kinase,RLK)是防御反应中的一类重要的受体因子[2],RLKs 可以通过磷酸化和去磷酸化调控相关基因表达,在调控植物生长发育和胁迫反应中发挥着重要作用[3]。小麦中类受体蛋白激酶基因TaPK3A能够提高小麦抗纹枯病的能力[4];RLK 蛋白TaCRK10 通过与TaH2A互作,激活耐高温小麦对条锈病的抗性[5],大豆GsCBRLK的过表达能够增强植株对高盐和ABA 的耐受性[6]。因此,对RLKs 蛋白相关功能的研究有助于揭示RLKs 在植物抗病防御反应中分子机制以及信号转导途径,对分析植物对外界刺激产生的反应机制具有很大帮助。
植物病程相关蛋白5(Pathogenesis-related protein 5,PR5)是一种重要的植物防御蛋白家族,类PR5受体蛋白激酶(PR5 receptor-like protein kinase,PR5Ks)作为RLK 家族的1 个亚族,包含2 个结构域,其中1 个胞外结构域与PR5 相似性高,具有与PR5相似的氨基酸序列和结构[7];另1 个是激酶结构域,具有磷酸化活性,其所编码的蛋白功能与受体激酶一致。PR5Ks 一般是由665 个氨基酸构成的多肽序列,该家族与植物的抗病防御反应相关[8]。有研究表明,类受体蛋白激酶GhPR5K可以增强棉花抗黄萎病的能力[9];拟南芥AtPR5K2通过磷酸化ABI1 和ABI2 调节ABA 依赖的干旱胁迫信号转导[10]。
小麦是世界上主要的粮食作物之一,对小麦抗病相关基因的挖掘、抗病机制的研究以及小麦的抗病育种和稳产高产具有重要意义。目前,RLKs 已被证明在多种抗逆胁迫中发挥重要作用[11],作为与PR5 结构相似的受体激酶,PR5Ks 家族的研究相对较少,仅在拟南芥和棉花中被成功分离和鉴定,并初步验证了其抗干旱和抗病的相关功能[12],在小麦中尚未见报道,为此本研究拟利用小麦基因组数据库对小麦PR5Ks 蛋白家族进行筛选和鉴定,并从理化性质、蛋白结构等方面进行分析,进一步探索小麦PR5Ks 蛋白家族的功能特点,为PR5Ks 蛋白家族在小麦抗病防御反应中发挥功能的研究奠定基础。
1 材料与方法
1.1 小麦PR5Ks 蛋白家族的鉴定与理化性质分析
结合在线工具NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和HMMER(https://www.ebi.ac.uk/Tools/hmmer/search/hmmscan) 进 行结构域分析,借助小麦基因组数据库(http://plants.ensembl.org)获得小麦中PR5Ks 序列。利用在线软件ExPASY-ProtParam(https: // www.expasy.org)对筛选出的小麦PR5Ks 家族进行理化性质的分析,同时借助在线软件Cell-PLoc(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc/)进行该家族的亚细胞定位预测。
1.2 小麦PR5Ks 蛋白家族蛋白结构预测
利用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对小麦PR5Ks 蛋白家族进行二级结构预测。利用在线工具SWISS-MODEL(https://swissmodel.expasy.org/interactive)对小麦PR5Ks 家族蛋白进行三维结构分析。
1.3 小麦PR5Ks 蛋白家族的基因结构和保守基序分析
借助在线工具GSDS(http://gsds. gao-lab. org/index.php)对小麦PR5Ks 家族成员进行结构分析。利用蛋白质保守基序在线搜索程序MEME(http://meme-suite.org)分析,基序设置为24 个,其他为默认值,对小麦PR5Ks 成员进行保守基序分析。
1.4 小麦PR5Ks 家族的启动子分析
从小麦基因组数据库中获得17 个小麦PR5Ks基因转录起始位点上游2 000 bp 的启动子序列,提交至在线程序 PlantCARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html),预测顺式作用元件,然后使用GSDS 2.0 进行数据可视化。
1.5 抗病相关PR5Ks基因的初步筛选
为了明确小麦PR5Ks基因的表达情况,借助expVIP 数据库分析其在赤霉菌(Fusarium graminearum)和条锈菌(Puccinia striiformisf. sp.tritici)胁迫下的表达水平,最终获得17 个成员的相关信息,最后借助TBTools 对PR5Ks基因的表达模式进行可视化和聚类分析。
采用撒粉接种法将小麦叶锈菌THTS 同时接种于小麦感病品种‘Thatcher’和抗病品种‘TcLr19’上,分别取0、12、24、48、72、96、144、168 h 的叶片,以TaPR5K-3、TaPR5K-5、TaPR5K-9和TaPR5K-11序列为靶标设计引物(表1),利用实时荧光定量PCR(Quantitative real-time PCR,qPCR)技术,检测TaPR5K-3、TaPR5K-5、TaPR5K-9和TaPR5K-11叶锈菌诱导时的表达模式。

表1 qPCR 引物序列Table 1 Primers used for qPCR
2 结果与分析
2.1 小麦PR5Ks 蛋白家族的鉴定与理化性质分析
借助中国春数据库,通过Pfam ID(PF00314)查询到140 个具有PR5 结构域的基因,获得序列并提交到NCBI-CDD 在线网站进行保守结构的检测,最终获得17 个含有PR5 和激酶结构域的受体蛋白激酶(图1),将这17 个小麦PR5Ks基因命名为TaPR5K-1~TaPR5K-17(表2)。利用在线网站进行理化性质分析,结果显示,17 个小麦PR5Ks基因序列中氨基酸的数量在415 ~663,相对分子量在73.52(TaPR5K-3) ~44.60 kD(TaPR5K-13), 等电点介于5.61(TaPR5K-1)~8.4(TaPR5K-13),大多数属于酸性蛋白。同时发现,小麦PR5Ks 蛋白平均疏水性均为负值,为疏水性蛋白。亚细胞定位预测结果显示,除TaPR5K-13 定位在细胞壁、细胞质、细胞核上,其余小麦PR5Ks 均只在细胞核中有定位。
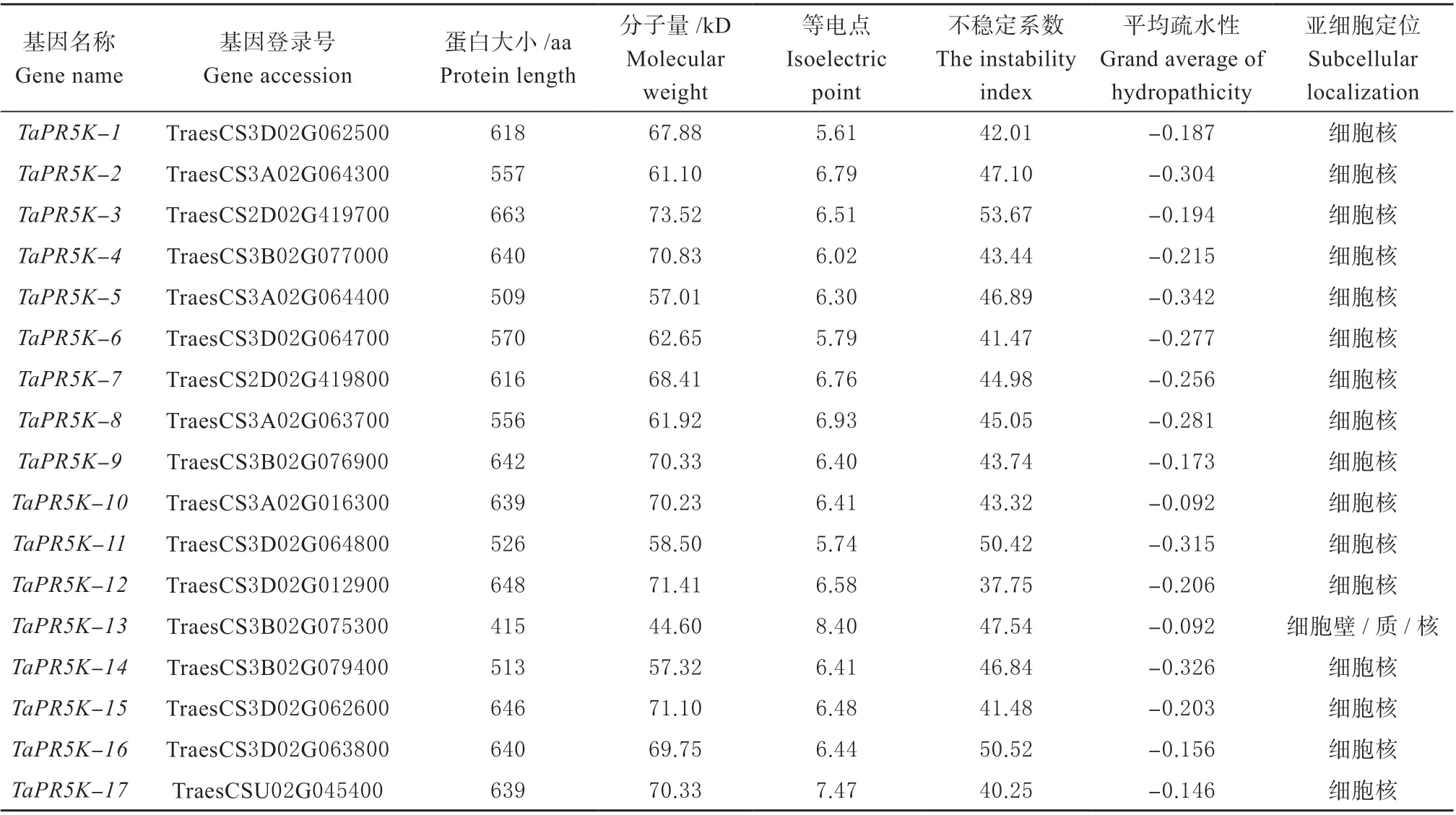
表2 小麦PR5Ks 蛋白家族理化性质分析Table 2 Physicochemical properties of PR5Ks proteins in wheat

图1 小麦PR5Ks 蛋白家族的结构域分析Fig. 1 Domain analysis of wheat PR5Ks protein family
2.2 小麦PR5Ks 蛋白家族的结构预测
对小麦PR5Ks 蛋白家族的二级结构进行预测,PR5Ks 蛋白主要由α 螺旋、β 转角、延伸链、无规则卷曲4 种构型组成,其中无规则卷曲所占比重最大,在41.07%~49.16%之间;其次是α 螺旋,占比在25.3% ~34.22%;β 转角占比相对较少,在4.91 ~8.61 之间,主要集中在6%(表3),说明小麦PR5Ks 蛋白家族主要由无规则卷曲和α 螺旋组成,分布于整条肽链中。同时,借助SWISSMODEL 在线工具分析PR5Ks 家族蛋白的三级结构,结果显示,PR5Ks(除TaPR5K-13)蛋白含有大量的α 螺旋和少量的β 折叠,但TaPR5K-13 主要由β 折叠构成,表明TaPR5K-13 与其他PR5Ks蛋白相比可能执行特殊的功能。虽然这些PR5Ks蛋白的三级结构有一定的相似性,但也存在差异,这些差异可能导致不同的蛋白在功能上有一定的不同(图2)。
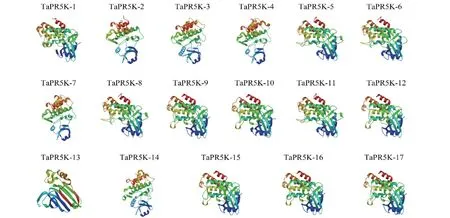
图2 小麦PR5Ks 蛋白家族三级结构预测Fig. 2 Prediction of tertiary structure of PR5Ks proteins in wheat

表3 小麦PR5Ks 蛋白家族二级结构预测Table 3 Prediction of secondary structure of PR5Ks proteins family in wheat

续表:
2.3 小麦PR5Ks 蛋白家族基因结构和保守基序的分析
利用在线工具GSDS 对小麦PR5Ks 蛋白家族成员进行基因结构分析,结果显示,17 个PR5Ks中TaPR5K-4、TaPR5K-9、TaPR5K-10、TaPR5K-11、TaPR5K-13、TaPR5K-14、TaPR5K-15、TaPR5K-16均只有一段外显子,没有内含子区段;TaPR5K-3有3 个外显子和2 个内含子,剩下8 个PR5Ks包含2个外显子,被1 个内含子分隔开。总体来看,小麦PR5Ks有1 ~3 个外显子,家族结构相对简单(图3A)。
通过在线软件MEME 对小麦PR5Ks 蛋白家族进行保守基序分析,17 个小麦PR5Ks 家族共24个motif,均含有motif 4、motif 5、motif 9、motif 10、motif 11,是PR5Ks 蛋白的特征基序。其中TaPRKK-5、TaPRKK-11、TaPRKK-13、TaPRKK-14与其余14 个PR5Ks 相比,所含保守基序较少,差异较大(图3B)。

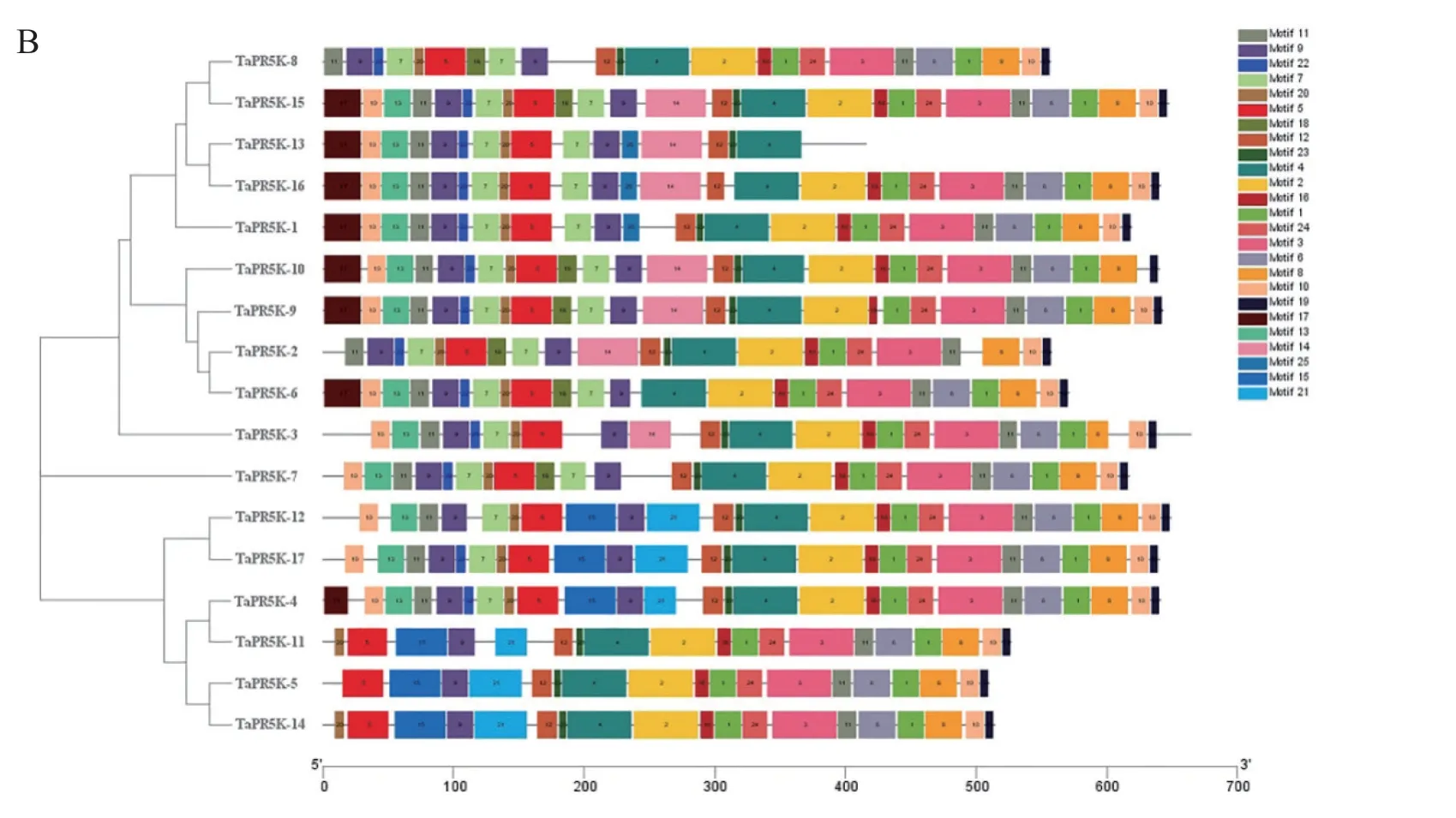
图3 小麦PR5Ks 蛋白家族的结构分析(A)和保守基序分析(B)Fig. 3 Gene structural analysis (A) and conserved motifs (B) of wheat PR5Ks protein family
2.4 小麦PR5Ks基因的启动子序列分析
为了了解PR5Ks的转录调控,通过PlantCARE在线软件分析17 个小麦PR5Ks基因上游2 000 bp的启动子序列包含的顺式作用元件。分析结果显示,激素响应元件有水杨酸响应元件TCA-element、茉莉酸甲酯响应元件CGTCA-motif 和TGACGmotif、ABA 响 应 元 件ABRE 等,这 表 明PR5Ks参与激素调控反应。其中TCA-element、CGTCAmotif 和TGACG-motif 为主要的激素响应元件,说明PR5Ks可能响应SA 或MeJA 信号。此外,小麦PR5Ks基因的启动子序列中包含的非生物胁迫元件为厌氧诱导元件ARE、低温响应元件LTR、参与干旱诱导的MYB 结合位点MBS、干旱和盐响应元件MYC 和防御和胁迫响应元件TC-rich 元件,这些与非生物胁迫相关的顺式作用元件的存在说明PR5Ks是受非生物胁迫响应的(图4)。总体表明PR5Ks基因在小麦生长发育中具有一定作用,并且可能参与植物的抗逆、抗病防御反应。

图4 小麦PR5Ks基因启动子分析Fig. 4 Promoter prediction ofPR5Ksgenes in wheat
2.5 小麦PR5Ks的表达谱分析
为了初步明确小麦PR5Ks基因的抗病性,借助expVIP 数据库,分析PR5Ks基因在2 种小麦主要病原菌赤霉菌(Fusarium graminearum)和条锈菌(Puccinia striiformisf. sp.tritici)侵染小麦时表达量的变化并绘制热图。分析结果显示,在小麦接种赤霉菌后,与对照组相比TaPR5K-2、TaPR5K-3、TaPR5K-5、TaPR5K-6、TaPR5K-7、TaPR5K-9、TaPR5K-11在小麦中均上调表达。TaPR5K-3在接种赤霉菌后36 h 和48 h 上调表达,约为对照组的11.0 倍和6.4 倍;TaPR5K-2、TaPR5K-5、TaPR5K-6、TaPR5K-9、TaPR5K-11在接种后48 h 表达量达到最大,分别约为对照组的4.7,6.7,5.0,5.7 和4.0 倍(见图5A),表明TaPR5K-2、TaPR5K-3、TaPR5K-5、TaPR5K-6、TaPR5K-7、TaPR5K-9、TaPR5K-11受赤霉菌的诱导。
接种条锈菌后,TaPR5K-8在9 d 和11 d 上调表达,约为对照的4.0 和8.6 倍,TaPR5K-9在1 d和11 d 为表达量的2 个高峰,约为对照的3.4 倍和4.7 倍;TaPR5K-2、TaPR5K-3、TaPR5K-4、TaPR5K-5、TaPR5K-6、TaPR5K-7、TaPR5K-10、TaPR5K-11在接种后1 d 表达量较高且为最大值(图5B)。上述基因在接种条锈菌后均有表达且发生变化,说明这些基因的表达量受条锈菌的诱导。

图5 赤霉菌(A)和条锈菌(B)诱导下小麦PR5Ks基因的表达模式Fig. 5 Expression pattern of wheatPR5Ksgenes induced byFusarium graminearum(A)andPuccinia striiformisf. sp.tritici(B)
2.6 叶锈菌诱导下小麦PR5Ks的表达分析
expVIP 数 据 库 分 析 显 示,TaPR5K-3、TaPR5K-5、TaPR5K-9和TaPR5K-11受 赤 霉 菌 和 条锈菌共同诱导,为明确这4 个基因是否受叶锈菌诱导,以小麦抗病品种‘TcLr19’(非亲和组合)和感病品种‘Thatcher’(亲和组合)接种小麦叶锈菌THTS,利用qPCR 技术检测TaPR5K-3、TaPR5K-5、TaPR5K-9、TaPR5K-11的表达模式。结果显示,TaPR5K-3在非亲和组合中表达量变化显著,0 ~72 h 呈上升趋势,72 h 达到最大,约为对照组(0 h)的12.0 倍,亲和组合中表达量变化较小;TaPR5K-5在非亲和组合中96 ~168 h 表达量上升显著,168 h达到最大,约为对照组的4.8 倍,亲和组合中表达量差异性小,表达较平稳;TaPR5K-11在非亲和组合中144 h 为表达高峰,约为对照组(0 h)的7.2 倍;亲和和非亲和组合中TaPR5K-9均在72 h 出现表达高峰,且差异较小,但0 ~168 h 内,非亲和组合表达量均高于亲和组合(图6)。表明TaPR5K-3、TaPR5K-5、TaPR5K-9和TaPR5K-11受叶锈菌诱导,且在小麦与叶锈菌互作过程中发挥正向调控作用。
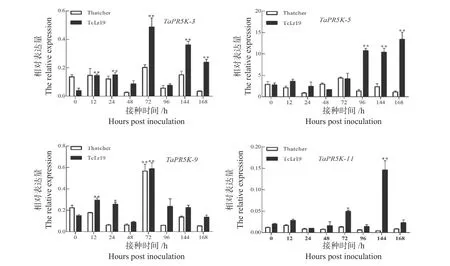
图6TaPR5Ks基因在接种叶锈菌THTS 后的表达分析Fig. 6 Expression analysis ofTaPR5Ksinoculated with THTS
3 结论与讨论
根据不同物种的基因组数据库,利用多种生物信息学技术筛选、鉴定和分析相关基因,已经成为一种快速、有效筛选目的基因的途径,例如通过对小麦CIPK基因家族分析,筛选出响应不同胁迫的TaCIPK基因[13];番茄基因组中GRAS 家族成员的分析获得SLGRAS43基因,并验证该基因可以增强植物的抗干旱和抗寒冷的能力[14];Liu 等人通过对菜豆CesA/Csl基因家族全基因组生物信息学和发育表达的分析,初步揭示了菜豆纤维素合酶基因的生化生理功能[15]。本研究借助中国春数据库对小麦PR5Ks 蛋白家族进行鉴定,共筛选出17 个PR5Ks成员,在此基础上对该家族的理化性质、结构特征进行分析。同源建模是预测蛋白质结构的有效工具,在确定蛋白质功能时,蛋白质结构信息往往比单靠序列数据分析更有价值。17 个PR5Ks 三维(3D)模型显示,TaPR5K-13 与其余蛋白三级结构差异较大,推测TaPR5K-13 可能具有特殊功能,小麦PR5Ks蛋白家族内含子/外显子和保守基序结构相对保守,说明功能上有一定的相似性。
为了探究小麦PR5Ks 蛋白家族功能,本研究对启动子序列进行分析。启动子是位于基因5’上游的一段DNA 序列,顺式作用元件是启动子上调控基因表达所必需的元件,分析基因启动子上的顺式作用元件,可初步预测该基因可能存在的生物学功能[16-17],例如,水稻OsWRKY13基因在水稻抗性防御反应中发挥着关键作用,顺式元件PRE4 与OsWRKY13 结合,调控OsWRKY13基因表达[18]。本研究中,PR5Ks启动子区域包含多个激素响应元件和逆境防御响应元件,不同基因元件的种类和数量有所不同,说明PR5Ks 家族响应不同的刺激信号。SA 和MeJA 是调节植物胁迫的信号分子,在植物生长发育和抗病反应中发挥作用[19],TaPR5K-4、TaPR5K-7、TaPR5K-10、TaPR5K-11、TaPR5K-17同时含有SA 和MeJA 信号响应元件,推测这些基因可能是小麦PR5Ks基因参与生物胁迫时的关键基因。同时,PR5Ks启动子区域还包括逆境响应元件,说明PR5Ks 可能参与小麦的生物或非生物胁迫响应与调控。总体分析表明,PR5Ks启动子区域顺式作用元件功能多样,类型丰富,说明PR5Ks 家族可能在小麦的生长发育中发挥重要作用。
基因的表达模式往往和功能密切相关,为了进一步分析PR5Ks 蛋白家族是否参与抗病防御反应,可以通过模拟接种病原菌时各基因表达量的变化趋势初步判断是否具有抗病功能。对51 个大豆Hsp20基因在生物胁迫下的表达分析,初步揭示了大豆Hsp20基因在抗逆反应中的作用[20];Chen等人通过对不同胁迫下的基因表达谱分析,筛选到GmPI-PLC7基因并证明该基因在抗干旱和盐胁迫中的作用,为GmPLC基因响应非生物胁迫的功能分析提供了新的思路[21]。在本研究中,通过模拟接种赤霉菌和条锈菌,筛选出4 个PR5K基因,TaPR5K-3、TaPR5K-5、TaPR5K-9、TaPR5K-11在赤霉菌和条锈菌诱导中均上调表达,初步认为4 个TaPR5K基因可能参与小麦抗病防御反应。
综上所述,小麦PR5Ks 蛋白家族共发现17 个成员,主要定位细胞核中,基因结构相对保守,启动子区域存在多个激素响应元件和逆境响应元件,TaPR5K-3、TaPR5K-5、TaPR5K-9、TaPR5K-11受赤霉菌、条锈菌和叶锈菌诱导表达。后续可以通过基因沉默等技术进一步验证4 个基因的功能,为进一步研究PR5Ks 在小麦抗病防御反应中功能提供参考。
