转录因子SlERF1a调控蜡质芽胞杆菌AR156诱导番茄对青枯病系统抗性作用机制研究
2022-11-21汤淑亚李子桀侯启华郭坚华蒋春号
汤淑亚,李子桀,侯启华,郭坚华,蒋春号
(南京农业大学生物农药与绿色植保实验室,江苏 南京 210095)
番茄青枯病是由茄科劳尔氏菌(Ralstoniasolanacearum)引起的一种细菌性土传病害,该病害发生后难以控制,造成番茄大面积枯萎死亡,严重制约番茄生产的果实产量和品质[1-2]。目前传统防治措施效果不稳定、易污染环境、防效不理想等问题突出[3]。生物防治因其环保、经济、安全等优点,受到生产者和研发者的青睐,在农业生产中得到了广泛使用。据报道,青枯病的生物防治措施主要包括植物源活性物质和微生物菌剂的利用。其中已报道的微生物菌剂主要有无致病力青枯菌(R.solanacearum)、假单胞菌属(Pseudomonassp.)和芽胞杆菌属(Bacillussp.)细菌[4-6]。其中芽胞杆菌因其对环境友好、定殖能力强、贮藏期长等特质成为农业生产中应用最多的生防细菌之一,因此,深入解析芽胞杆菌防治青枯病的作用机制对青枯病生物防治技术的广泛应用具有深远意义。研究表明,芽胞杆菌可通过产生抗菌蛋白、抗生素等拮抗物质,与青枯菌竞争碳水化合物、无机盐等营养物质,或通过诱导番茄产生系统抗性来防治青枯病[7-9]。
植物系统获得性抗性(systemic acquire resistance,SAR)与诱导系统抗性(induced systemic resistance,ISR)是植物体内2种不同的诱导抗性,前者由植物病原菌诱导获得,后者由非致病根际促生菌(plant growth promoting rhizobacteria,PGPR)诱导产生[10]。植物系统抗性的产生是由于PGPR的刺激激活了植物防卫反应,并通过某种途径将这一反应扩散到植物体其他部位,从而抵御病原菌侵染[11]。研究发现如果植物预先与枯草芽胞杆菌(B.subtilis)、蜡质芽胞杆菌(B.cereus)等根际促生菌接触,则可诱导植物ISR的产生,从而抵御青枯病、根结线虫病、晚疫病等病害的侵染[12]。乙烯是ISR诱导系统中的重要信号分子。Knoester等[13]发现乙烯信号突变型植株失去了被荧光假单胞杆菌(P.fluorescens)诱导系统抗性的能力,证明ISR机制的建立与乙烯信号通路密切相关。乙烯响应因子(ethylene responsive factor,ERF)是AP2/ERF超家族蛋白,研究表明ERF转录因子可调控乙烯反应基因表达,从而调节乙烯的生物合成和信号传导[14]。但ERF转录因子是否参与芽胞杆菌诱导的ISR尚不清楚。
蜡质芽胞杆菌AR156是本课题组前期从森林树木根围土壤中分离的一株植物根际促生细菌(PGPR)。菌株AR156通过诱发植物自身的抗病潜能增强植物的抗病性,从而高效防治多种病害[15]。前期通过对蜡质芽胞杆菌AR156防治植物病害的机制进行系统性研究,发现AR156关键作用机制是诱导植物产生系统抗病性。贺蝉等[16]研究表明菌株AR156激活MAPK通路诱导拟南芥对丁香假单胞菌番茄致病变种(Pseudomonassyringaepv.tomatoDC3000,PstDC3000)产生系统抗性;Jiang等[17]研究表明菌株AR156通过抑制miR472和激活CNLs介导的拟南芥基础免疫,从而触发对PstDC3000的系统抗性。本课题组前期研究发现菌株AR156可诱导番茄系统抗性,抵御番茄青枯病、根结线虫病等病害的侵染,但其诱导番茄产生对青枯病的抗性机制仍有待研究。
本研究通过转录组学分析技术,对调控AR156诱导番茄对青枯菌系统抗性的关键基因进行挖掘,并对鉴定出的关键转录因子ERF1a的生物学功能及生化功能进行研究,为蜡质芽胞杆菌AR156防治青枯病的生防机制研究奠定基础。
1 材料与方法
1.1 植物及微生物材料
番茄种子经表面消毒、催芽后播种于穴盘中,待番茄苗生长至四真叶期进行移栽,每个盆钵种植1株,移栽后7 d左右进行试验处理。培养条件:25 ℃,光周期为长日照(光照/黑暗培养时间16 h/8 h)。
试验菌株及质粒见表1。生防菌蜡质芽胞杆菌AR156在LB液体培养基(1 L配方:酵母浸粉5 g,胰蛋白胨10 g,NaCl 10 g,pH7.2)中37 ℃、250 r·min-1培养24 h,所得菌液于4 ℃、6 000 r·min-1离心10 min,用水调至5×108CFU·mL-1,备用。青枯菌GMI1000在YGPA液体培养基[1 L配方:酵母浸粉5 g,蛋白胨5 g,葡萄糖10 g,pH(7.0~7.2)]中28 ℃、250 r·min-1培养24 h,所得菌液于4 ℃、6 000 r·min-1离心 10 min,用水调至5×107CFU·mL-1,备用。

表1 试验菌株及质粒Table 1 Strains and plasmids used in the study
1.2 番茄植株生物量的测定
选取移栽后长势一致的植株,分别向每盆番茄根部灌入25 mL AR156菌液,对照组以等体积的清水代替,每个处理24株,3次生物学重复。处理14 d后,用卷尺、游标卡尺以及天平测量番茄株高、茎粗、地上部鲜重。
1.3 VIGS(virus-induced gene silencing)沉默接种及沉默效率检测
利用https://vigs.solgenomics.net/网站进行SlERF1a基因VIGS沉默片段的筛选与引物设计,引物见表2。以番茄cDNA为模板,利用引物ERF1a-VIGS-F/R进行扩增,扩增后的片段经过XbaⅠ、BamHⅠ双酶切后连接到pTRV2载体上,构建重组质粒pTRV2-SlERF1a。利用电转化的方法,将阴性对照pTRV2、阳性对照pTRV2-SlPDS1以及pTRV2-SlERF1a质粒转入根癌农杆菌GV3101中,利用筛选培养基及菌落PCR技术筛选阳性转化子,使用甘油保存法将阳性转化子保存于-80 ℃。
根癌农杆菌菌株pTRV1、pTRV2、pTRV2-SlERF1a、pTRV2-SlPDS1在LB液体培养基(50 μg·ml-1Km,25 μg·mL-1Rif)中,28 ℃、200 r·min-1培养16 h。离心收集菌体,用悬浮液(10 mmol·L-1MgCl2,10 mmol·L-1MES,150 μmol·L-1AS)调整浓度为2×109CFU·mL-1。然后将重悬液pTRV1分别与pTRV2、pTRV2-SlPDS1、pTRV2-SlERF1a的重悬液按1∶1体积比混合均匀,混合后的菌液在常温静置3 h或28 ℃、200 r·min-1振荡1 h。
用针头在番茄子叶背面扎几个小孔,用1 mL注射器将混合后的菌液沿着小孔注射入番茄叶片。在阳性对照pTRV2-SlPDS1沉默植株出现白化表型后(注射后15 d左右),每个处理取3个重复,分别提取RNA并进行反转录,得到的cDNA片段以Actin作为内参基因,采用半定量RT-PCR鉴定沉默植株中ERF1a基因的表达。

表2 引物序列Table 2 Primers sequence
1.4 番茄青枯病温室防效试验
设置AR156处理组和清水对照组。选择移栽7 d后的番茄植株,每株灌入25 mL AR156菌液,以等体积的清水作为对照,每个处理24株,3次生物学重复。预处理5 d后,向处理组和对照组番茄根部灌入30 mL GMI1000青枯菌液,观察并统计各处理番茄的发病情况。
根据植株叶片萎蔫程度,将番茄青枯病病害[19]级别分为5级。0级:植株正常;1级:植株叶片萎蔫程度不超过25%;2级:植株叶片萎蔫程度超过25%且不超过50%;3级:植株叶片萎蔫程度超过50%且不超过75%;4级:植株叶片萎蔫程度超过75%。
发病率=发病株数/调查总株数×100%。
病情指数=∑(病级数×该病级植株数)/(最大病级数×植株总株数)×100%。
防治效果=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.5 RNA提取及RT-qPCR分析
按照AR156及清水预处理时间点或青枯菌GMI1000接种时间点,收集番茄叶片,置于液氮速冻,每个处理使用5株植物的叶片,3次生物学重复。利用TRIzol法提取叶片总RNA,使用琼脂糖凝胶电泳和Nano Drop2000分光光度计检测RNA质量,将合格的RNA样品送往华大基因公司进行转录组测序,通过生物信息学分析差异表达的基因。
将预处理0、3、5 d的番茄叶片总RNA使用HiScript®Ⅲ RT SuperMix for qPCR(+gDNA wiper)试剂盒反转录为cDNA后,以Actin作为内参基因,使用qPCR-SlERF1a-F/R、qPCR-SlPR1-F/R、qPCR-SlPIN2-F/R、qPCR-SlActin-F/R引物对(表2)和SYBR GREEN PCR Master Mix试剂盒进行RT-qPCR分析。反应体系:2×AceQ qPCR SYBR Green Master Mix 10.0 μL,50×ROX reference Dye Ⅱ 0.4 μL,前、后引物各0.4 μL,cDNA(1/10)2.0 μL,ddH2O补齐至20 μL。反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环。采用2-ΔΔCT方法计算SlERF1a、SlPR1、SlPIN2基因相对表达量。
1.6 亚细胞定位分析
利用pENTR Directional TOPO Cloning Kits User Manual与Gateway_LR_Clonase_II_Enzyme_Mix试剂盒构建重组质粒pEG104-SlERF1a-YFP,将测序正确的重组质粒和空载体质粒pEG104-EV-YFP转入农杆菌GV3101。利用农杆菌介导的瞬时表达系统,使用注射器将农杆菌菌液注入烟草叶片中,处理后的烟草黑暗培养48 h,取样制作玻片,使用蔡司(Zeiss LSM710)激光共聚焦显微镜观察SlERF1a亚细胞定位情况。具体参照张悦婧等[20]的方法进行烟草叶片瞬时表达。
1.7 转录激活活性检测
为了研究SlERF1a的转录激活活性并确定激活域,将SlERF1a基因分为2部分:ERF1aΔC、ERF1aΔN。利用同源重组酶将SlERF1a全长、ERF1aΔC、ERF1aΔN3个片段连接到pGBKT7酵母表达载体上,构建重组质粒pGBKT7-SlERF1a、pGBKT7-SlERF1aΔC、pGBKT7-SlERF1aΔN。将测序正确的重组质粒和空载体质粒pGBKT7转入酵母菌株AH109中,使用SD/-Trp缺陷培养基,在28 ℃培养箱内培养3 d。挑取酵母单菌落,用100 μL无菌水重悬,按照10-1、10-2、10-3浓度梯度进行稀释,取10 μL菌液点在SD-Trp与含有X-α-Gal的SD/-Trp/-Ade/-His培养基上,倒置培养3 d,拍照记录。
1.8 数据分析
使用GraphPad Prism 7.0进行单因素方差分析(ANOVA)评估2种以上处理的显著性,采用DPS 7.5软件进行统计学分析,计算标准差和标准误,并对所有数据进行t检验。

图1 AR156对番茄的促生作用Fig.1 The growth-promoting effect of AR156 on tomatoA. AR156或清水预处理5 d后,番茄生长表型对比。AR156处理:使用25 mL 5×108 CFU·mL-1AR156菌液灌根番茄;H2O处理:使用25 mL清水灌根番茄。B. AR156或清水预处理5 d后,番茄各项生长指标对比。图中不同小写字母表示在0.05水平差异显著。下同。A. Comparison of tomato growth phenotypes after pretreatment with AR156 or water for 5 days. AR156 treatment:25 mL of AR156 bacterial solution with a concentration of 5×108 CFU·mL-1 was used to irrigate tomato roots;H2O treatment:25 mL of water was used to irrigate tomato roots. B. Comparison of various growth indicators of tomato after pretreatment with AR156 or water for 5 days. Different lowercase letters in the figure indicate statistically significant differences at 0.05 level. The same as follows.
2 结果与分析
2.1 菌株AR156对番茄的促生抗病作用
由图1可见:与清水对照组相比,AR156处理组中番茄植株的株高、茎粗、地上部鲜重等生长指标均有不同程度的增加。AR156预处理对地上部鲜重的促进作用最为显著,与清水预处理相比,地上部鲜重增加29.21%,株高和茎粗分别增加21.25%和11.30%,表明AR156对番茄具有促生作用。
使用清水预处理5 d的番茄接种GMI1000,10 d后枝叶萎蔫明显,而用AR156预处理5 d,再接种GMI1000的植株大部分枝叶仍处于挺立状态(图2-A),发病率和病情指数与对照相比都显著降低,AR156防效约为56.33%(图2-B,表3)。前期研究表明,AR156可诱导番茄系统抗性,抵御PstDC300侵染[18]。为验证AR156可通过诱导番茄系统抗性防治青枯病,在AR156预处理0、3、5 d后,提取番茄叶片RNA,利用RT-qPCR检测番茄叶片中防御基因SlPR1和SlPIN2的表达量,发现在AR156预处理后,SlPR1、SlPIN2表达量均呈上升趋势,SlPR1基因表达量先上升后略下降,SlPIN2基因表达量先下降后上升(图2-C和D),说明AR156可调控防御基因的表达,诱导番茄产生对青枯病系统抗性,从而降低青枯病发病率。
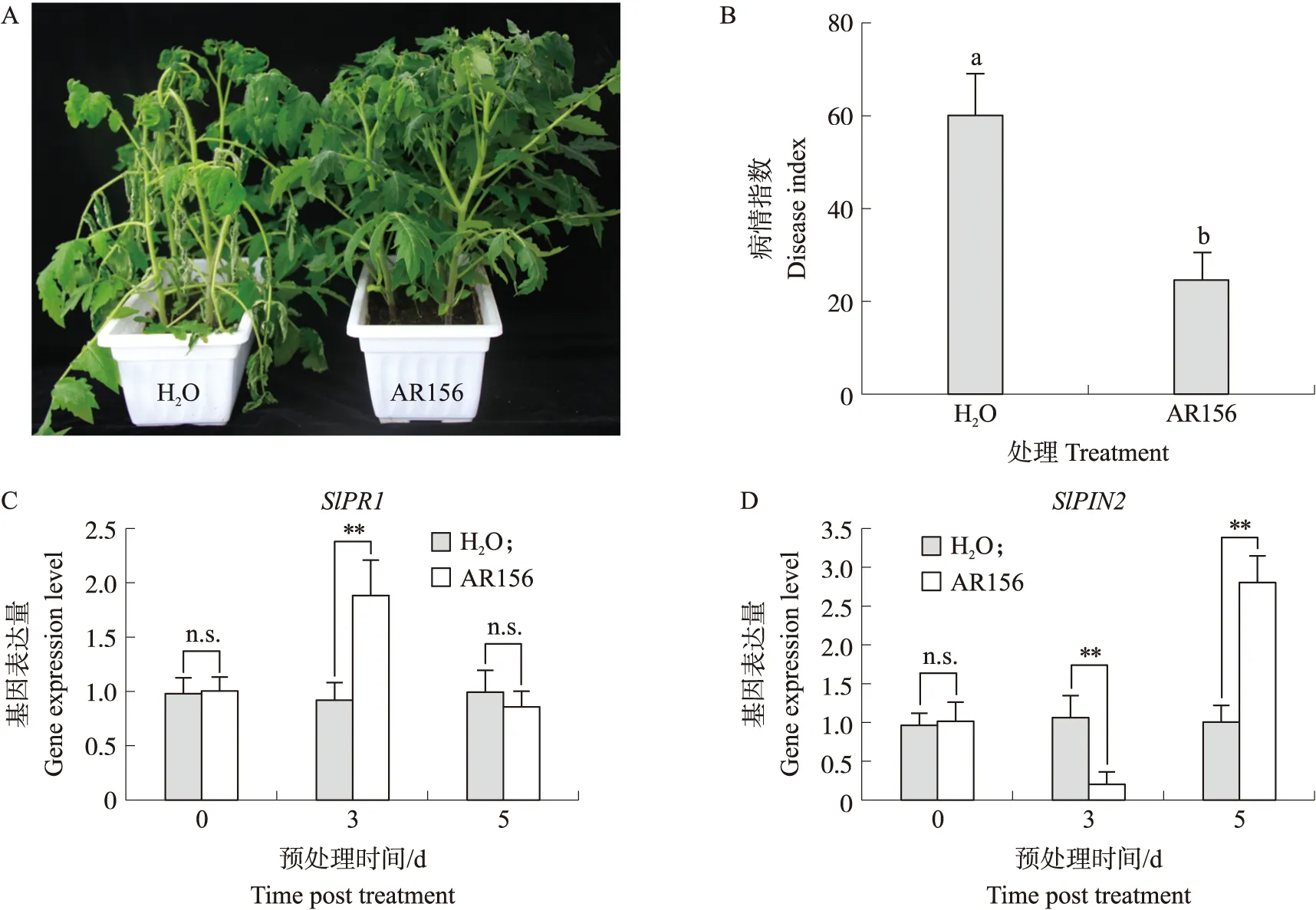
图2 AR156诱导番茄对青枯病的系统抗性Fig.2 AR156 induces systemic resistance to bacterial wilt in tomatoA. AR156或清水预处理5 d后,番茄对青枯病抗病性表型。B. AR156或清水预处理5 d后,青枯病在番茄上的病情指数。C、D. AR156或清水预处理0、3、5 d后,番茄叶片中SlPR1和SlPIN2基因表达量变化。列上方的双星号表示在0.01水平显著差异,不同小写字母表示在0.05水平差异显著,n.s.表示无显著差异。 下同。A. Phenotypes of tomato resistance to bacterial wilt after pretreatment with AR156 or water for 5 days. B. Disease index of bacterial wilt on tomato after pretreatment with AR156 or water for 5 days. C,D. Changes of SlPR1 and SlPIN2 genes expression in tomato leaves after AR156 or water pretreatment for 0,3 and 5 days. Double asterisks above columns indicate statistically significant differences at 0.01 level,different lowercase letters indicate statistically significant differences at 0.05 level,n.s. means no significant difference. The same as follows.
2.2 菌株AR156影响番茄基因表达

表3 在野生型(WT)番茄中,AR156对番茄青枯病的 防治效果
为探索AR156诱导番茄对青枯病的系统抗性机制,取清水和AR156预处理2、3 d后的番茄叶片进行转录组测序分析,筛选获得参与AR156诱导系统抗性相关基因。结果显示,AR156处理引起大量番茄植株基因表达水平变化(图3-A)。在预处理2 d后,与对照相比,AR156引起222个基因差异表达,其中有142个为上调基因,80个为下调基因;处理3 d后,有522个基因差异表达,其中上调基因503个,下调基因19个(图3-B)。韦恩图(图3-C)显示,有15个基因在2次处理中均差异表达,其中乙烯响应因子Solyc06g035700.1(SlERF1a),在AR156处理3 d后表达量显著上调。
为验证SlERF1a基因在AR156诱抗过程中的表达量变化,提取清水或AR156预处理3 d后的番茄叶片RNA,反转录为cDNA,使用适量cDNA进行RT-qPCR。结果(图4-A)显示,SlERF1a基因表达量在AR156预处理后显著升高,说明SlERF1a在AR156诱导系统抗性期间上调表达,有可能参与AR156诱导的ISR。此外,本研究发现在AR156预处理5 d后,在接种或未接种青枯菌GMI1000的番茄植株中,相较于清水对照,SlERF1a基因表达量均显著上升(图4-B),且接种GMI1000后,相较于未接种植株,SlERF1a基因表达量上调显著,因此猜想SlERF1a可能在蜡质芽胞杆菌AR156诱导番茄产生对青枯病系统抗性中发挥重要作用。

图3 蜡质芽胞杆菌AR156处理番茄后诱导相关基因差异性表达Fig.3 Differential expression of related genes induced by Bacillus cereus AR156 in tomatoAR156或清水预处理2、3 d后,番茄差异基因表达分析热图(A)、灿图(B)和韦恩图(C)。红色表示上调,蓝色表示下调。Heat map(A),volcano plot(B)and Venn diagram(C)of tomato differential gene expression analysis of tomato after pretreatment with AR156 or water for 2 and 3 days. Red means up-regulation,blue means down-regulation. dpi:Days post inoculation.
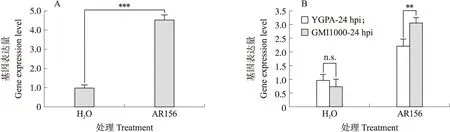
图4 AR156对SlERF1a基因表达量的影响Fig.4 Effects of AR156 on SlERF1a gene expression levelA. RT-qPCR检测AR156预处理3 d后的番茄植株内SlERF1a基因相对表达量。Detection of relative expression level of SlERF1a gene in tomato plants pretreated with AR156 for 3 days by RT-qPCR. B. AR156预处理5 d后的番茄植株,接种GMI1000 24 h后,检测SlERF1a基因相对表达量。Tomato plants were pretreated with AR156 for 5 days,then inoculated with GMI1000,and detected the relative expression level of SlERF1a gene 24 hours later.
2.3 SlERF1a参与调控AR156诱导的ISR
本研究成功构建了SlERF1a沉默植株(图5-A)。通过提取注射TRV2-SlERF1a菌株的番茄植株RNA,反转录后进行半定量PCR,发现与注射TRV2菌株的植株相比,该处理组植株SlERF1a的表达量明显下降(图5-B),说明SlERF1a已成功沉默,表明SlERF1a沉默植株可用于后续试验。
利用VIGS基因沉默技术将SlERF1a基因沉默后,沉默植株对青枯病的敏感性显著增强(图5-C,表4),说明SlERF1a正向调控番茄抗病性。为进一步验证SlERF1a转录因子在蜡质芽胞杆菌AR156诱导番茄产生对青枯病系统抗性中的作用,统计并分析SlERF1a沉默前、后青枯病发病率、病情指数以及AR156对番茄青枯病的防效。在基因沉默后,AR156处理组与对照组相比发病率没有显著差异,且防效下降,说明在SlERF1a沉默植株中AR156抗病性下降,表明SlERF1a正向调控AR156触发的系统抗性。同时,AR156在SlERF1a沉默后仍保留部分防效,说明生防菌诱抗机制是多样的,SlERF1a的表达上调只是AR156诱抗机制中的一种而非全部。综上,转录因子SlERF1a可参与调控AR156诱导番茄对青枯病系统抗性。
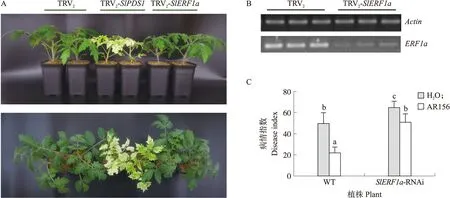
图5 SlERF1a基因沉默番茄植株构建与抗病性鉴定Fig.5 Construction and disease resistance identification of SlERF1a gene-silenced tomato plantsA. SlERF1a基因沉默植株表型The phenotype of SlERF1a-silenced plant;B. SlERF1a基因沉默植株验证Validation of SlERF1a-silenced plants;C. AR156或清水预处理5 d后,青枯病在野生型番茄(WT)、SlERF1a基因沉默番茄RSV上的病情指数The disease index of bacterial wilt in wild-type tomatoes(WT)and SlERF1a silent tomatoes RSV after AR156 or water pretreatment for 5 days.
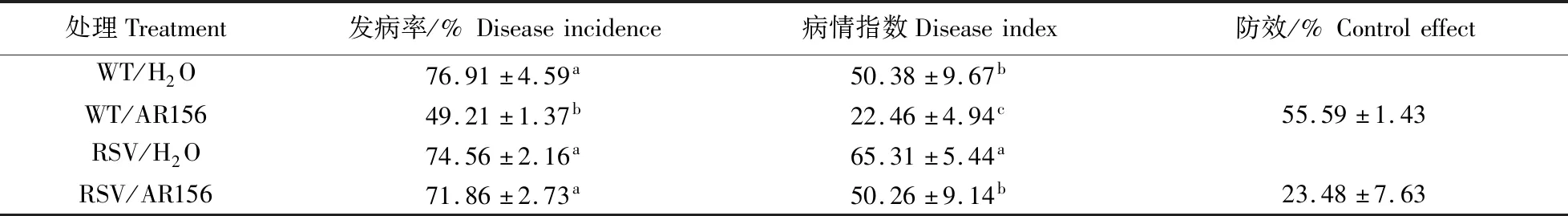
表4 在野生型番茄、SlERF1a基因沉默番茄(RSV)中AR156对番茄青枯病的防治效果Table 4 Control effect of AR156 on tomato bacterial wilt in WT tomatoes and SlERF1a silent tomatoes(RSV)

图6 SlERF1a蛋白的亚细胞定位(A)及转录调控活性分析(B)Fig.6 Subcellular localization(A)and transcriptional regulatory activity(B)of SlERF1a protein
2.4 SlERF1a定位于细胞核且具有转录激活活性
利用农杆菌介导的瞬时表达系统在烟草中表达SlERF1a,通过激光共聚焦显微镜观察SlERF1a的亚细胞定位,发现对照组荧光分布于整个叶片细胞,而pEG104-SlERF1a处理组荧光仅定位于细胞核中(图6-A),说明SlERF1a是一个核蛋白。此外,转入质粒pGBKT7-SlERF1a的酵母能够在SD/-Trp-His-Ade培养基上正常生长,且在含有X-α-Gal的SD/-Trp-His-Ade平板上变蓝(图6-B),说明SlERF1a转录因子具有转录激活活性。为进一步确定SlERF1a转录激活域,构建了pGBKT7-SlERF1aΔC、pGBKT7-SlERF1aΔN重组质粒,并转入酵母菌株中(图7-A)。所有的酵母细胞在SD/-Trp培养基上均可正常生长,但只有pGBKT7-SlERF1a和pGBKT7-SlERF1aΔN酵母菌可以在SD/-Trp-His-Ade培养基上正常生长,且在含有X-α-Gal的SD/-Trp-His-Ade平板上变蓝(图7-B)。表明SlERF1a的转录激活域位于C末端。

图7 SlERF1a蛋白转录激活结构域分析Fig.7 Analysis of the transcriptional activation domain of SlERF1a proteinA. 用于SlERF1a转录激活域分析的结构示意图。条形上方的数字表示氨基酸残基的位置。Schematic diagram of the structure used for SlERF1a transcriptional activation domain analysis. The numbers above the bars indicate the positions of amino acid residues.B. SlERF1a转录激活结构域检测。SlERF1a transcriptional activation domain detection.
3 讨论与结论
近年来,青枯病的生物防治在生防菌的开发、无致病力青枯病菌的筛选及转基因植物的构建等方面的研究取得较大进展[21]。其中,生防菌的合理利用是青枯病生物防治的重要内容,不仅达到防治病害的目的,而且增强植物对环境的适应性,促进植物生长。用于防治青枯病的生防菌包括芽胞杆菌属(Bacillussp.)、假单胞菌属(Pseudomonassp.)、链霉菌属(Streptomycessp.)等有益微生物,其生防机制主要有利用寄生、竞争、抗生、交叉保护等拮抗机制抑制青枯病菌生长,或者诱导植物对青枯病产生系统抗性,从而降低青枯病发病率[22]。目前,生防菌防治植物病害的机制各不相同。很多菌株防病的具体作用机制尚不明确,导致菌剂在进入实际生产后由于缺乏系统的理论依据,难以在田间发挥稳定效果[23]。因此,为进一步探索青枯病生防机制,本研究采用蜡质芽胞杆菌AR156为供试生防菌,验证得出AR156能促进番茄生长,并诱导番茄对青枯菌GMI1000产生系统抗性,从而抵御青枯病侵染。
根际促生菌(PGPR)是一类生存于植物根系、对植物兼具促生及抗病效果的生防菌。研究表明,PGPR可通过调节植物防卫机制来降低植物病害的发生,这种抗病性被称为诱导系统抗病性(ISR)[24]。近期研究表明,解淀粉芽胞杆菌(B.amyloliquefaciens)、枯草芽胞杆菌(B.subtilis)、蜡质芽胞杆菌(B.cereus)等均可诱导番茄ISR的产生,抵御青枯病侵染[9,12]。蜡质芽胞杆菌AR156是一种根际促生细菌,可以在拟南芥和番茄上诱导对PstDC3000的系统性抗性[12,18]。根际促生菌诱导的植物抗病机制非常复杂,不同的PGPR-寄主植物-病原菌组合,诱导植物系统抗性机制及其所依赖的信号转导途径也不同[25]。在以往研究中,大多数以模式植物拟南芥为植物材料研究AR156诱导抗病机制,对于AR156诱导番茄系统抗性机制尚不明确。因此,为明晰AR156诱导番茄产生系统抗性机制,本研究利用转录组测序对AR156预处理后番茄相关基因的转录水平变化进行分析,发现1个ERF家族的SlERF1a转录因子表达量显著上调,而在接种青枯菌GMI1000后,其表达量上调更显著,表明SlERF1a在AR156诱导系统抗性过程中被显著上调,说明SlERF1a极有可能参与AR156诱导番茄系统抗性过程。
AP2/ERF家族转录因子与植物抗病信号传导密切相关[26]。ERF亚家族转录因子ERF1[27]、ORA59[28]被证明均在茉莉酸(JA)和乙烯(ET)信号转导中发挥重要调控作用。荧光假单胞菌(P.fluorescens)WCS417r通过JA/ET信号通路并以NPR1依赖的方式在拟南芥中触发ISR[29],表明JA/ET信号通路在生防菌诱导的ISR中发挥着重要调节作用。Nie等[30]发现在乙烯、茉莉酸信号通路缺失突变体拟南芥中,AR156对PstDC3000的抗性下降,说明这2条信号通路的激发均能在一定程度上抑制病原菌在植物体内的增殖,共同调节AR156诱导的系统抗性。Jiang等[31]发现转录因子WRKY70和WRKY11可分别通过激活SA、JA/ET不同信号通路调控AR156诱导ISR从而减少病害发生。AR156在这2种转录因子WRKY11和WRKY70单突变体中抗病能力下降,能够保留部分防效,但在双突变体植株中则完全丧失防效,表明WRKY11和WRKY70在AR156诱导的ISR中发挥重要调控作用,且存在功能冗余。本研究发现,在SlERF1a沉默番茄中,AR156处理与清水对照组青枯病发病率没有显著差异,说明SlERF1a沉默后AR156对青枯病的抗病性显著下降,表明SlERF1a参与调控AR156触发的系统性抗性,揭示AR156可通过上调SlERF1a编码基因表达诱导番茄对青枯病的系统抗性机制。此外,SlERF1a作为ERF亚家族转录因子,有可能通过调节JA/ET信号传导从而调控AR156诱导的ISR。而在SlERF1a沉默后,AR156对青枯病仍具有显著防效,说明AR156诱导的ISR可能不完全依赖于SlERF1a。但我们也无法排除因VIGS沉默技术沉默基因不完全导致SlERF1a仍能发挥部分功能的可能性[32],因此后续可通过构建SlERF1a过表达植株对表型进一步验证。
前期研究表明,AP2/ERF家族转录因子可参与植物防御反应以应对各种环境胁迫和病原体,例如非生物胁迫(冷、热、干旱、盐度、渗透胁迫)和生物胁迫(草食性昆虫和微生物病原体)[33-34]。许多研究证明,过表达AP2/ERF家族转录因子的转基因植物可提高对非生物和生物胁迫的耐受性。在SlERF1a沉默番茄中,无论是否进行AR156处理,沉默植株的病情指数都显著高于野生型植株,说明ERF1a正向调控番茄对青枯病的抗性。先前的研究表明,在应对生物胁迫时,ERF转录因子可通过调控防御相关基因的表达[35]、激活靶基因诱导植物激素反应[36]、调控程序性细胞死亡[37]等途径参与植物防御反应。因此,为了进一步研究SlERF1a转录因子在调控植物抗性中的作用,本研究对ERF1a转录活性、亚细胞定位等生化功能进行初步分析,结果表明SlERF1a是具有转录激活活性的核蛋白,且转录激活域位于C端,说明其可能作为一个转录激活因子参与植物抗病过程,但对于其如何调控下游基因表达,是否参与调节JA/ET信号传导还需要进一步研究。
综上所述,本研究发现AR156诱导的番茄对青枯病系统抗性依赖于SlERF1a编码基因的上调表达,同时SlERF1a可作为转录因子正向调控植物的基础抗性。但SlERF1a在AR156诱导番茄对青枯病系统抗性过程中发挥的具体作用仍有待后续进一步系统研究。
