葡萄HB基因家族全基因组鉴定及表达分析
2022-11-21林艺灵刘众杰王子诚杨毓贤王令宇张川王晨贾海锋卢素文房经贵上官凌飞
林艺灵,刘众杰,王子诚,杨毓贤,王令宇,张川,王晨,贾海锋,卢素文,房经贵,上官凌飞
(南京农业大学园艺学院/江苏省果树品种改良与种苗繁育工程中心,江苏 南京 210095)
葡萄(Vitisvinifera)在生长发育的过程中容易受到生物及非生物胁迫的影响,导致其果实产量和品质下降。同源异型盒(homeobox,HB)基因家族在动植物发育中具有许多调节作用的转录因子,广泛存在于真核生物中。HB基因在植物组织器官发育、激素信号转导和逆境胁迫应答等生理过程中起重要作用[1]。因此,对葡萄HB基因的全基因组鉴定,并对其序列特征、进化特征和表达特性进行分析,有利于进一步研究HB基因的功能。
HB基因中有一段核苷酸序列较为保守,其编码的约60个氨基酸序列经折叠形成同源异型盒结构域(HD)[2]。HB基因首次在果蝇的同源突变体中被鉴定出,随后在人类和真菌中也被发现[3]。植物HB基因的研究起步较晚,1991年第1个植物HB基因在玉米中被克隆[4]。根据蛋白质序列进化分析,植物HB家族被分为14类:HD-ZIPⅠ、HD-ZIP Ⅱ、HD-ZIP Ⅲ、HD-ZIP Ⅳ、KNOX、BEL、PLINC、WOX、DDT、PHD、NDX、LD、PINTOX和SAWADEE,不同类别的成员具有不同结构和功能[4]。其中,HD-ZIPⅠ类成员参与光信号转导,调控植物某些发育过程及响应非生物胁迫[5-6]。HD-ZIP Ⅱ类成员诱导植物的避荫反应并增强细胞生长,HD-ZIP Ⅲ类成员影响侧器官极性发育和茎尖分生组织的形成,而HD-ZIP Ⅱ和HD-ZIP Ⅲ还能相互作用调节植物生长激素[7-9]。HD-ZIP Ⅳ成员会影响玉米的毛状体发育和花药形成[10]。PLINC蛋白在非生物胁迫响应中起到重要作用[11]。KNOX类成员影响茎尖分生组织的维持,并与BEL相互作用调节激素稳态[12-13]。WOX类成员能够促进根系伸长提高耐旱性,并植物胚胎发育中起到重要作用[14-15]。值得注意的是,葡萄WOX4能够在冬、夏芽形成以及茎、侧枝、花序和体细胞胚中发挥作用[16]。上述研究表明HB基因家族在植物生长发育过程中起到至关重要的作用。
目前,在植物基因组中许多HB基因的功能尚未明确。关于植物HB基因的研究主要集中在拟南芥和水稻上,虽然在葡萄中已有对HB基因家族的初步分析[17],但是关于进化和表达分析较少,HB基因家族作为非生物胁迫下作物改良的潜在候选者,在作物改良方面具有非常大的潜力。本研究使用生物信息学方法鉴定葡萄HB基因家族,并且系统分析了其蛋白理化性质、基因结构、染色体定位及进化表达特征,以及在不同芽休眠阶段、果实生长及非生物胁迫下的时空表达特异性。进一步分析HB基因可能存在的生物学功能,以期为HB基因不同成员在植物生长发育过程和逆境胁迫方面的功能鉴定提供依据。
1 材料与方法
1.1 材料
使用本实验室构建的‘阳光玫瑰’葡萄基因组数据(待发表),从TAIR(https://www.arabidopsis.org/)网站下载拟南芥(Arabidopsisthaliana)HB基因家族序列。
1.2 葡萄HB基因家族成员的鉴定
以拟南芥HB基因序列为靶序列,利用BLASTp检索出葡萄基因组中的HB候选序列,用隐马尔可夫模型(HMM)进一步证实葡萄HB基因结构域(PF00046、PF02183),E值为e-5[18]。检索后的序列利用CDD在线工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行检索,筛选保留具有HB相关结构域的序列,获得葡萄HB基因家族成员。将获得的VvHB基因家族蛋白序列提交至ExPASY(http://web.expasy. org/protparam/),预测其长度、相对分子质量、等电点。采用TargetP-2.0(https://services.healthtech.dtu.dk/service.php?TargetP-2.0)进行亚细胞定位。
1.3 葡萄HB基因在染色体上的分布
利用TBtools软件从葡萄基因组注释信息文件中提取HB基因家族位置信息[19],并用MG2C(http://mg2c.iask.in/mg2c_v2.1/)绘制染色体定位图[20]。
1.4 葡萄HB基因家族系统进化树构建
通过ClustalW对葡萄和拟南芥HB基因家族成员进行多序列比对,手动删除同源性差异较大的序列。利用MEGA X软件,以邻近法(Neighbour-joining,NJ)构建进化树,自展法系数(Bootstrap)设置为1 000[21]。
1.5 葡萄HB基因结构和所编码蛋白的保守结构域分析
葡萄HB基因家族内含子和外显子信息依据葡萄基因组注释信息文件GFF。采用MEME在线网站(https://meme-suite.org/meme/tools/meme)预测HB家族蛋白保守结构域,基序数量设置为15个,并利用TBtools软件进行可视化。
1.6 葡萄HB基因家族共线性和选择压力分析
使用MCScanX软件对葡萄HB家族及葡萄和拟南芥进行共线性预测,并将HB基因家族中具有显著共线性的成员标注出来。此外,利用TBtools软件对具有共线性的HB基因家族成员进行Ka/Ks(进化选择压力)计算。
1.7 葡萄HB基因家族启动子顺式作用元件以及蛋白互作网络预测分析
利用PlantCARE在线网站对葡萄HB基因家族ATG上游2 000 bp的启动子序列进行预测,并下载文件简化整理,进行可视化。
利用String(https://www.string-db.org/cgi/network)网站,以葡萄HB基因家族氨基酸序列为查询序列,设置置信度为0.700,构建蛋白质互作网络预测分析。
1.8 葡萄HB基因的表达特性分析
根据已有的葡萄转录组序列数据进行葡萄HB基因家族在不同条件下表达情况分析,具体数据包括芽休眠(登录号:SRP159132)、果实发育(GSE77218)、涝害胁迫(SRP070475)、干旱胁迫(SRP074162)、盐胁迫(SRP070475)和铜胁迫[22]。不同版本基因ID号利用BLAST软件比对后进行转换,根据ID号从转录组数据中提取HB基因在不同条件下的表达信息,使用TBtools绘制热图。
2 结果与分析
2.1 葡萄HB基因家族的鉴定及其所编码蛋白的理化性质分析
由表1可见:初步鉴定出葡萄中共80个HB基因家族成员,根据其在染色体上的分布,将其命名为VvHB1—VvHB80。葡萄HB基因家族成员的氨基酸数量和相对分子质量差异较大。氨基酸数量为66~1 772,其中蛋白长度最长的是VvHB47,最短的是VvHB37。相对分子质量为(8.28~198.55)×103,最大的是VvHB47,最小的是VvHB37。等电点(pI)为4.60~10.03,有80%的成员pI小于7.00,说明其可能是一类酸性蛋白。所有成员均无信号肽,说明其不属于分泌蛋白。将序列上传至TargetP-2.0网站,发现有11个成员(VvHB9、VvHB16、VvHB39、VvHB42、VvHB45、VvHB48、VvHB50、VvHB57、VvHB60、VvHB70、VvHB75)定位在叶绿体上,有5个成员(VvHB12、VvHB20、VvHB33、VvHB65、VvHB73)定位在线粒体上。
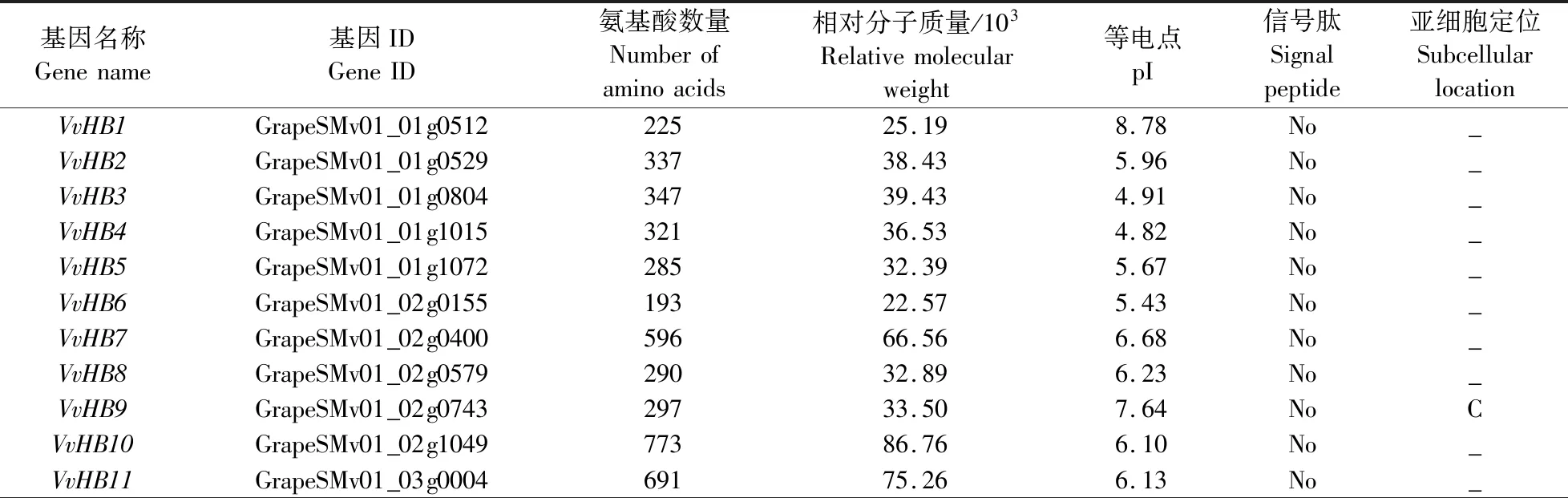
表1 葡萄HB基因家族蛋白理化性质分析Table 1 Physicochemical properties of HB gene family proteins in Vitis vinifera
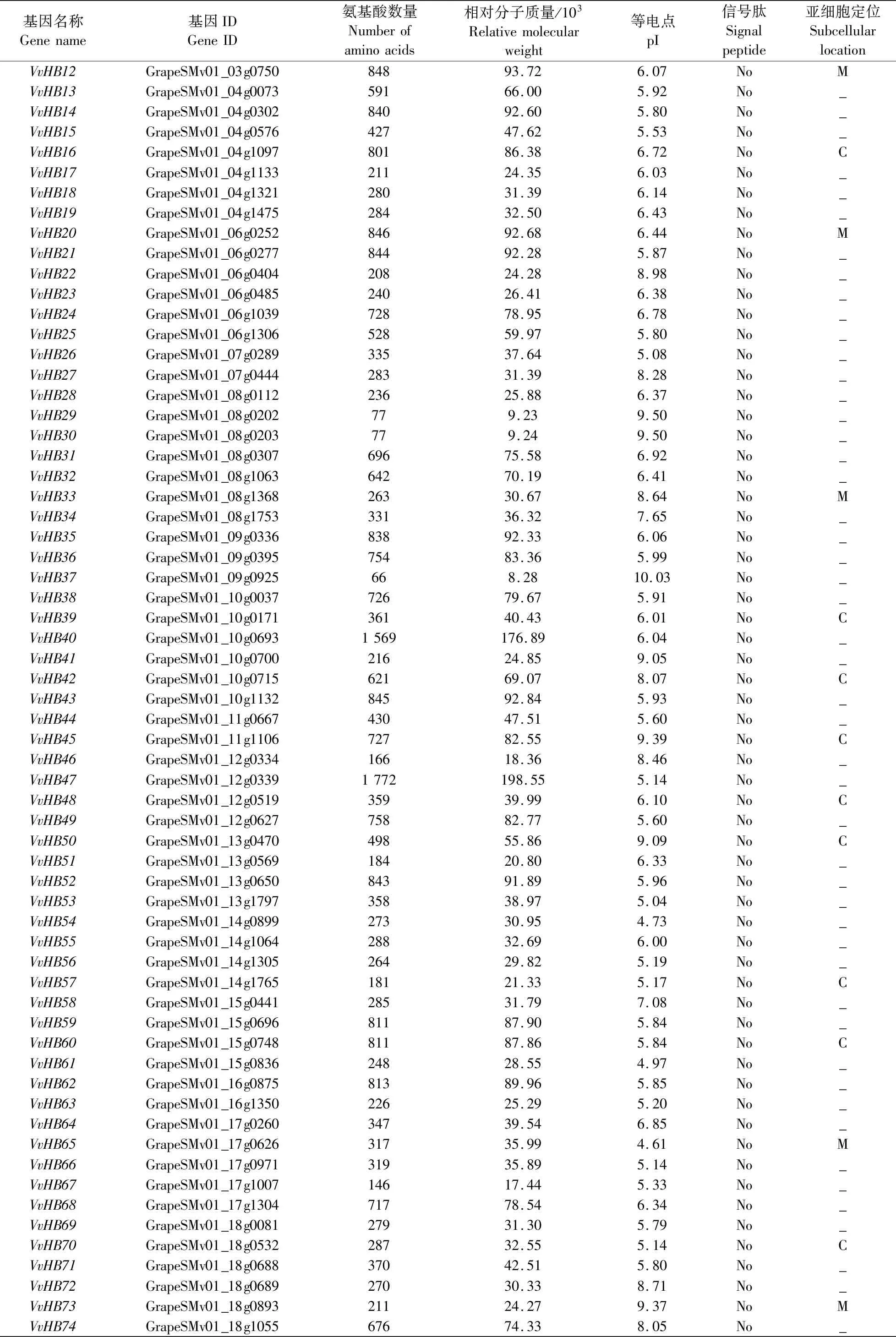
续表1 Table 1 continued
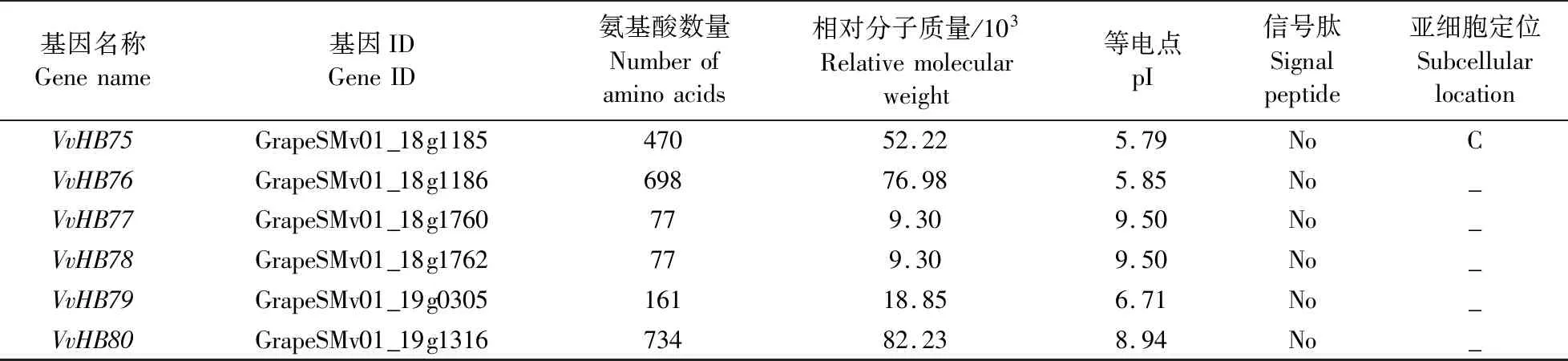
续表1 Table 1 continued
2.2 葡萄HB基因家族染色体定位分析
根据葡萄HB基因家族在染色体上的位置信息,80个基因家族成员共定位在18条染色体上(Chr01—Chr04,Chr06—Chr19)(图1)。其中18号染色体上分布的成员最多为10个,其余染色体上为2~7个成员。绝大部分成员分布在染色体的中上端或者下端。另外,8号染色体上的VvHB29和VvHB30这2个成员位置相近并且序列一致,推测是由于基因间的串联重复引起的。

图1 葡萄HB基因家族染色体定位分析Fig.1 Chromosome localization of HB gene family in V.vinifera
2.3 葡萄HB基因家族系统进化树分析
为了解葡萄和拟南芥HB基因家族间的进化关系,构建了拟南芥、葡萄HB基因家族系统进化树(图2)。参考拟南芥HB基因家族分类和葡萄HB基因家族自身蛋白结构域,将其分为9个亚家族。其中HD-ZIPⅠ、HD-ZIP Ⅳ包含葡萄HB基因家族成员最多,为15个,说明HD-ZIP是HB基因家族的主要类别。最少的为PHD亚家族,只有2个成员。HB基因家族成员数比较分析发现,HD-ZIPⅠ、HD-ZIP Ⅱ、HD-ZIP Ⅳ、BEL和KNOX亚家族数与拟南芥数相似,分别为15、7、15、12和9个;WOX亚家族数与拟南芥相比明显较少为11个。HD-ZIP Ⅲ、DDT、PHD亚家族数目与拟南芥一致,分别为5、4、2个,证明这几个亚家族在葡萄基因组中没有大范围变化。

图2 拟南芥和葡萄HB基因家族系统进化树Fig.2 Phylogenetic tree of HB gene families in Arabidopsis thaliana and V.viniferaHD-ZIPⅠ:调节子叶发育和蓝光信号传导;HD-ZIP Ⅱ:避荫反应、调节胚胎发育和分生组织功能;HD-ZIP Ⅳ:顶端分生组织的形成、调节花器官的正常发育;KNOX:分生组织的维持;BEL:调节激素稳态;PHD:调节非生物胁迫;HD-ZIP Ⅲ:叶片和胚胎的顶端分生组织形成;DDT:未知;WOX:早期胚胎分化、干细胞维持和器官形成。HD-ZIPⅠ:Regulation of cotyledon development and blue light signaling conduction;HD-ZIP Ⅱ:Shade avoidance response,regulation of embryo development and meristem function;HD-ZIP Ⅳ:Formation of apical meristem,regulation of normal development of floral organs;KNOX:Meristem maintenance;BEL:Regulation of hormone homeostasis;PHD:Regulation of abiotic stress;HD-ZIP Ⅲ:Apical meristem formation of leaf blade and embryo;DDT:Unknown;WOX:Early embryo differentiation,stem cell maintenance and organ formation.
2.4 葡萄HB基因结构和蛋白保守结构域分析
由图3可知:HB基因结构比较复杂,葡萄HB成员均包含外显子,数量为1~20个。每个葡萄HB成员都有CDS区域,但有21个成员不含有UTR区域。HD-ZIP Ⅱ家族的外显子数量为4~5个,且外显子和内含子的排列规律相同,为外显子—内含子—外显子,说明这个亚家族相对而言比较保守。此外,由于基因长度差异较大,不同分支的内含子和外显子的分布位置和数目差异也较大,推测其功能也会有所差别。
使用CDD对HB基因家族蛋白结构域进行预测,每个成员都包含HD结构域。80个成员含有30种结构域,除HD结构域外,同源异型盒相关亮氨酸(HALZ)结构域数量最多,其被认为是介导蛋白质与蛋白质相互作用的区域。KNOX结构域抑制靶基因表达,START结构域抑制细胞根毛形成。亮氨酸拉链(bZIP)结构域是包含介导序列特异性DNA结合的碱性区域和二聚化所需的亮氨酸拉链区域的蛋白质。bZIP转录因子能够调节病原体防御、光和胁迫信号以及种子成熟等过程。不同亚家族所包含的结构域不同,说明HB基因家族功能的多样性。

图3 葡萄HB基因结构及其所编码蛋白的保守结构域Fig.3 HB gene structure and the conserved domains of the encoded proteins in V.vinifera
2.5 葡萄HB基因家族共线性和选择压力分析
通过MCScanX分析葡萄HB基因家族的共线性关系,结果(表2和图4)表明葡萄HB基因家族存在 2对串联重复基因(VvHB29、VvHB30与VvHB75、VvHB76)和23对共线性基因。在拟南芥和葡萄间存在82对共线性关系。Ka/Ks表示2个蛋白编码基因的非同义替换率(Ka)和同义替换率(Ks)之间的比例,Ka/Ks反映物种进化的驱动力,在探究物种起源方面具有重要意义。当Ka/Ks>1,说明基因受正向选择(positive selection);当Ka/Ks=1,基因中性进化(neutral evolution),没有受到选择压力;当Ka/Ks<1,基因受纯化选择(purify selection)。Ka/Ks计算结果表明,Ka/Ks的值远小于1,说明其在进化过程中受纯化选择影响。
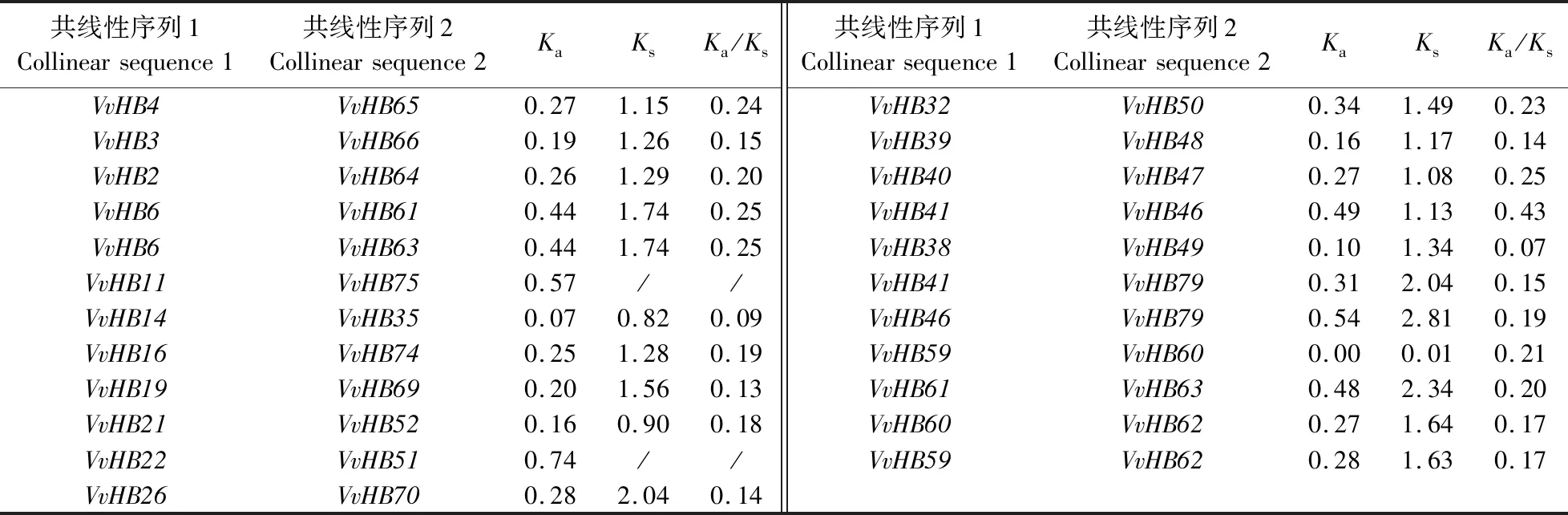
表2 葡萄HB基因家族共线性关系及非同义替换率(Ka)和同义替换率(Ks)Table 2 Collinearity of HB gene family and non-synonymous replacement rate(Ka)and synonymous replacement rate(Ks)in V.vinifera

图4 葡萄HB基因共线性分析Fig.4 Collinearity analysis of HB gene in V.viniferaChr01—Chr19表示19条葡萄染色体,At1—At5表示5条拟南芥染色体。Chr01-Chr19 represent 19 chromosomes in V.vinifera,and At1-At5 represent 5 chromosomes in A.thaliana.

图5 葡萄HB基因家族启动子顺式作用元件分布Fig.5 The cis-element distribution of HB gene family promoter in V.vinifera光响应元件:3-AF1 binding site、4cl-CMA2b、AAAC-motif、ACE、AE-box、AT1-motif、ATC-motif、ATCT-motif、Box 4、Box Ⅱ、CAG-motif、chs-CMA1a、chs-CMA2a、chs-CMA2c、chs-Unit 1 m1、G-Box、GA-motif、Gap-box、GATA-motif、GATT-motif、GT1-motif、GTGGC-motif、I-box、L-box、LAMP-element、sbp-CMA1c、LS7、Sp1、TCCC-motif、TCT-motif、MRE;植物激素响应元件:脱落酸响应元件(ABRE)、赤霉素响应元件(GARE-motif、P-box、TATC-box)、茉莉酸甲酯响应元件(CGTCA-motif、TGACG-motif)、水杨酸响应元件(TCA-element、SARE)、生长素响应元件(TGA-element、AuxRR-core、AuxRE);压力响应元件:低温响应元件(LTR)、干旱诱导的MYB结合位点(MBS)、生物胁迫响应元件(TC-rich repeats)、机械伤害响应元件(WUN-motif)、缺氧响应元件(ARE、GC-motif);不同组织部位响应元件:胚乳表达元件(GCN4_motif)、分生组织表达元件(CAT-box)、种子特异性调控(RY-element)、根特异性元件(motif I)。Light-responsive elements:3-AF1 binding site,4cl-CMA2b,AAAC-motif,ACE,AE-box,AT1-motif,ATC-motif,ATCT-motif,Box 4,Box Ⅱ,CAG-motif,chs-CMA1a,chs-CMA2a,chs-CMA2c,chs-Unit 1 m1,G-Box,GA-motif,Gap-box,GATA-motif,GATT-motif,GT1-motif,GTGGC-motif,I-box,L-box,LAMP-element,sbp-CMA1c,LS7,Sp1,TCCC-motif,TCT-motif,MRE;Plant hormone response elements:Abscisic acid response element(ABRE),gibberellin response element(GARE-motif,P-box,TATC-Box),methyl jasmonate response element(CGTCA-motif,TGACG-motif),salicylic acid response element(TCA-element,SARE),auxin response element(TGA-element,AUXRR-Core,AuxRE);Pressure response elements:Low temperature response element(LTR),drought-induced MYB binding site(MBS),biological stress response element(TC-rich repeats),mechanical damage response element(WUN-motif),hypoxia response element(ARE,GC-motif);Different tissue response elements:Endosperm expression element(GCN4_motif),meristem expression element(CAT-box),seed specific regulation(RY-Element),root specific element(motif I).
2.6 葡萄HB基因家族启动子顺式作用元件分析
为了进一步了解葡萄HB基因家族的功能,对葡萄HB基因家族上游2 000 bp的启动子序列进行顺式作用元件分析。将葡萄HB基因家族启动子主要的顺式作用元件分为光响应、激素响应、非生物和生物胁迫以及不同组织部位4大类(图5)。其中,所有的葡萄HB基因家族均包含大量光响应元件,说明HB基因家族可能参与光信号途径调控植物光形态建成。在启动子序列中都含有至少一个激素相关响应元件,如ABRE、P-box、CGTCA、SARE、TGA等,它们分别参与脱落酸(ABA)、赤霉素(GA)、茉莉酸甲酯(MeJA)、水杨酸(SA)和生长素(IAA)的应答,说明HB基因家族可能通过激素途径缓解逆境胁迫。除VvHB65外,其他成员均可参与非生物与生物胁迫响应。其中只有VvHB8、VvHB10含有创伤修复相关的元件,提示其可能在葡萄受到创伤时发挥作用。此外,有56%的成员含有胚乳发育、分生组织等不同组织部位的响应元件。说明葡萄HB基因家族成员广泛参与葡萄生长发育与逆境胁迫等多个过程。
2.7 葡萄HB家族蛋白互作网络预测分析
由图6可见:在80个成员中,有20个成员表现出高置信度(>0.700)。该网络由20个枢纽基因和 31个边构成。VvHB39能够与VvHB18、VvHB71、VvHB76、VvHB7、VvHB13、VvHB32及VvHB50发生互作,表明KNOX与WOX和BEL亚族有很强的互作关系。此外,STM和WUS互作调控拟南芥芽分生组织,提示属于KNOX亚家族的VvHB39、VvHB71能够与WOX亚家族的VvHB18发生互作影响葡萄芽的生长发育[23]。另外,KNOX与BEL亚家族成员间互作关系最为密切。

图6 葡萄HB蛋白互作网络预测Fig.6 Prediction of HB protein interaction network in V.vinifera
2.8 葡萄HB基因家族在芽休眠、果实发育过程中以及不同非生物胁迫下的表达分析
葡萄芽休眠转录组数据(SRP159132)分析发现,在80个葡萄HB基因中,有66个基因在芽休眠过程中差异表达。由图7可见:2个基因(VvHB31、VvHB64)在芽休眠期间显著表达,有超过半数的基因(44个)在3月或者4月表达量达到最高,13个基因在1、2月表达量最高,其余9个基因在11、12月表达量最高。近83%的HB基因在芽休眠过程中显著差异表达,并且绝大部分基因在3、4月表达量达到最高,提示HB基因家族在抗低温胁迫中发挥作用。
对葡萄果实发育不同阶段的数据(GSE77218)进行分析,结果(图7)表明:有23个基因(VvHB11、VvHB15、VvHB19、VvHB23、VvHB24、VvHB26、VvHB27、VvHB32、VvHB34、VvHB4、VvHB41、VvHB43、VvHB48、VvHB5、VvHB53、VvHB58、VvHB63、VvHB65、VvHB69、VvHB7、VvHB77、VvHB8、VvHB9)在果实膨大期显著表达,在转色和成熟期下调表达;4个基因(VvHB60、VvHB61、VvHB73、VvHB76)在果实膨大期下调表达,在转色和成熟时期显著表达;VvHB30、VvHB54在果实发育和成熟阶段下调表达,而在转色阶段上调表达。此外,有4个基因(VvHB5、VvHB26、VvHB58、VvHB60)在整个果实生长发育阶段都有差异表达,说明它们可能在果实成熟过程中具有多种作用。已有研究报道BEL、WOX亚家族中多个HB基因参与调节果实大小、发育和成熟[24],提示HB基因家族在葡萄发育成熟阶段可能发挥多种潜在作用。
由图7可见:在干旱胁迫下,80个HB基因家族成员中共发现64个差异表达基因,其中有37个成员上调表达,27个成员下调表达。在盐胁迫下,有5个基因成员差异表达,且全部上调表达。在涝害下,有29个基因成员差异表达,17个上调表达,12个下调表达。在铜胁迫下,有9个差异表达基因,其中5个上调表达,4个下调表达。总之,HB基因家族响应干旱胁迫的数量明显多于涝害胁迫、铜胁迫和盐胁迫。有32个成员仅在干旱胁迫下有差异表达,19个成员(VvHB27、VvHB2、VvHB7、VvHB12、VvHB15、VvHB16、VvHB23、VvHB20、VvHB24、VvHB36、VvHB40、VvHB42、VvHB45、VvHB47、VvHB50、VvHB52、VvHB53、VvHB69、VvHB80)上调表达,13个成员(VvHB13、VvHB17、VvHB18、VvHB21、VvHB33、VvHB77、VvHB59、VvHB64、VvHB68、VvHB70、VvHB72、VvHB74、VvHB75)下调表达。此外,VvHB9和VvHB34能够响应多种非生物胁迫。VvHB9在不同非生物胁迫下均上调表达,而VvHB34在盐胁迫、涝害胁迫和铜胁迫中上调表达,在干旱胁迫中下调表达。
3 讨论
HB基因家族广泛存在于植物中,参与植物各种发育过程、信号调控和逆境胁迫响应。目前,HB基因家族在许多植物中被鉴定,其中拟南芥110个、水稻107个、杨树148个、鹰嘴豆89个[25-26]。本研究从葡萄中鉴定出80个HB基因家族成员,相对于其他植物较少,说明葡萄HB可能在进化过程中发生了基因缺失,基因丢失可能是进化中强大的力量,表明单个同源盒基因的丢失与形态简化有关[27]。利用葡萄HB蛋白序列构建系统进化树,可将其分为9个亚族,与拟南芥相比缺少了PLINC、NDX、LD、PINTOX和 SAWADEE类成员。而其在水稻、油菜中也仅被分为10个和9个亚族,说明HB基因家族可能在不同物种的进化过程中出现基因分化,从而行使新的功能[26,28]。HB基因家族的蛋白大小为66~1 772个氨基酸,相对分子质量为(8.28~198.55)×103,等电点为4.60~10.03,说明其蛋白大小等特征差异较大,这与豆科植物中的研究结果类似[18]。80条葡萄HB成员不均匀分布在18条染色体上。内含子和外显子的缺失和获得会导致功能上的差异,有助于基因功能的多样化。通过基因结构分析发现,葡萄HB基因家族中有 68个成员的内含子少于10个,有12个成员超过10个。总体而言同一类中的内含子数目比较相似,表明它们中的大多数可能具有共同的进化起源。HD-ZIPⅠ类成员内含子为0~3个、HD-ZIP Ⅱ类成员内含子为2~3个,HD-ZIP Ⅲ类成员的内含子为17个,且明显多于HD-ZIPⅠ、HD-ZIP Ⅱ、HD-ZIP Ⅳ类成员,这与桃中HD-ZIP家族的规律相似,说明其比较保守[29]。BEL、KNOX类内含子为3~5个,WOX、DDT、PHD、HD-ZIP Ⅳ类内含子数量不均。对葡萄HB的重复事件预测分析发现,葡萄HB基因家族存在2对串联重复基因和23对片段重复基因,说明HB基因家族成员的扩增主要以片段重复为主。葡萄和拟南芥的共线性分析结果显示,拟南芥和葡萄存在82对共线性基因对,推测具有共线性关系的成员间具有相似的功能。
研究表明,HB基因家族参与植物多种生长发育过程。WOX13影响拟南芥果实发育,LeHB-1与番茄果实的发育和成熟有关,HD-ZIP Ⅱ转录因子调控桃乙烯生物合成[30-31]。WOX类成员Vv19、Vv69等68个HB基因在葡萄果实发育中表达差异显著,也说明HB基因家族在葡萄果实发育成熟期具有显著作用。对葡萄HB家族启动子上游序列进行分析,发现其广泛存在激素响应和非生物胁迫响应的元件。在涝害胁迫下基因表达量高的往往包含多种激素相应元件。ATHB2可以增加ABA的敏感性,ATHB6是ABA信号通路的负调节因子,VvHB9、VvHB4分别与ATHB2、ATHB6亲缘关系最近,推测其能够通过调节ABA信号通路来响应逆境胁迫[32-33]。37个含有LTR响应元件的HB基因家族成员在芽休眠的不同阶段差异表达,推测其可能在芽休眠过程中起调控作用,但具体调控机制还有待进一步研究。越来越多的证据表明 HD-ZIP 家族蛋白在非生物胁迫下发挥作用。例如,辣椒HD-ZIP蛋白在盐胁迫下表达显著增强,GhHB1 参与盐胁迫应答,过表达OsBIHD1 增强烟草对盐胁迫的耐受性[34-36]。盐胁迫下,葡萄HB基因家族上调表达的成员均为HD-ZIP家族蛋白,并且在干旱胁迫、铜胁迫和涝害胁迫中也有许多HD-ZIP家族蛋白上调表达。此外,属于HD-ZIP Ⅱ亚族的VvHB9和VvHB34能够响应多种非生物胁迫,表明这些HD-ZIP家族成员在葡萄非生物胁迫下发挥重要作用。总之,HB基因已经被认为是植物发育关键调控因子,其在许多植物发育的不同阶段的特定胁迫反应中发挥重要作用。
通过分析葡萄HB基因在芽休眠、果实发育成熟过程和不同非生物胁迫下的表达情况,发现一些较为重要的基因。有9个基因仅在芽休眠阶段显著差异表达,在果实发育和不同非生物胁迫下均无差异表达。PpHB22可以激活PpDAM1以调节‘Suli’梨的芽休眠转变[37],HB21、HB40和HB53可以增强NCED3表达,从而抑制芽发育[38]。说明这些HB基因可能在葡萄芽休眠过程中发挥作用。值得注意的是,其中有7个基因(VvHB3、VvHB22、VvHB28、VvHB39、VvHB51、VvHB66、VvHB71)是KNOX和WOX亚家族的成员,暗示它们能够发生互作调控葡萄芽休眠过程,这与拟南芥中STM和WUS互作调控茎尖分生组织的结果相似[23]。但是关于HB基因家族成员在非生物胁迫下的耐受机制以及KNOX和WOX亚家族成员的互作如何调控葡萄芽休眠,还有待进一步研究。
致谢:本研究得到南京农业大学生物信息中心高性能计算平台的支持,在此表示感谢!
