PARP抑制剂奥拉帕利的合成及晶型A的制备
2022-11-21李宏名胡瑞馨张祥阳郑维江
李宏名,胡瑞馨,张祥阳,郑维江,张 娇
(1.新乡医学院,河南 新乡 453003;2.四川农业大学 园艺学院,四川 成都 611130;3.国药集团川抗制药有限公司,四川 成都 611731;4.四川科伦药物研究院有限公司,四川 成都 611138)
奥拉帕利[1](Olaparib,AZD2281,1),商品名:利普卓[2](Lynpara),化学名:4-(3-{[4-(环丙基羰基)哌嗪-1-基]羰基}4-氟苯基)甲基]酞嗪-1(2H)-酮,2014年12月在欧洲和美国上市,2018年8月进入我国,被纳入2019医保目录.奥拉帕利是阿斯利康公司开发上市的全球首款口服小分子聚腺苷二磷酸核糖聚合酶(PARP)抑制剂,用于BRCA突变晚期卵巢癌患者的一线维持治疗,及铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗.近年来奥拉帕利对卵巢癌、乳腺癌、前列腺癌、胰腺癌、小细胞肺癌、胃癌、喉鳞状细胞癌和鼻咽癌等多种疾病均有一定的临床靶向治疗作用,有成为广谱抗癌药的潜质.[3-7]
目前文献报道[8-14]的奥拉帕利的合成路线主要分为三种:路线一[11],以2-氟-5-[(4-氧代-3,4-二氢酞嗪-1-基)甲基]苯甲酸为原料,与N-Boc哌嗪酰胺化,脱Boc后进行N-环丙基甲酰化反应得到目标产物.路线二[12,13],以2-氟-5-[(4-氧代-3,4-二氢酞嗪-1-基)甲基]苯甲酸为原料,在CDI作用下直接与N-环丙甲酰基哌嗪反应或者将羧酸转化为酰氯,再与N-环丙甲酰基哌嗪缩合得到目标产物;路线三[14],以4-(3-溴-4-氟苄基)-2H-酞嗪-1-酮为原料,与N-环丙甲酰基哌嗪及CO反应得到目标产物.路线二的优点是合成路线短、工业成本低,缺点是N-环丙甲酰基哌嗪中容易残留哌嗪导致目标产物中容易产生一分子哌嗪与两分子2-氟-5-[(4-氧代-3,4-二氢酞嗪-1-基)甲基]苯甲酸缩合形成的二聚体杂质,多次试验发现此二聚体杂质极难去除,不利于产品质量的控制.路线三使用了毒性较大的CO作为羰基源以及昂贵的钯催化剂,不适合大规模工业生产.路线一操作简单,反应条件温和,产品质量易于控制,容易实现工业化生产.
本文在路线一的基础上,参考文献[15]的方法,以2-氟-5-[(4-氧代-3,4-二氢酞嗪-1-基)甲基]苯甲酸为原料,在HBTU作用下与N-叔丁氧羰基(Boc)哌嗪发生酰胺化反应,在酸性条件下脱Boc,在HBTU作用下与环丙基甲酸进行缩合,经三步反应得到奥拉帕利粗品.奥拉帕利粗品经乙醇水溶液处理得到奥拉帕利晶型A.本文优化了前两步的反应条件和后处理方式,并将第三步的酰氯与有机胺的缩合改为羧酸在HBTU下与有机胺缩合,反应条件更温和、副产物更少.路线总收率由文献的38%提高到51%.
本路线反应条件温和,操作简便,对环境友好,适宜工业化生产.合成路线见图1.
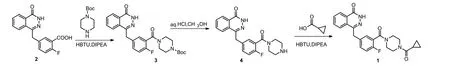
图1 奥拉帕利的合成路线
1 仪器和试剂
AV ANCE 400型核磁共振仪(德国Bruker公司),Autospec Premier 776磁质谱仪(美国Waters公司),1100型液相色谱仪(美国安捷伦公司),YRT-3药物熔点仪(上海华岩仪器设备有限公司),X'Pert3 Power X射线粉末衍射仪(荷兰PANalytical公司),DSC2500差示扫描量热仪(美国TA公司),TGA1热重分析仪(美国METTLER TOLEDO公司).所有溶剂、试剂均为化学纯.
2 实验部分
2.1 4-[2-氟-5-(4-氧代-3,4-二氢酞嗪-1-基)甲基)苯甲酰基]哌嗪-1-甲酸叔丁酯(3)的合成
2-氟-5-[(4-氧代-3,4-二氢酞嗪-1-基)甲基]苯甲酸(2,29.83 g,100 mmol)、N-Boc哌嗪(20.49 g,110 mmol)、O-苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU,43.61 g,115 mmol)搅拌下溶解于N,N-二甲基乙酰胺(DMA,150 mL)中.保持内温20~25℃,历经2 h滴入N,N-二异丙基乙胺(DIPEA,35 mL,200 mmol),滴毕继续搅拌2 h.缓慢滴加纯化水(800 mL)析晶,20~25℃养晶2 h后过滤,滤饼用无水乙醇(100 mL)于75℃打浆后干燥,得浅黄色固体4(38.81 g,83.2%).纯度99.67%[HPLC归一化法:检测方法同1].1H NMR(400 Hz,DMSO-d6)δ:12.62(s,1H),8.26(dd,J1=1.2 HZ,J2=7.8 HZ,1H),7.97(d,J=7.8 HZ,1H),7.89(dt,J1=1.5 HZ,J2=7.5 HZ,1H),7.84(dt,J1=1.2 HZ,J2=7.5 HZ,1H),7.45(m,1H),7.36(dd,J1=2.1 HZ,J2=6.5 HZ,1H),7.24(t,J=9.0 HZ,1H),4.34(s,2H),3.60(br,2H),3.39(br,2H),3.23(br,2H),3.15(br,2H),1.41(s,9H);13C NMR(100Hz,DMSO-d6)δ:164.5,159.9,158.1,155.6,154.2,145.3,135.3(J=3 Hz),134.0,132.2(J=8 HZ),132.0,129.6,129.4(J=4 HZ),128.4,126.6,1260,124.1(J=17 HZ),116.4(J=22 HZ),79.7,46.8,41.7,36.9,28.5.
2.2 4-[3-(哌嗪-1-羰基)苄基]-2H-酞嗪-1-酮(4)的合成
甲醇(37 mL)、浓盐酸(75 mL,900 mmol)搅拌下分批加入3(37.32 g,80 mmol).维持内温20~25℃反应4 h后减压蒸除溶剂,剩余物中加入纯化水(280 mL),先用二氯甲烷(110 mL×3)洗涤,再用浓氨水调节pH=8~9.二氯甲烷(110 mL×2)萃取,合并有机相,减压蒸除溶剂后加入甲基叔丁基甲醚(75 mL)析晶,过滤,干燥,得浅黄色固体4(26.76 g,79.6%).纯度99.76%[HPLC归一化法:检测方法同1].1H NMR(400 Hz,CDCl3)δ:8.36-8.38(m,1H),7.62-7.68(m,3H),7.25-7.27(m,1H),7.19-7.23(m,1H),6.92(t,J=8.8 Hz,1H),4.21(S,2H),3.71(br,2H),3.35(S,1H),3.22(br,2H),2.89(t,J=5.0 HZ,2H),2.75(br,2H);13C NMR(100 Hz,DMSO-d6)δ:165.0,161.1,158.2,155.7,145.6,134.3(J=3 Hz),133.6,131.5,131.3(J=8 Hz),129.5,129.1(J=3 Hz),127.6(J=119 Hz),125.1,124.0(J=19 Hz),116.0(J=21 Hz),50.4,48.0,45.7(J=50 Hz),42.8,37.7.
2.3 奥拉帕利(1)粗品的合成
4(25.23 g,60 mmol)、HBTU(26.17 g,69 mmol)、环丙基甲酸(6.68 g,75 mmol)搅拌溶解于DMAC(125 mL)中,保持内温20~25℃,历经2 h滴入DIPEA(21 mL,120 mmol),滴毕继续搅拌2 h.缓慢滴加纯化水(400 mL)析晶,20~25℃养晶2 h后过滤,滤饼用无水乙醇(20 mL)洗涤,得类白色粗品(24.35 g,81.4%).
2.4 奥拉帕利晶型A的制备
粗品(24.35 g)中加入50、乙醇水溶液(120 mL,v%),加热回流溶解,滤液保持80℃缓慢滴加纯化水(180 mL),滴毕升温至90℃蒸馏乙醇,然后降温至20℃.过滤,干燥,得白色固体1(20.06 g,77.0%).熔点201.6~211.4℃(文献值210.1℃);纯度99.9%[HPLC归一化法:色谱柱YMC-Pack pro C18 AS柱(150 mm×4.6 mm,3 μm);流动相 流动相A:0.05 mol/L的磷酸二氢钾-甲醇-乙腈(90∶5∶5),流动相B:甲醇-乙腈-水(45∶45∶10);梯度洗脱(0~25 min:95%→80%A;25~62 min:80%→30%A;62~63 min:30→95%A;63~70 min:95%A);检测波长210 nm;柱温30℃;流速0.8 mL/min].元素分析(C24H23FN4O3)测定值(计算值,%):C 66.35(66.30),H 5.34(5.34),N 12.90(12.86);HREI MS(m/z)C24H23FN4O3测定值(计算值):434.1760(434.1754);1H NMR(400 Hz,DMSO-d6)δ:12.63(s,1H),8.27(dd,J1=7.8 Hz,J2=0.9 Hz,1H),7.96(d,J=7.8 Hz,1H),7.90(d,J=7.3 Hz,1H),7.82(dt,J1=7.4 Hz,J2=0.9 Hz,1H),7.44-7.48(m,1H),7.39(br,1H),7.25(5,J=9.0 Hz,1H),4.35(s,2H),3.41-3.76(m,6H),3.19(d,J=26.0 Hz,2H),1.96(d,J=38.4 Hz,1H),0.72-0.78(m,4H);13C NMR(100 Hz,DMSO-d6)δ:171.8,164.5,159.9,158.1,155.6,145.3,135.3(J=3 Hz),134.0,132.2(J=8 Hz),132.1,129.6,129.4(J=3 Hz),128.4,126.6,125.9,124.0(J=18 Hz),116.4(J=22 Hz),47.0(J=47 Hz),45,2(J=43 Hz),42.2,41.6(J=13 Hz),36.9,10.8,7.7.
2.5 奥拉帕利晶型A的表征
X射线粉末衍射(XRPD),Cu Kα石墨单色器,射线管工作电压40 kV,工作电流40 mA,扫描范围3.5~40.0 °,步长0.0131 °,透射式连续扫描方式扫描,XRPD结果如图2所示,与文献晶型A一致.[15]差示扫描量热法(DSC),精密称取3~5 mg样品,均匀铺于铝坩埚中,加盖,以空坩埚作空白对照,在氮气保护下升温扫描,温度范围35~200℃,升温速率10℃·min-1.热重分析法(TGA),精密称取上述3~5 mg样品,均匀铺于瓷坩埚中,以空坩埚作空白对照,在氮气保护下升温检测,温度范围35~500℃,升温速率10℃·min-1.DSC和TGA结果如图3所示.DSC熔点峰212℃,TGA显示250℃以前无失重,与文献晶型A一致.

图2 奥拉帕利的XRPD

图3 奥拉帕利的DSC/TGA图谱
3 讨论
3.1 化合物3的制备工艺优化
反应条件优化 取消了氮气保护,简化了操作;降低了反应试剂用量比:N-boc哌嗪(1.2→1.1 eq),DIPEA(2.2→2.0 eq),HBTU(1.3→1.15 eq),DMA(5.9→5.0 v/w);文献采用滴加N-Boc哌嗪溶解于DMA的溶液的方式控制反应速度,因溶解化合物2需要大量的DMA,溶解N-Boc哌嗪仅需少量DMA,文献方法滴加N-Boc哌嗪的DMA溶液,操作困难,反应速度较难控制,副产物较多.本文优化为采用滴加DIPEA的方式控制反应速度,很好地控制了反应过程.
后处理优化 文献采用将反应液加入到水中的方式析出固体,水是产物的反溶剂,因而容易产生暴析现象包裹杂质.本文优化为向反应液中缓慢滴加水析晶,很好地控制了析晶过程.后处理由三种溶剂室温打浆优化为一种溶剂高温打浆.收率从78%提高到83%,纯度从85%提高到99.67%.
3.2 晶型A的制备工艺优化
药物不同晶型的分子结构不同,因而具有不同的物理化学性质.[16]奥拉帕利有多晶型现象,文献报道奥拉帕利有无水晶型A[15]、无水晶型L[17]、水合物晶型H[18]、多种溶剂合物.[15]
参考文献[15]的方法,采用乙醇水溶液重结晶奥拉帕利,常常得到晶型L或晶型A与晶型L的混晶,与文献报道的可由晶型A在有机溶剂中浆化制备晶型L的现象一致[17],推测可能是溶剂介导转晶:结晶过程中有溶剂合物生成,溶剂合物再转晶为晶型L.因此,本文采用高温滴加反溶剂的方式结晶,避免了低温生成溶剂合物再转晶为晶型L的风险.工艺优化后,所得晶型A用XRPD,DSC,TGA表征,不含其他晶型,有利于产品质量的控制.[19]
4 结论
以2-氟-5-[(4-氧代-3,4-二氢酞嗪-1-基)甲基]苯甲酸为原料,经酰胺化反应、脱Boc、再酰胺化等三步反应得到奥拉帕利粗品,再经乙醇水溶液重结晶得到奥拉帕利晶型A.每步中间体均用1H NMR和13C NMR确证结构,目标产物的化学结构经1H-NMR,13C-NMR,MS和元素分析等确证,晶型经XRPD,DSC,TGA确证.路线总收率为51%.
