绿茶提取物结合耐力训练对人体底物代谢的影响
2022-11-21盛治进张忠兴计永胜
盛治进,张忠兴,计永胜
(1.安徽医科大学 体育教学部,安徽 合肥 230032;2.中国科学技术大学 生命科学与医学部,安徽 合肥 230026)
由生活习惯所导致的疾病大多与肥胖密切相关,如Ⅱ型糖尿病、高血压、高血脂和动脉硬化等.因此,肥胖是许多国家都面临的健康问题.这种疾病主要是由于缺乏锻炼或者摄入过多能量所致,为了防止肥胖症的发生,一般建议经常进行耐力训练以及改善饮食习惯.耐力训练是指在中等到高等强度训练中,能够提高骨骼肌中脂肪酸氧化能力并且在保证一定的能量输出下增加全身脂肪利用比例.将饮食同耐力训练相结合,通过饮食调整增强耐力训练有效性的研究甚少.
在亚洲国家,绿茶是最受欢迎的饮料之一,其含有茶儿茶素(Tea Catechins,TC)类多酚组成的GTE.有研究表明,习惯性地摄入GTE可以减少体重和脂肪量,在人类休息和运动时,通过增强交感神经活动和脂类分解,提高全身脂肪利用的比率.[1]GTE中所含的TC对脂肪的代谢有很大影响.[2-3]Murase等人指出,长期摄入GTE并且进行常规运动,小鼠体重增加被抑制.长期摄入GTE增加了骨骼肌中脂肪酸氧化,从而增加了全身脂肪的利用比例.[4-5]国内学者关于GTE对于人体有氧性、无氧性运动疲劳的恢复做了有关研究,属于事后补充GTE的功效研究.[6-7]本文研究人体在耐力训练过程中补充GET对人体底物代谢的影响.
1 对象与方法
1.1 受试对象
研究对象为合肥市某大学18名健康男性大学生.纳入标准:有长期坚持体育运动的习惯;无绿茶及相关饮料的饮用习惯.年龄21~25岁,身高167~177 cm,体重62.7~71.9 kg,体质指数(BMI)21.4~24.4 kg/m2,峰值摄氧量(VO2peak)3.12~3.74 L/min,通气无氧阈(VT)1.73~2.18 L/min,最大心率(HRmax)181~203次/分.受试对象被随机分为两组:安慰剂(placebo,PLA)组和GTE组,表1显示了详细信息.所有受试者均已签署知情同意书.本研究测试计划获得安徽医科大学医学伦理委员会批准.

表1 两组实验对象实验前后基本特征比较(x±±Ss,n=18)
1.2 实验设计
1.2.1 实验仪器
身高体重测试仪(恒奥德TFB-CSTF-ST),人体成分分析仪(康奈尔公司SN-1C),血压计(欧姆龙U30),功率自行车(瑞典Monark834E),气体分析仪(美国KORR Cardio Coach),心率表(POLAR RS800CX),心电图仪(德国CUSTO Med Cardio 100).
1.2.2 实验指标
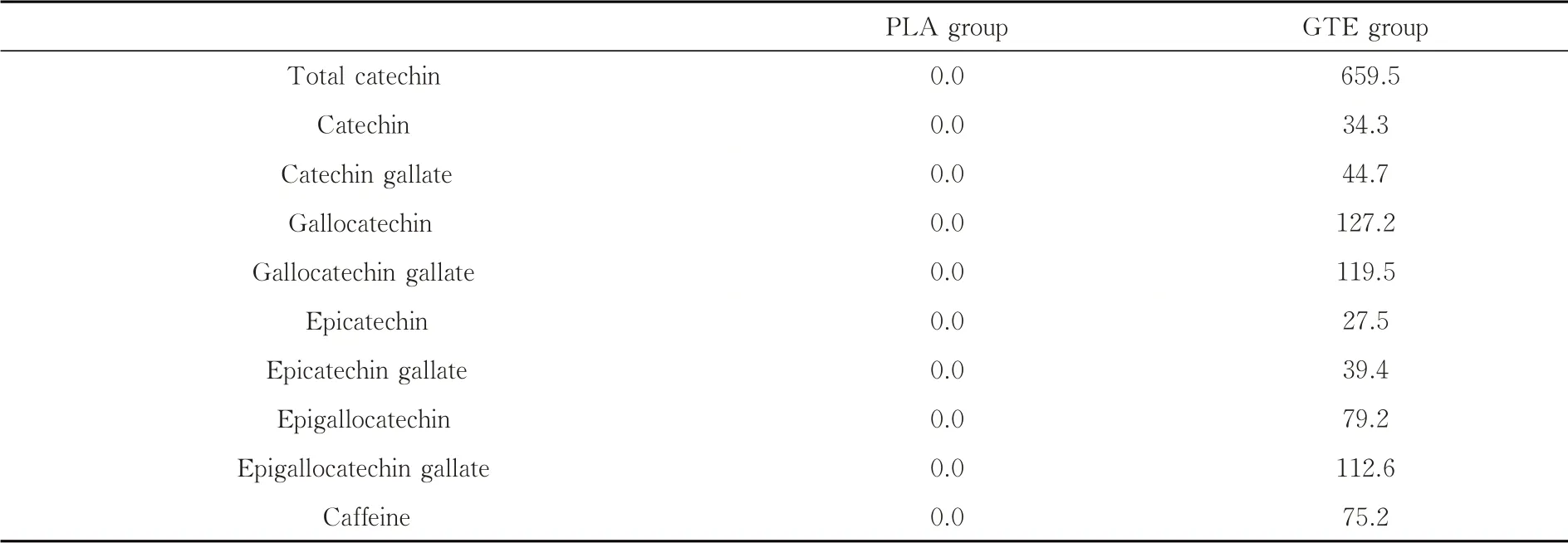
表.2 测试饮料成分表 mg
血液指标:血糖、甘油三酯、血乳酸、脂肪酸.形态学指标:身高、体重、BMI.机能指标:心率、血压.运动指标:递增负荷运动实验(Graded Exercise Test,GXT),每级负荷最后1 min心率、血压、动态心电图.气体代谢指标:呼吸交换率(Respiratory Exchange Ratio,RER)、摄氧量(Oxygen Uptake,VO2)、二氧化碳生成量(Carbon Dioxide Production,VCO2).
1.2.3 测试饮料
两组受试者在10周内每天喝340 mL的测试饮料.饮料的组成成分如表2所示.在GTE组测试饮料中,TC总含量为659.5 mg,大约相当于6-7杯普通绿茶的含量.PLA组所饮用的饮料中TC总含量为0.实验期间,受试者不能饮用除实验室提供的其他饮料.
1.2.4 膳食摄入
在实验期间,两组受试者的膳食配比做统一要求,每天平均能量维持在2700±312 kcal,其中蛋白质(%)13.5±0.8,脂肪(%)31.2±2.4,CHO(%)55.3±3.1.
1.2.5 实验方法
实验设计:根据递增负荷运动实验确定最大吸氧量(VO2max)、耗氧量峰值(VO2peak)、通气无氧阈(VT)、最大心率(HRmax)指标.再采用亚极量运动模式进行日常训练,该模式吸氧量为最大吸氧量(VO2max)的75%,能量代谢当量(MET)值为8,心率(HR)150~165次/分.受试者在温度为23℃、湿度为35%的环境中进行为期10周的耐力训练.每周3天,每天60 min.GTE组在整个实验期间服用事先备好的含GTE测试饮料,PLA组服用的饮料不含上述物质.各项实验数据的获取时间为,实验前(Pre-experiment):未服用测试饮料,10周训练开始前.实验后(Post-experiment):最后一次服用测试饮料,10周训练结束后.
实验操作:首先进行递增负荷运动实验.实验开始前,两组受试者于当日早上8点来到实验室,期间已经禁食12小时,统一提供早餐,餐后90 min进行测试,实验温度23~25℃,湿度50%.待正常状态后进入负荷测试状态.正式测试开始后,受试者以60转/分的负荷开始蹬车,运动强度每3分钟增加60转,直到180转.在此强度下,每2分钟增加30转,直到240转.之后每2分钟增加15转,直到受试者力竭不能保持转速.在此期间,每15秒测试一次耗氧量和通气阈.结束后取3个最大平均值,确定耗氧峰值.然后在亚极量运动模式下获取实验数据.实验室环境和测试设备不变,维持VO2max的75%,HR控制在150~165次/分,以每分钟60转的速度运动90 min.环境湿度每分钟测量一次.VO2和VCO2每30 s测量一次.血样采集时间在90 min运动之后.
1.2.6 底物氧化量计算
底物氧化量的计算:把实验过程中每30 s测量一次的VO2和VCO2数据代入底物氧化公式[8]:
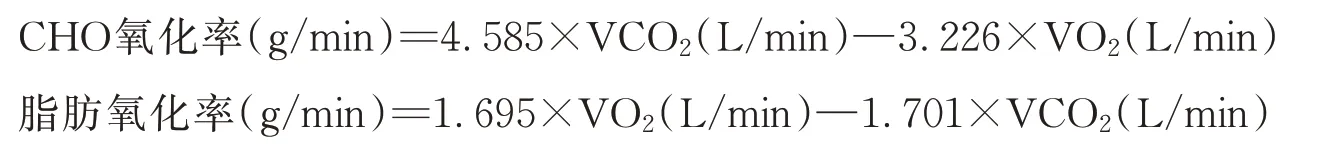
1.3 统计学分析
采用SPSS 24.0软件包进行统计分析.计量资料以均数±标准差(xˉ±s)表示,组内数据用配对t检验,组间数据用方差分析,P<0.05为差异有统计学意义.
2 结果
实验前,PLA组和GTE组血液指标、形态学指标、机能指标、膳食摄入等均无显著性差异(P>0.05).整个训练过程中,PLA组和GTE组的平均运动负荷无显著性差异(P=0.87,P>0.05).
2.1 CHO氧化率变化特征
在PLA组和GTE组中,实验后两组的平均CHO氧化率明显低于实验前,组内差异显著(P<0.05).从组间差异分析,实验后GTE组CHO氧化率下降值显著高于PLA组,组间差异显著(P<0.05)(表3).
表3 实验前后CHO氧化率、脂肪氧化率对比 (mg/min/kg)(±±Ss, n=18)
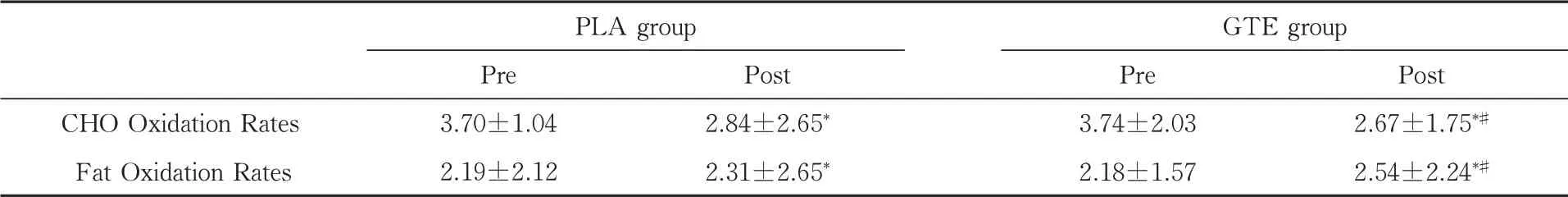
表3 实验前后CHO氧化率、脂肪氧化率对比 (mg/min/kg)(±±Ss, n=18)
注:*P<0.05 vs Pre-experiment.#P<0.05 vs PLA group post-experiment
CHO Oxidation Rates Fat Oxidation Rates PLA group Pre 3.70±1.042.19±2.12 Post 2.84±2.65*2.31±2.65*GTE group Pre 3.74±2.032.18±1.57 Post 2.67±1.75*#2.54±2.24*#
2.2 脂肪氧化率变化特征
实验后两组的平均脂肪氧化率明显高于实验前,组内差异显著(P<0.05).从组间差异分析,实验后GTE组脂肪氧化率上升程度显著高于PLA组,组间差异显著(P<0.05)(表3).
2.3 RER变化特征
在PLA组,90 min运动后平均RER为0.836±0.006,实验前的数值为0.840±0.005,组内无显著差异(P>0.05).在GTE组中,90 min运动后平均RER为0.807±0.004,实验前数值0.846±0.003,组内实验前后呈显著性差异(P<0.05).实验后组间方面,GTE组相对于PLA组下降趋势明显,组间呈现显著性差异(P<0.05),即呈现出一种趋势,补充GTE结合中度有氧训练加速了呼吸交换率(RER)的下降.
2.4 血基质浓度分析
血乳酸浓度和血浆葡萄糖浓度方面,PLA和GTE组在实验前后浓度基本不变,组内和组间差异不显著(P>0.05).血浆甘油浓度方面,实验开始前随着运动时间的推进,血浆甘油浓度增加明显,而实验后升高的趋势减缓,组内差异显著(P<0.05).血清游离脂肪酸方面,实验后两组浓度呈增高趋势,组内差异显著(P<0.05).GTE组比PLA组在实验后增长趋势明显,组间差异显著(P<0.05)(表4).
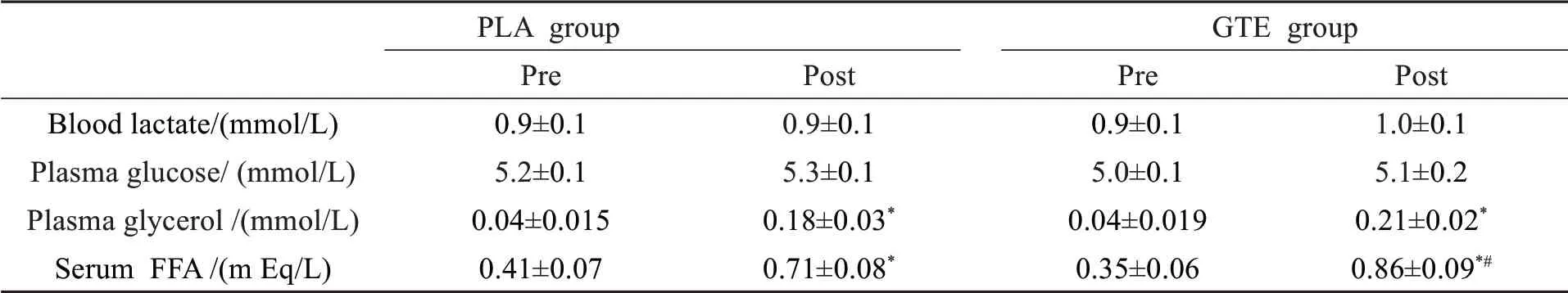
表4 实验前后血基质浓度对比分析(x±±Ss,n=18)
3 讨论
笔者发现,受试者耐力训练中补充GTE,比单独训练而言增加了全身脂肪的利用率,增强了在运动过程中优先使用脂肪作为能量来源的能力.Carter与De Bock等人得出过对训练的代谢适应可以降低能量消耗的结论,但这种减少很难通过比较训练前后的脂肪氧化绝对值来评估或解释脂肪代谢的变化.[9-10]
关于通过GTE来降低RER的作用机理,Murase等人曾做过研究,使用过GTE再进行耐力训练的老鼠,运动后血浆脂肪酸浓度明显高于没有使用过GTE的老鼠,这表明长期摄入GTE可在运动中增强脂肪溶解和脂肪酸在骨骼肌合成中的供应.[5]传统观点认为,运动过程中骨骼肌的脂肪酸氧化高度依赖于血管内FFA浓度[11],但这个观念仍然存在争议.然而,更高的FFA供应至少在一定程度上有助于GTE降低RER.
从作用机理分析,运动过程中骨骼肌中脂肪酸特别是长链脂肪酸的氧化主要是通过肉碱棕榈酰转移酶(CPT-I)进入线粒体进行调控的.丙二酰辅酶A(malonyl-CoA)作为存在于外线粒体膜中的一种关键酶,它能起到抑制CPT-I的作用.[12]Murase等人研究证实,服用GTE结合耐力训练的老鼠骨骼肌中的malonyl-CoA含量明显低于没有使用过GTE的老鼠.因此,在动物实验中,GTE降低malonyl-CoA水平可以减轻对CPT-I的抑制,从而促进脂肪酸氧化.[4]
对于人体的作用机制而言,Odland等人在研究中发现,尽管脂肪氧化大量增加,但人体骨骼肌中的malonyl-CoA含量在运动过程中并没有改变.[13-14]此外,Roepstorff等人报道称,无论运动前肌糖原含量高或低,运动期间人体骨骼肌中的malonyl-CoA含量变化不大,尽管脂肪氧化有显著差异.[12]这些研究表明,在运动过程中,人体骨骼肌肉中的malonyl-CoA可能不是调节脂肪酸氧化的关键因素.
进一步研究发现,在运动过程中,线粒体酶的激活对促进脂肪氧化非常重要.在运动后,服用GTE结合耐力训练的老鼠骨骼肌内脂肪酸β氧化活性明显高于没有GTE的小鼠,这表明长期服用GTE的小鼠在线粒体水平上增加了脂肪酸的氧化.[15]因此,在本研究中,长期摄入GTE可能激活人体骨骼肌中的脂肪酸β氧化,这可能有助于在运动过程中加速全身脂肪的利用.然而因为不能直接测量人体骨骼肌β氧化的活性,因此,需要进一步的研究来评估.
在PLA组中,RER在实验前后基本保持不变,不变的RER可能部分归因于训练前的脂肪代谢基线.较高的脂肪氧化预训基线可能将训练诱导的基质代谢的适应性降到最低限度.[16]在GTE组中,训练后观察到较低的RER,恰恰说明GTE是一种在脂肪氧化中相当有效的刺激物.
TC是GTE主要组成部分,是对于能量消耗和脂肪氧化增加的主要因素.TC抑制儿茶酚氧位甲基转移酶,降低去甲肾上腺素的酶,且咖啡因抑制磷酸二酯酶,降解细胞内环腺苷酸的酶,所以GTE摄入对增加或延长交感神经活动有协同效应,从而增加能量消耗和脂肪氧化.[17]Venables等人研究发现,在中强度运动中,急性摄入GTE可导致脂肪氧化和血浆甘油浓度升高,这表明GTE增强了全身脂肪脂解,从而增加脂肪的氧化.与急性效应不同,慢性GTE摄入则有选择性地增加整体脂肪在运动时的利用,而没有任何关于能量消耗或全身脂解的影响.[2]Murase等人报告,与没有GTE的小鼠相比,在GTE耐力训练的小鼠中,锻炼时间明显更长,运动后立即伴有较高的肌糖原含量.[18-19]他们认为,耐力表现的提高至少在一定程度上归功于GTE对全身脂肪代谢的刺激而导致的肌肉收缩.[5]目前尚不清楚GTE是否会影响其他生理决定因素,比如VO2peak,VT和肌肉效率.
4 结论
习惯性地摄入GTE和适度运动可以有效增加身体运动中全身脂肪的利用.从运动训练与营养干预相互作用的观点来看,这项研究将提供一种全新的视角看待全身底物代谢的适应性.然而,这项研究的结果仅限于年轻男子,中等强度的训练,或在一夜未进食的状态下进行的最大运动测试.因此,在不同的条件下(如年龄、性别、身体构成、训练状况、锻炼强度或饮食等)的进一步研究需要应用策略来解决与脂肪代谢有关的健康问题.
