QuEChERS-液相色谱-串联质谱法测定 鸡蛋中金刚烷胺和金刚乙胺残留量
2022-11-21李巧莲
◎ 李巧莲,刘 鑫,刘 瀛,林 洋,王 韵
(沈阳市食品药品检验所,辽宁 沈阳 110136)
随着人们生活水平的提高,鸡蛋作为优质的高蛋白动物源食物,已成为餐桌上不可或缺的食物。因此,鸡蛋中兽药残留问题引起人们高度关注。金刚烷胺和金刚乙胺是具有饱和三环葵胺结构的金刚烷胺类药物,对流感病毒、帕金森氏综合征等病症有治疗作用[1]。金刚烷胺和金刚乙胺可在家禽养殖过程中,用于预防禽流感和治疗早期的禽流感,但是大量的金刚烷胺、金刚乙胺药物残留容易引起神经系统异常,对人体造成极大的危害[2-3]。因此,我国原农业部和美国食品药品监督管理局在2005年和2006年先后颁布相关的公告,命令禁止在畜禽养殖环节中使用金刚烷胺、金刚乙胺类药物[4-6]。但仍有部分养殖场违规使用金刚烷胺、金刚乙胺等类药物,由此可见建立一种准确快速检测金刚烷胺、金刚乙胺等类药物残留的方法具有重要意义。
目前测定金刚烷胺和金刚乙胺的方法主要有液相色谱法[7]、气相色谱法[8]、酶联免疫吸附法[9-10]及液相色谱-串联质谱法[11]等。液相色谱法和气相色谱法劣势是灵敏度低、选择性差、前处理过程烦琐;酶联免疫吸附法易出现假阳性;液相色谱-串联质谱法因其高选择性、高灵敏度、高通量等优势,广泛应用于多种农药、兽药残留的检测[12-15]。检测鸡蛋中金刚烷胺和金刚乙胺的方法常用的有国家标准《食品安全国家标准 动物性食品中金刚烷胺残留量的测定 液相色谱-串联质谱法》(GB 31660.5—2019)[16]和行业标准《出口动物组织中抗病毒类药物残留量的测定 液相色谱-质谱/质谱法》(SN/T 4253—2015)[17]。上述国家标准和行业标准是采用N-丙基乙二胺、固相萃取柱进行净化。QuEChERS因其前处理过程快速、简捷、有效等优势,已经在食品药品安全检测领域中广泛应用[18-21]。本研究用乙腈对鸡蛋样品进行提取,优化QuEChERS净化技术,配比N-丙基乙二胺、十八烷基硅烷键合硅胶、石墨化碳黑(PSA-C18-GCB)3种吸附剂对样品进行净化,建立一种同时检测鸡蛋中金刚烷胺和金刚乙胺残留的液相色谱-串联质谱(Liquid Chromatography-Tandem Mass Spectrometry,LC-MS/MS)分析方法,以期为鸡蛋中金刚烷胺和金刚乙胺残留的分析和监管提供技术支持。
1 材料与方法
1.1 仪器与试剂
LCMS-8050液相色谱质谱联用仪(日本岛津公司);PTY-B620电子天平(感量0.01 g,华志电子科技有限公司);T10分散机(德国IKA公司);MS200多管涡旋混匀仪(杭州瑞诚仪器有限公司);H1750R离心机(长沙湘仪离心机仪器有限公司);C18色谱柱(150 mm×2.1 mm,3.5 µm,美国Waters 公司)。
标准物质金刚烷胺、盐酸金刚乙胺、金刚烷胺-D15、盐酸美金刚-D6(100 mg·L-1,上海安谱实验科技股份有限公司);甲酸(分析纯,国药集团化学试剂有限公司);乙腈、甲醇(色谱纯,美国Thermo Fisher Scientific公司);无水MgSO4、PSA、HC-C18、GCB(上海安谱实验科技股份有限公司);实验室用水为高纯水。
样品购自沈阳市超市。
1.2 实验方法
1.2.1 标准溶液的配制
配制金刚烷胺、金刚乙胺混合标准中间溶液 (100 ng·mL-1):分别精密量取金刚烷胺、盐酸金刚乙胺标准溶液100.0 µL,置于100 mL容量瓶中,并用甲醇定容至刻度,-18 ℃避光保存。
配制金刚烷胺-D15、盐酸美金刚-D6混合同位素内标工作溶液(100 ng·mL-1):分别精密量取金刚烷胺-D15、盐酸美金刚-D6标准溶液100.0 µL,置于100 mL容量瓶中,并用甲醇定容至刻度,-18 ℃避光保存。
1.2.2 液相色谱条件
C18色谱柱(2.1 mm×150 mm,3.5 µm);流动相:水相(A)为0.1%的甲酸水,有机相(B)为乙腈;洗脱梯度:0~1 min,5%B,1~4 min,5%B→95%B, 4~8 min,95%B,8~9 min,95%B→5%B, 9~11 min,5%B;流速:0.3 mL·min-1;柱温:40 ℃;进样体积:5 µL。
1.2.3 质谱条件
电喷雾正离子(ESI+)模式电离;多级反应监测模式(MRM);雾化气的流量:3 L·min-1;干燥气和加热气的流量:10 L·min-1;LD的温度:250 ℃;接口的温度:300 ℃;加热块的温度:400 ℃。优化后定性离子对、定量离子对、碰撞能量(CE)参数见表1。
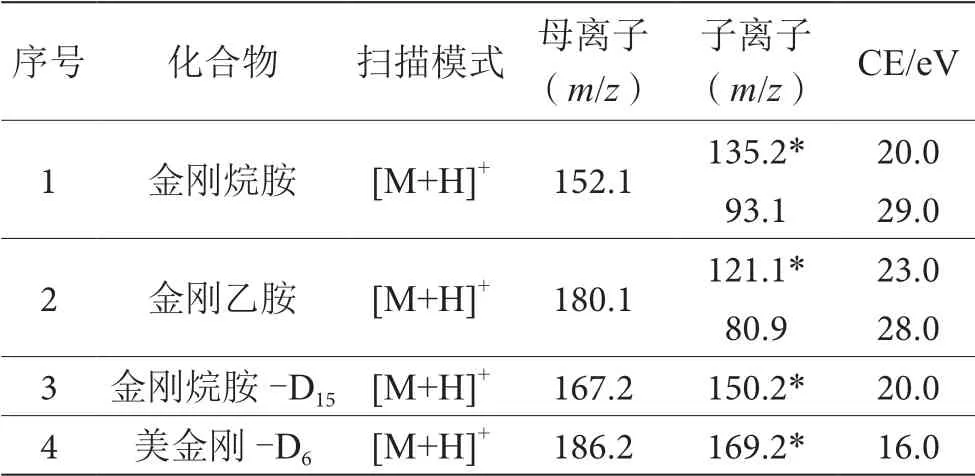
表1 质谱参数表
1.2.4 样品前处理
称取匀浆后的空白样品5.00 g置于50 mL离心管中,加入同位素内标工作溶液(1.2.1)100.0 µL,加入10 mL乙腈,1 600 r·min-1涡旋提取5 min,在转数为10 000 r·min-1的离心机中离心3 min,取上清液。将上述提取过程重复一次,合并混匀两次上清液。向15 mL离心管中分别加入150 mg无水MgSO4和3种净化剂PSA 100 mg、HC-C18100 mg 、GCB 25 mg,再加入4 mL 的上清液,1 600 r·min-1涡旋净化5 min,在转数为 10 000 r·min-1的离心机中离心3 min,取上清液,经 0.22 μm有机滤膜过滤后供液相色谱-串联质谱仪分析。
2 结果与分析
2.1 质谱条件的优化
为获得金刚烷胺和金刚乙胺最佳质谱参数,利用LCMS-8050液相色谱质谱联用仪中的自动优化模块,使用100 ng·mL-1的混合标准中间溶液(1.2.1)进行方法优化。利用前体离子搜索及产物离子搜索进行优化,得最优质谱条件,见表1。
2.2 色谱条件的优化
首先对乙腈-水和甲醇-水流动相体系进行考察,以乙腈为有机相时,可得到较好的色谱峰,色谱峰形尖锐对称,且出峰附近无明显的干扰峰,质谱响应值较高。进一步考察在水相中添加甲酸对质谱信号的影响,按0%、0.1%、0.2%、0.3%和0.5%改变添加甲酸的比例。实验结果表明水相中添加0.1%甲酸时,化合物质谱信号明显增加。但是随着甲酸添加比例的增大,质谱信号明显下降,如图1。因为正离子扫描时,酸性条件下目标化合物易于获取一个H+形成[M+H]+的分子离子峰,H+过多会抑制化合物的质谱响应。综上,采用梯度洗脱程序,用0.1%甲酸水-乙腈作为流动相,对金刚烷胺、金刚乙胺进行分离。图2为质谱和色谱条件优化后的MRM色谱图。

图1 添加甲酸的比例对化合物离子化的影响图(n=3)
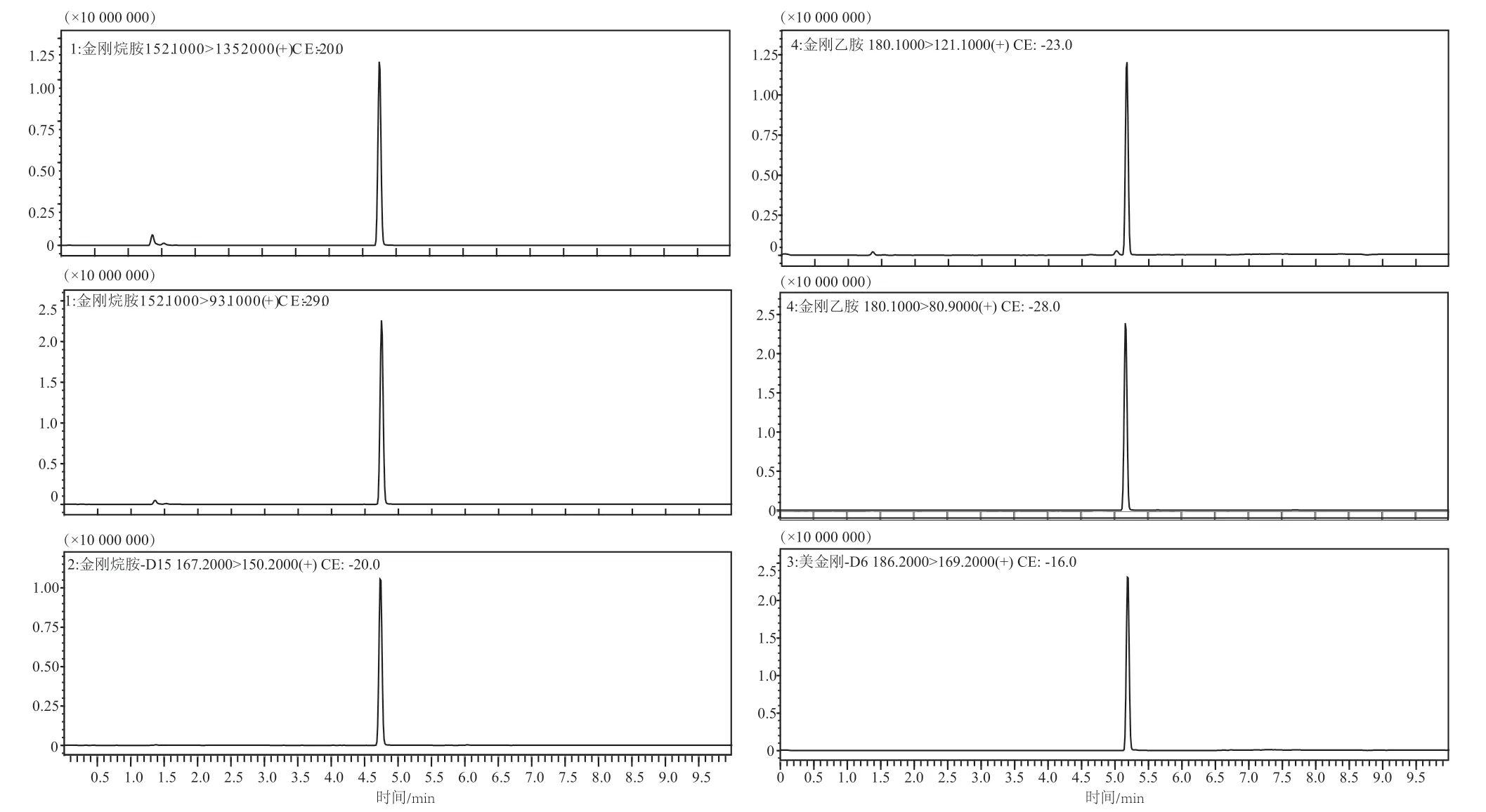
图2 MRM色谱图(0.5 µg·L-1)
2.3 QuEChERS条件的优化
本研究优化了QuEChERS技术,优化脱水剂无水MgSO4和N-丙基乙二胺、十八烷基硅烷键合硅胶、石墨化碳黑(PSA-C18-GCB)3种吸附剂的组合用量。其中无水MgSO4用于吸附试样中的少量水分,PSA用于吸附有机酸、脂肪酸、糖类,HC-C18用于吸附脂类等非极性干扰物,GCB能除去色素和固醇类物质的干扰。考察无水MgSO4、PSA、HC-C18和GCB用量对目标化合物回收率的影响。
称取空白鸡蛋基质5.00 g,添加一定量的混合标准中间液(1.2.1),使其质量浓度为0.5 µg·kg-1,按照1.2.4步骤前处理,取3组每组5个15 mL的离心管。①如图3(a)所示,无水MgSO4的添加量(50 mg、100 mg、150 mg、200 mg和250 mg)对金刚烷胺、金刚乙胺回收率影响不明显,实验选择添加量为150 mg。②添加150 mg无水MgSO4,改变PSA的添加量,如图3(b)所示,当PSA添加量为150 mg时对金刚烷胺、金刚乙胺有明显吸附,选取对化合物回收率最佳的添加量100 mg。③添加150 mg无水MgSO4和100 mg 的PSA,而改变HC-C18的添加量(25 mg、50 mg、100 mg、150 mg和200 mg),随着HC-C18添加量的增加,如图3(c)所示,化合物回收率明显下降,HC-C18添加150 mg时吸附明显,因此选择HC-C18的添加量为100 mg。④添加不同量的GCB(15 mg、20 mg、 25 mg、50 mg和100 mg),再分别添加无水150 mg MgSO4、100 mg PSA和100 mg HC-C18,当添加25 mg的GCB时,金刚烷胺、金刚乙胺的回收率较高,如图3(d)。
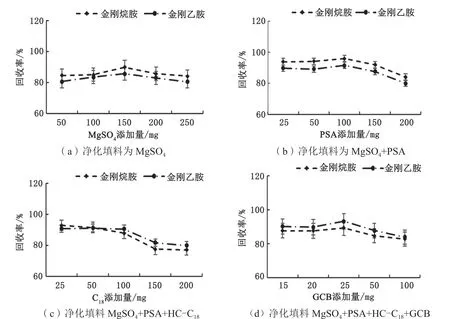
图3 净化填料用量对化合物回收率的影响图(n=3)
综上所述,选确无水MgSO4、PSA、HC-C18和GCB的添加量分别为150 mg、100 mg、100 mg和25 mg。
2.4 基质效应
基质效应(Matrix Effect,ME)普遍存在残留分析的物质中,影响检测结果的准确性,本研究采用基质标准曲线与甲醇为溶剂标准曲线线性方程斜率比进行计算评价。计算方法为 ME=(空白基质标曲斜率/溶剂标曲斜率-1)×100%,当ME为正值时为基质增强效应,当ME为负值时为基质减弱效应。弱基质效应为-20%~20%,基质干扰程度较低;中等程度基质效应为-50%~-20%和20%~50%;而ME小于-50%和大于50%为强基质效应,需采取措施补偿基质效应[22]。表2结果表明,金刚烷胺、金刚乙胺为中等基质减弱效应。为消除基质干扰,提高检验结果的可靠性,应采用基质匹配校准曲线。

表2 基质效应、相关系数、检出限和定量限表(n=3)
2.5 方法学验证
2.5.1 检出限、定量限和线性范围
在空白基质中加入一定量的金刚烷胺、金刚乙胺标准溶液(1.2.1)使其浓度分别为0.125 µg·L-1、 0.250 µg·L-1、0.500 µg·L-1、1.250 µg·L-1和2.500 µg·L-1, 按1.2.4步骤进行操作,配制基质标准曲线。在 0.125~2.500 µg·L-1,相关系数r为0.999 87、0.999 90, 均大于0.99,线性关系良好。以信噪比S/N≥3和S/N≥10计算检出限和定量限,得到的检出限和定量限分别为0.5 μg·kg-1、2.0 μg·kg-1和2.0 μg·kg-1、5.0 μg·kg-1,如表2所示。
2.5.2 回收率和精密度
称取空白基质5.00 g,添加一定量的混合标准中间液(1.2.1),使金刚烷胺质量浓度为0.5 µg·kg-1、 1.0 µg·kg-1和2.5 µg·kg-1、金 刚 乙 胺 质 量 浓 度 为 2.0 µg·kg-1、4.0 µg·kg-1和10.0 µg·kg-1,按1.2.4步 骤进行操作,对低、中、高3个浓度平行测定6次。如表3所示,平均回收率为93.43%~98.90%,相对标准偏差(RSD)为0.92%~4.14%。结果表明,该方法具有良好的准确度和较高的精密度。
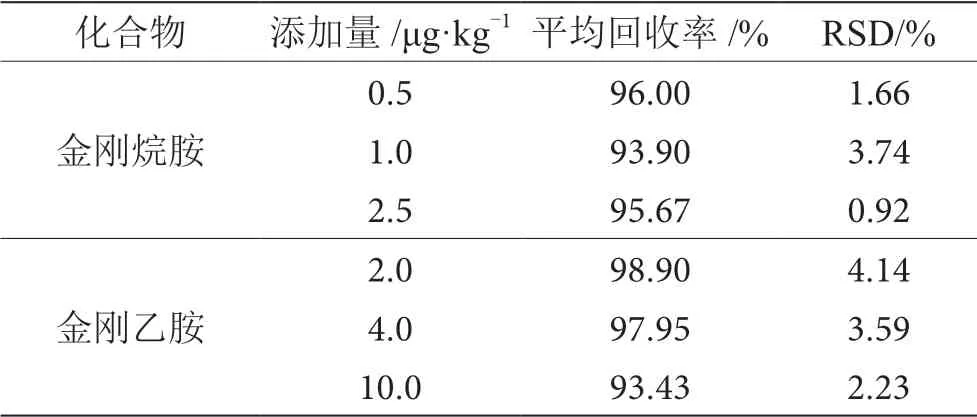
表3 回收率和精密度试验结果表(n=6)
3 结论
本研究应用改进的QuEChERS技术结合液相色谱-串联质谱法建立了鸡蛋中金刚烷胺和金刚乙胺残留量的检测方法。采用基质标准曲线校准,同位素内标法定量。该方法前处理过程简便、线性关系良好、准确度和精密度高,可为鸡蛋中金刚烷胺和金刚乙胺残留量的检测提供参考依据。
