基于增强CT影像组学术前预测胃癌淋巴结转移*
2022-11-21高玉青王小雷李淑华赵灿灿赵德雷段绍峰谢宗玉
高玉青 王小雷 徐 鹤 李淑华 赵灿灿 赵德雷 段绍峰 谢宗玉,*
1.蚌埠医学院第一附属医院放射科(安徽 蚌埠 233004)
2.上海GE医疗公司(上海 21000)
胃癌是目前我国常见的恶性肿瘤之一,其发病率及病死率均较高[1],早期诊断及治疗对患者预后至关重要,胃镜是早期诊断胃癌的常用方法,但其为侵入性检查,且不能评估肿瘤扩散及淋巴结转移情况[2],有研究证实[3]胃癌患者淋巴结转移与患者预后密切相关,因此,术前准确评估胃癌患者是否伴有淋巴结转移对患者治疗方式的选择及预后至关重要。CT、超声内镜以及PET-CT是临床常用的术前评估方法,但其准确性难以达到临床满意[4-5]。影像组学可高通量提取大量定量图像数据,将影像数据转换为定量、客观的可挖掘数据,进而进行数据分析[6],有助于临床治疗决策,且基于CT 的影像组学具有无创的特点,本文探讨基于CT图像的影像组学术前预测胃癌淋巴结转移的价值。
1 资料和方法
1.1 一般资料收集我院2019年1月至2019年12月期间经手术后病理证实的胃癌患者259例,男175例,女84例,年龄27~86岁(平均年龄63.4 ± 10.2岁)。
纳入标椎:接受根治性手术切除的患者;术后病理证实为胃癌且是否有淋巴结转移;术前行腹部CT平扫及增强扫描;术前未进行放射治疗、化学治疗等其他治疗。
1.2 仪器与方法所有患者使用GE 64排Light Speed及256排Revolution CT进行扫描,扫描范围为膈顶部至双肾下极水平,扫描参数: 管电压120kV,采用ACTM自动管电流调制技术,层厚5mm,层距5mm。先行平扫,后行增强扫描,经肘静脉通过高压注射器注射碘普罗胺,流率3.5mL/s,剂量1.0mL/kg,于注射对比剂后20~30秒、40~50秒行动脉期及静脉期扫描。图像重建层厚是0.625 mm。
1.3 图像分割使用AK软件(artificial intelligence Kit,GE Healthcare,China)在CT增强静脉期图像上手动勾画ROI,以DICOM格式导出图像至AK软件,一位年轻放射科医生在一位具有五年以上及一位十五年以上腹部影像学诊断经验的放射科医生A和B共同指导下对所有患者的病变进行ROI勾画。在进行勾画时,选取肿瘤最大层面,且保留距肿瘤边缘1~2 mm的距离,以避免周围脂肪组织及空气的干扰(手动勾画见图1)。两周之后年轻放射科医生又随机挑选20例病例,重新进行一次勾画,以评价两次勾画之间的一致性。采用AK软件(GE health care,shanghai)对勾画的ROI进行特征提取,最终提取396个影像组学特征,并对组内影像组学特征可重复性进行评估,采用组内相关系数(Interclass,correlation coefficients,ICCs)评价组内一致性,ICC>0.75表示一致性较好。
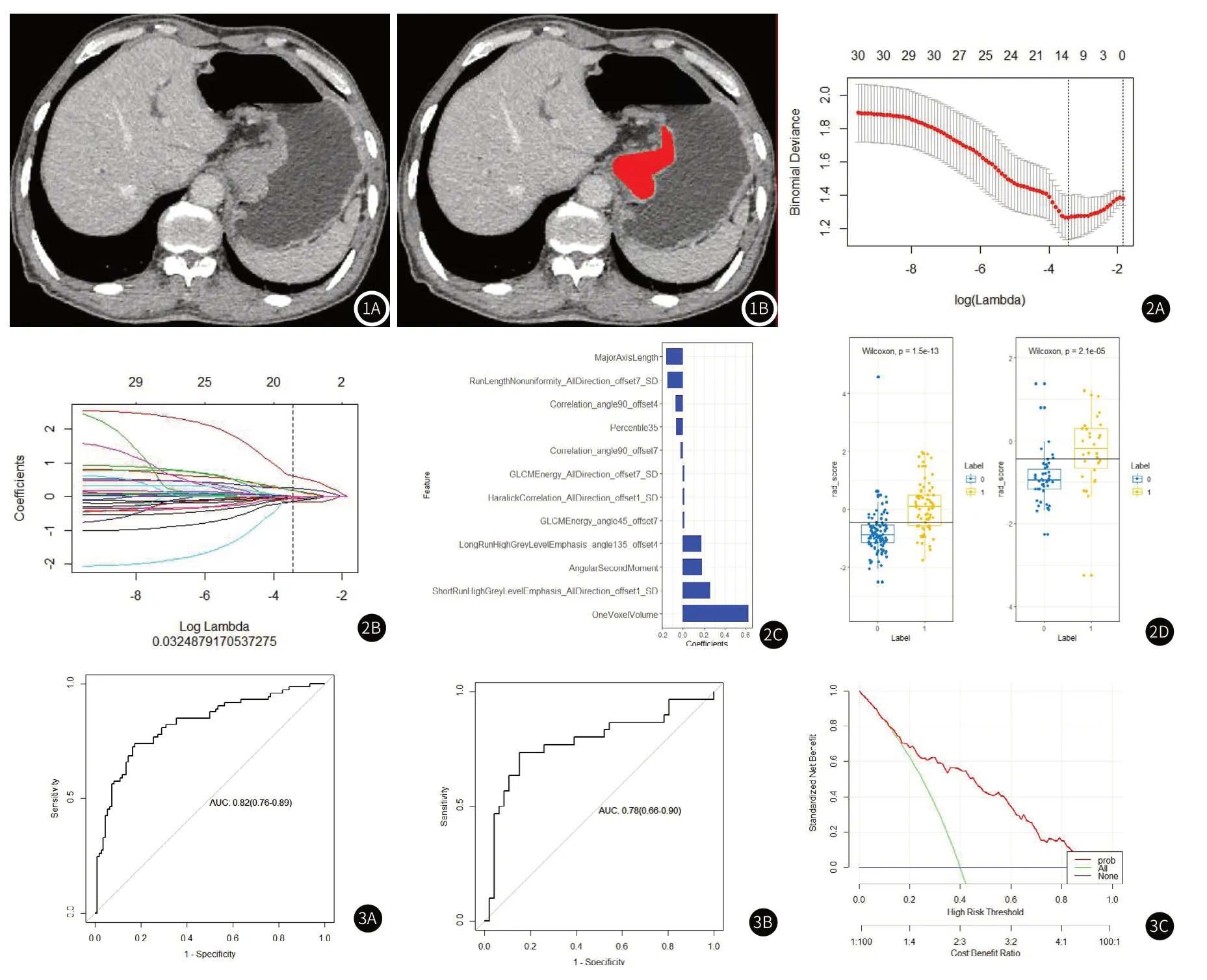
图1 基于肿瘤最大层面手动勾画ROI示意图。图2 采用LASSO回归分析最终筛选出12个影像组学特征,图2A:通过10折交叉验证选择LASSO模型中的调谐参数λ,y轴表示二项式偏差,较低的x轴表示logλ的值,较高的x轴表示特征数量,左边虚线对应二项式偏差最小时λ的值,选取此时λ值作为最终调谐参数;图2B:各个特征的系数随λ变化的曲线,在虚线二项式偏差最小处保留系数不为0的特征;图2C:最终保留的系数不为0的特征以及其相应的系数;图2D:将最终保留的12个系数不0的特征通过线性结合,并计算每个病人的rad_score分数,根据最优截断值将radscore分为淋巴结转移组(Label=1,黄色点),以及非转移组(Label=0,蓝色点),在训练集和验证集当中两组分类均有显著差异(P<0.05)。图3 影像组学模型预测胃癌淋巴结转移的ROC曲线(图3A:训练集;图3B:验证集)。决策曲线分析(DCA)评估该模型的临床实用性,在0.2~1的阈值范围内,组学评估胃癌淋巴结转移具有较高收益(图3C)。
1.4 特征选择及影像组学组模型的建立将259例病例随机分为训练集(n=183)和验证集(n=76),在训练集中使用最小冗余最大相关方法(minimum redundancy maximum relevance,mRMR)和最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)两种特征选择方法来选择特征。首先使用mRMR去除冗余和不相关的特征,然后进行LASSO回归分析来选择最有预测价值的影像组学特征,使用多元逻辑回归分析构建影像组学模型,并计算每个病人的影像组学分数(Radscore)。
1.5 预测模型的评估采用受试者工作特征(ROC)曲线对模型的效能进行评估,并通过20次重复交叉验证来验证结果的可靠性。在训练集和验证集中分别对预测模型的效能进行评估。
1.6 统计学分析使用R软件(版本3.5.1,http://www.Rproject.org)进行统计分析。使用独立样本t检验比较训练集与验证集患者年龄的差异;使用Chi-Squared检验比较患者性别的差异,并使用非参数检验的统计分析来评估影像组学分数的差异。LASSO回归使用“glmnet”软件包进行,而多变量逻辑回归是使用“rms”软件包执行。使用“pROC”软件包进行受试者者工作特征(ROC)曲线的绘制。P<0.05为差异有统计学意义。
2 结 果
根据术后病理证实,259例胃癌患者中,156例患者存在淋巴结转移,103例患者无淋巴结转移。按7:3分组将病人分为训练集和验证集,其中训练集183例,男125例,女58例,年龄27~86岁(平均年龄63.2±10.9岁),其中淋巴结转移阳性110例,阴性73例;验证集76例,男50例,女26例,年龄43~83岁(平均年龄63.9±8.6岁),其中淋巴结转移阳性46例,阴性30例;两组间患者年龄、性别间差异无统计学意义。
2.1 特征选择与影像组学模型构建所提取的396个影像组学特征均具有较好的组内一致性(ICC>0.75)。首先通过mRMR去除冗余和不相关的特征,保留30个特征,然后采用LASSO最终筛选出12个对胃癌淋巴结转移最有预测价值的影像组学特征,采用多元逻辑回归分析构建影像组学模型(见图2),并计算每个病人的Radscore,其计算公式如下:Radscore=0.622*OneVoxelVolum e+0.013*GLCMEnergy_angle45_offset7+0.012*GLCMEnergy_AllDirection_offset7_SD+0.259*ShortRunHighGreyLevelEm phasis_AllDirection_offset1_SD+-0.07*Correlation_angle90_offset4+-0.161*MajorAxisLength+-0.066*Percentile35+-0.147*RunLengthNonuniformity_AllDirection_offset7_SD+0.182*AngularSecondMoment+0.176*LongRunHighGreyLev elEmphasis_angle135_offset4+0.013*HaralickCorrelation_AllDirection_offset1_SD+-0.024*Correlation_angle90_offset7+-0.434。
2.2 模型预测胃癌淋巴结转移的效能在训练集中,影像组学模型预测胃癌淋巴结转移的ROC曲线下面积(AUC)为0.82[95%CI(0.76-0.89)],验证集中AUC为0.78[95%CI(0.66~0.90)],20次重复交叉验证中的平均准确度、敏感度、特异度分别为0.79、0.74、0.83及0.76、0.63、0.85,最后使用决策曲线分析(DCA)来评估该模型的临床实用性(见图3)。
3 讨 论
胃癌是否存在淋巴结转移对于临床术前规划及术后辅助治疗方式的选择至关重要[7],且与患者的预后紧密相关,研究表明[2]阳性淋巴结比例较高的患者5年生存率不足20%,根据NCCN指南[8],CT、超声内镜以及PET-CT是临床常用的术前评估胃癌淋巴结转移方法。其中,临床上最常用的术前检查方法是CT扫描,而CT术前预测淋巴结的准确不高[9],超声内镜作为有创检查,并不适用于所有患者,且其准确率约为50~70%左右[10],在远处淋巴结转移及骨转移方面,PET/CT具有其独特优势,但对于区域淋巴结转移的准确性并不高于CT及超声内镜[11]。
影像组学作为近年来新兴的一种影像分析手段,可高通量提取大量图像数据,将影像图像转换为定量、客观的可挖掘数据,已广泛应用于胃癌患者。Gao[12]等研究指出,肿瘤浸润性调节T细胞(TITreg) 比例越高,胃癌患者预后越差,影像组学可通过评估胃癌患者TITreg的比例从而预测患者预后情况,这表明影像组学可能在预测胃癌患者免疫治疗疗效方面发挥有利作用;另外,影像组学在预测胃癌患者预后及化疗疗效、胃肿瘤鉴别上也表现出了较好的诊断效能[13-15]。
影像组学可通过提取的特征参数来反映肿瘤内在特征(如大小、纹理、灰度)等的异质性[16],目前,基于CT图像的影像组学是胃癌、直肠癌等淋巴结转移的独立预测指标,可用于构建术前淋巴结转移的预测模型[17-18]。在本研究中,基于胃癌患者CT图像提取影像组学特征,并通过使用mRMR和LASSO两种特征选择方法筛选出12个系数不为0的特征,包括灰度共生矩阵、最大径长度、35分位值、角二阶矩、体积、灰度游程矩阵相关参数,其中体积、角二阶矩、短/长游程高灰度强化与淋巴结转移呈正相关,且相关性较高,基于特征参数构建的术前淋巴结转移预测模型在训练集和验证集中均具有较好的诊断效能(AUC分别为0.82和0.78),准确度、敏感度、特异度分别为0.79、0.74、0.83及0.76、0.63、0.85。LASSO方法是常用的高维变量回归方法,Sun[19]等利用LASSO回归分析,建立了基于CT图像和临床病理特征的影像组学研究预测非小细胞肺癌(NSCLC)患者肿瘤细胞PD-L1的表达,从而确定哪些患者可以从抗PD-L1免疫治疗中获益。Jiang[20]等利用LASSO回归分析选取影像组学特征,其研究结果表明影像组学可作为淋巴结转移的独立预测因子,与淋巴结分期显著相关,其研究共纳入1689例患者,且预测模型整合了影像组学特征、临床T和N分期以及其他临床病理变量,本研究纳入病例较少,未结合患者临床特征,在接下来的研究中将收集更多病例进一步研究。Wang[21]等人的研究表明CT影像组学在胃癌淋巴结转移具有一定的预测价值。不同的是,其在CT动脉期图像上进行病灶分割和提取特征,而本研究在CT静脉期图像上进行病灶分割和提取特征,本研究认为一方面CT增强动脉期,明显强化的血管腔会对病灶造成伪影干扰,另一方面大多数胃癌在静脉期强化较为明显,可与邻近正常组织区分开,这对提取和选择有意义的放射组纹理特征有很大影响,如果病灶分割不准确,则会得出不可靠的结论。另外,Ma[22]等人的研究显示在胃癌CT征象中,静脉期CT值对淋巴血管侵犯的预测价值较好,因此,基于CT增强静脉期影像组学技术,不仅避免了观察者受主观及客观因素对影像征象解读的影响,还能深度挖掘影像图像中定量、客观的数字化信息,从而提高术前对胃癌淋巴结转移的预测。
本研究的局限性:首先,样本量小,影像组学结果需要大样本研究和多中心数据来证实。本研究建立的预测模型采用内部数据进行了验证,但未进行外部数据的验证。因此,以后尚需要多中心、大样本的研究。其次,CT、PET和MRI的影像组学研究表明,影像组学特征因图像重建、层厚、参数和扫描仪类型的不同而有所差异[23-24]。与以往研究[13,20,25]相同的是,本研究中CT图像来自两台不同类型的CT机器,在以后研究中尽量减少因不同扫描机器而对结果产生的影响[23]。
综上所述,初步研究表明基于CT图像的影像组学模型在预测胃癌淋巴结转移上具有潜在价值,可为临床医生于术前为患者选择合适的治疗方法提供一种新的检查手段。
