自然衰老致增龄性骨骼肌萎缩SD大鼠模型评价
2022-11-21张伟波吴丽洁高原温佩彤寿崟王晓南徐平
张伟波 吴丽洁 高原 温佩彤 寿崟 王晓南 徐平
(1浙江省立同德医院,浙江 杭州 310013;2浙江省中医院;3浙江省康复医院;4上海市第八人民医院;5上海中医药大学;6上海第一人民医院;7美国埃默里大学医学院)
Model evaluatron of aging-induced skeletal muscle atrophy in SD rats
ZHANG Wei-Bo, WU Li-Jie, GAO Yuan,etal.
Zhejiang Province Iongde Hospital,Hangzhou 310013,Zhejiang,China
【Abstract】ObjectiveTo observe the gastrocnemius wet weight of the body mass ratio, gastrocnemius microstructure morphology, age-related indicators of superoxide dismutase (SOD) activity and malondialdehyde (MDA) content, myogenic regulator 〔myogenic biochemical factor (MyoD), muscle satellite cell (Myogenin)〕 with the change of different months rats, then evaluate the morphology and related protein expression in rats skeletal muscle of different rats,to provide reference for the study of skeletal muscle model atrophy in SD rats with natural aging.Methods56 normal male SD rats were randomly divided into 6, 8, 12, 14, 16, 18 and 20-month-old group. They were fed with natural diet. At the corresponding age of month, two sides of gastrocnemius muscle and blood were taken. After weighing gastrocnemius muscle wet weight, the ratio to the body weight was calculated. After blood centrifugation, the content of SOD and MDA in muscle and serum and the expression of MyoD and Myogenin in muscle were measured.ResultsAfter the age of 14 months, the mortality of rats increased gradually with aging.Morphologically, compared with the age of 6 months, the gastrocnemius muscle of the rats at the age of 8 months had not significant atrophy. After the age of 12 months, the gastrocnemius muscle of the rats showed significant atrophy, skeletal muscle cells showed mild degenerative changes. With the increase of age, the gastrocnemius muscle atrophy and muscle fiber senescence necrosis became more obvious. The gastrocnemius muscle of rats showed obvious atrophy and degenerative changes after the age of 12 months, which could meet the requirements of modeling. SOD activity in gastrocnemius muscle and serum of the rats at the age of 12 months was not significantly different from that of the rats at the age of 8 months(P>0.05), it decreased significantly at the age of 14 months, and SOD activity decreased more obvious with the increase of the age (allP<0.05). MDA content in serum and gastrocnemius muscle did not increase significantly at the age of 12 months(P>0.05). At the age of 14 months, MDA content increased significantly, and with the increase of months, MDA content increased more significantly(allP<0.05). Compared with 8-month-old group, there was no significant difference in the expression of MyoD in gastrocnemius muscle between 12-month-old and 14-month-old group(P>0.05),but the expression of MyoD was significantly decreased in 16,18 and 20-month-old groups(P<0.05). The expression of Myogenin decreased with age increasing. Compared with 8-month-old group, the expression of Myogenin in other groups were significantly different(P<0.05). The natural aging could mainly affect the expression of Myogenin, except the expression of MyoD at the age of 12~14 months.ConclusionsThe better modeling time for the aging model of natural aging rats with skeletal muscle atrophy is the age of 12~16 months, during which skeletal muscle atrophy is obvious and feeding time is moderate, which could not only save modeling time and experimental cost, but also guarantee the success rate of modeling.
【Keywords】 Aging; Aging skeletal muscle atrophy; Animal model
疾病动物模型在生物医学研究中至关重要,是开展生物医学研究的前提条件,好的疾病动物模型需要尽可能地模拟人类疾病的发病机制和临床表现,满足发病机制的同源性、行为表象的一致性、药物治疗的可预见性〔1〕,这是动物模型应用的前提,同时,造模方法是否简单易行、是否可重复、死亡率、经济性等都是评价一个动物模型优劣的重要方面。增龄性骨骼肌萎缩是在衰老的过程中发生的一种运动功能逐渐衰退的疾病,与衰老的关系密切,模型的选择也大多采用衰老相关的动物模型,主要分为自发性动物模型、诱发性动物模型和转基因动物模型〔2〕,迄今为止尚未有任何一种动物模型可以完美复制人类衰老过程〔3〕,但自发性动物模型中的自然衰老模型最能接近人体自然衰老的生理病理特点,是较为理想的动物模型。在临床研究当中,增龄性骨骼肌萎缩的诊断一直缺乏明确的标准,但骨骼肌质量伴随着功能的逐渐丧失在该疾病的诊断中已达成共识〔4~7〕,参照人流行病学的调查研究,选择一个造模效果好的动物模型十分必要,而且,与自然衰老相关的原发性增龄性骨骼肌萎缩也是这一领域的主要研究重点,在衰老机制研究中应用广泛,本文主要观察自然衰老SD大鼠腓肠肌的湿重体重比及微观组织形态变化、衰老相关指标超氧化物歧化酶(SOD)活力和丙二醛(MDA)含量、生肌调节因子〔成肌生化因子(MyoD)、肌肉卫星细胞(Myogenin)〕的变化情况,评估不同月龄大鼠造模的特点。
1 材料与方法
1.1动物及设备 6月龄SPF级雄性SD大鼠,56只,体重(490±25)g,由西普尔-毕凯实验动物有限公司提供〔SCXK(沪)2014-0008〕,饲养于上海中医药大学实验动物中心SPF级设施〔SYXK(沪)2004-0005〕。
1.2实验分组 随机分为6月龄组、8月龄组、12月龄组、14月龄组、16月龄组、18月龄组、20月龄组,具体如下:动物适应性饲养1 w后,剔除疾病、意外死亡等不符合实验要求者,按体重由轻到重的顺序,分为8个区组,每组7只,再将每个区组按照随机数字表法随机分到7个组中。
1.3动物干预方法 正常饲养,自由饮水和摄取食物(国家标准啮齿类动物常规饲料)。
1.4取材方法 于对应月龄当天禁食,次日测量体重后,用5%戊巴比妥钠麻醉后,仰卧位鼠板固定,迅速剥离双侧的腓肠肌,用电子天平称重并记录。将左侧腓肠肌剪裁约1 cm ×1 cm ×1 cm,于4%多聚甲醛溶液内固定,待取材完毕,梯度脱水后用石蜡进行包埋,用于形态学苏木素-伊红(HE)染色观察,将右侧腓肠肌用锡纸包裹标记后放于液氮中保存,用于Western印迹检测备用,心尖取血5 ml,用台式离心机分离血清后,置于-80℃的恒温冰箱内备用。
1.5指标检测 肌肉获取前称量体重,计算肌肉湿重与体重之比。 采用常规石蜡切片,对比目鱼肌分别进行HE染色;采用OLYMPUS CX21型光学显微镜观察骨骼肌形态记录并保存,然后用Mic image pro2.0对保存的图像进行分析。按照试剂盒说明对其中的SOD活力及MDA含量进行检测并记录。采用常规Western印迹法检测骨骼肌相关蛋白表达,包括MyoD和Myogenin。
1.6统计学方法 采用SPSS21.0软件行t检验。
2 结 果
2.1大鼠的取材及死亡情况 大鼠8月龄组死亡0只,12月龄组死亡1只,14月龄组死亡1只,16月龄组死亡2只,18月龄组死亡3只,20月龄组死亡4只,提示随着月龄的增加,大鼠的死亡率逐渐升高。
2.2各组腓肠肌的湿重体重比变化 与6月龄相比,8月龄大鼠湿重体重比出现下降,但差异并不显著(P>0.05),自12月龄之后,腓肠肌的湿重体重比明显下降(均P<0.05),且随月龄增加有加重的趋势,到16月龄时,约为6月龄的73%。见表1。
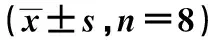
表1 各组体重及腓肠肌湿重体重比
2.3各组腓肠肌横断面HE染色 8月龄组显示为正常的骨骼肌组织学特征,肌纤维排列整齐、紧密,细胞膜边界清晰,无肌质淡染细胞,其横断面呈多角形,大小均匀,细胞核为多个,均位于细胞膜处,呈椭圆形;12月龄组出现轻度骨骼肌退行性病变,少见肌质淡染细胞,部分样本肌纤维横断面出现细胞核中心化(细胞核向细胞中心聚集)的现象,少见角化的肌纤维。14月龄组肌纤维排列尚紧密,大小尚均匀,细胞边界圆润,核内移现象较多,多见角化、坏死的肌纤维。16月龄组肌纤维的排列疏松,细胞的圆形化、小角化、细胞核的中心化及肌纤维坏死现象进一步加重,肌纤维细胞外基质增多,大小尚均匀,少见肌质淡染细胞,肌纤维的小角化现象多见,可见坏死被吞噬的肌纤维。18月龄组肌纤维的排列疏松,细胞的圆形化、小角化、细胞核的中心化及肌纤维坏死现象进一步加重。20月龄组肌纤维的排列疏松,肌纤维周边有空泡,肌质淡染,肌纤维的横断面大小差异较大,圆形化、小角化、细胞核的中心化现象进一步加重,坏死被吞噬的肌纤维多见。见图1。
2.4血清及腓肠肌SOD活力和MDA含量比较 与8月龄比较,12月龄大鼠血清及腓肠肌中的SOD活力未明显下降(P>0.05),到14月龄时才明显下降,而且随着月龄增加,SOD活力下降越明显(均P<0.05);血清及腓肠肌中MDA含量12月龄升高不明显(P>0.05),到14月龄时MDA含量升高显著,随着月龄的增加,MDA含量升高越明显(均P>0.05)。见表2。提示大鼠腓肠肌的衰老伴随着整体的衰老同时发生。

2.5腓肠肌中MyoD和Myogenin的表达量比较 腓肠肌中MyoD的表达,与8月龄组(0.66±0.18)比较,12、14月龄组(0.68±0.15、0.51±0.13)没有明显的统计学差异(P>0.05),16、18、20月龄MyoD表达(0.45±0.12、0.41±0.09、0.38±0.13)明显降低(均P<0.05);8、12、14、16、18、20月龄组Myogenin 表达分别为:0.72±0.08、0.66±0.04、0.63±0.08、0.53±0.05、0.49±0.08、0.46±0.12,且随着月龄增加逐渐降低,与8月龄组比较,其余各组Myogenin 表达差异有统计学意义(P<0.05)。提示12~14月龄,自然衰老主要影响Myogenin的表达,而对MyoD的表达影响并不明显。见图2。
3 讨 论
衰老是不可逆的,是机体发育成熟后的一个必然过程,也是增龄性骨骼肌萎缩发生的主要因素〔8〕,骨骼肌作为人体最大的运动和内分泌器官,它储存着人体60%的蛋白质,有研究显示,骨骼肌的质量和力量会在成年早期达到峰值〔9〕,之后便开始出现萎缩,在人体的研究中发现,从30岁开始,骨骼肌的相对质量开始下降,而骨骼肌绝对质量的显著下降要到50岁时才被观察到〔10〕。本研究结果说明,随着月龄的增加,肌纤维衰老的表现越来越明显。
除形态学的表现外,SOD和MDA也是反映衰老的重要指标。SOD具有重要的抗氧化功能,可以减少活性氧(ROS)的堆积,防止ROS对细胞造成损伤,这种“自由基衰老学说”最早由Denham Harman在1956年的时候提出〔11〕,研究证明,过氧化物堆积能够促进骨骼肌的萎缩〔12〕,MDA是一种具有高活性的化合物,主要来自多不饱和脂肪酸的脂质过氧化作用〔13〕,在生物体内,多是细胞膜上的脂质被氧自由基氧化的最终产物,常被用来检测脂质的过氧化程度,以间接测定膜系统的受损程度,并且MDA在细胞中能引起毒性反应,常被作为衡量生物氧化应激水平的标志〔14〕。本研究结果骨骼肌的衰老与整体的衰老关系密切。参照秦川〔15〕的医学实验动物学,其中6~12月龄正好是大鼠的成年期。由此可见,在成年期之后,大鼠衰老的同时,骨骼肌也出现了明显的衰老迹象,近年来,也有人将增龄性骨骼肌萎缩作为预测衰老死亡的一个重要指标〔4〕。因此,12月龄的大鼠,其肌肉和整体的衰老表现并不明显,若研究骨骼肌萎缩与衰老相关方面的研究,建议采用14月龄以后的大鼠。
骨骼肌的萎缩与运动单位数量和大小有关〔7,8,16〕,其中与MyoD和Myogenin的关系密切,也是决定骨骼肌萎缩的重要因素。MyoD和Myogenin是骨骼肌的正向调控因子〔17,18〕,属于生肌调节因子(MRFs)家族的成员〔19〕,能调节基因的转录〔20〕,在肌肉的生长、发育过程中起着重要作用,其中,MyoD可以激活肌卫星细胞向成肌细胞转化,促进成肌细胞转化为成熟的肌纤维,Myogenin能够促进成肌细胞分化成肌小管,在肌肉的分化过程中起着关键作用。本研究16月龄前,自然衰老主要影响肌卫星细胞能否正常分化为肌小管,而对肌卫星细胞自身的增殖影响并不明显。
一个动物模型的好坏,是直接影响科研效率和科研效果的重要因素,综上所述,增龄性大鼠骨骼肌萎缩自然衰老模型较佳的造模时间为 12~16月龄,如单纯研究某种干预措施对骨骼肌萎缩形态方面的影响,12月龄的大鼠已经可以满足相关需求,若研究骨骼肌萎缩与衰老相关方面的研究,建议采用14~16月龄的大鼠,其骨骼肌和整体衰老的指标相对明显,可见,根据实验目的选择不同月龄的大鼠模型,既可以规避高月龄大鼠高死亡率的风险,又能够节约造模时间和实验成本,提高科研效率。
