食品大豆转基因成分能力验证结果分析与讨论
2022-11-21周露,马秋莲,马蓉
随着转基因技术的飞速发展,转基因产品市场不断拓展,越来越多的转基因农产品商品化[1]。转基因技术的发展在食品中的应用也越来越广泛,已经走入了大众生活。为了提升实验室对于植物及其加工产品中转基因成分的检测能力,本实验室参加了中国检验检疫科学研究院测试评价中心组织的粮食转基因检测能力验证活动。
本次能力验证主要检测大豆内源基因Lectin(植物凝集素)、pCaMV35S(花椰菜花叶病毒35S启动子)、tNOS(来源于农杆菌的胭脂碱合成酶基因终止子)、CP4-EPSPS(根癌农杆菌CP4蛋白基因和5-莽草酸-3-磷酸合成酶基因)[2-3]。本次主要采用实时荧光PCR方法进行检测,实时荧光PCR技术是近年来定量PCR技术中兴起的最新定量检测技术[4]。
1 材料与方法
1.1 检验依据
本次实验根据《植物及其加工产品中转基因成分实时荧光PCR定性检验方法》(SN/T 1204—2016)[2]和中国检验检疫科学研究院测试评价中心的《ACAS—PT1138(2021)粮食转基因检测能力验证参试指导书》进行检测。
1.2 材料与设备
样品:大豆转基因样品共2瓶,瓶号为21-E577、21-F956。样品由中国检验检疫科学研究院测试评价中心提供。阳性对照:大豆阳性对照从实验室之前参加能力验证为阳性样品保存所获;阴性对照:非转基因大豆;空白对照:超纯水。
试剂:实验室超纯水;植物DNA提取试剂盒;引物;探针;2×Taq PCR预混试剂(不含染料);2×Taq PCR预混试剂;dNTPs溶液;Taq DNA聚合酶(含分装Mg2+)等。
设备:实时荧光PCR仪(美国安捷伦仪器公司);研磨器、电子天平(北京赛多利斯仪器有限公司);电热恒温水浴锅(上海齐欣科学仪器有限公司);微型离心机(德国HETTICH);旋涡振荡器(德国IKA);二级生物安全柜A2(新加坡ESCO);紫外分光光度计(岛津仪器(苏州)有限公司);微量移液器(德国普兰德);高压蒸汽灭菌器(日本株式会社平山制作所);法国AES均质器(法国AES仪器有限公司);超纯水机(Thermo Fisher SCIENTIFIC公司);酸度计(上海仪电科学仪器股份有限公司);药品保存箱(青岛Haier)。
1.3 实验方法
1.3.1 取样和制样
样品为粉末状,离心管密封包装。根据组织方作业指导书要求,将样品混匀后取样检测。
1.3.2 样品DNA的提取与纯化
(1)提取。根据购置的DNA试剂盒进行样品21-E577、21-F956中DNA的提取。取干重组织20 mg,加入400 μL缓冲液1和6 μL核酸内切酶,涡旋振荡,室温放置;加入130 μL缓冲液2,充分混匀,涡旋振荡;离心,将上清移至新的离心管中;加入1.5倍体积的缓冲液3,立即充分振荡混匀。
(2)纯化。将上述提取所得溶液和絮状沉淀都加入吸附柱中(吸附柱放入收集管中),离心,倒掉废液,吸附柱放入收集管中;向吸附柱中加入600 μL漂洗液,离心,倒掉废液,将吸附柱放入收集管中。重复操作一次;将吸附柱放回收集管中,离心,倒掉废液。将吸附柱置于室温放置,彻底晾干吸附材料中残余的漂洗液。将吸附柱转入干净的离心管中,悬空滴加200 μL洗脱缓冲液,室温放置,离心,将溶液收集到离心管中。
1.3.3 DNA浓度测定和定量
样品21-E577、21-F956DNA用紫外分光光度计测定在260 nm和280 nm处的吸收值,分别计算核酸的纯度和浓度。DNA的纯度比值应在1.7~1.9,浓度不低于 20 ng·μL-1。
1.3.4 实时荧光PCR反应体系配制
先取4个离心管分别标记Lectin基因、pCaMV35基因、tNOS基因、CP4-EPSPS基因,由于每个基因均有阳性、阴性、空白、21-E577样品和21-F956样品5个体系,每个离心管按表1反应体系的5倍量分别用移液器添加10PCR缓冲液、dNTP、上引物、下引物、探针、Taq酶和超纯水,完成后用微型离心机快速旋转一会儿静置。取20个PCR反应管分别标记Lectin-阳性、Lectin-阴性、Lectin-空白、Lectin-577、Lectin-956,pCaMV35S-阳 性、pCaMV35-阴 性、pCaMV35-空 白、pCaMV35- 577、pCaMV35- 956、tNOS-阳性、tNOS-阴性、tNOS-空白、tNOS-577、tNOS-956、CP4-EPSPS-阳性、CP4-EPSPS-阴性、CP4-EPSPS-空白、CP4-EPSPS-577和CP4-EPSPS-956,分别分装各自的基因20 μL体系,再分别添加5 μL的DNA模板,盖上盖子后上机。
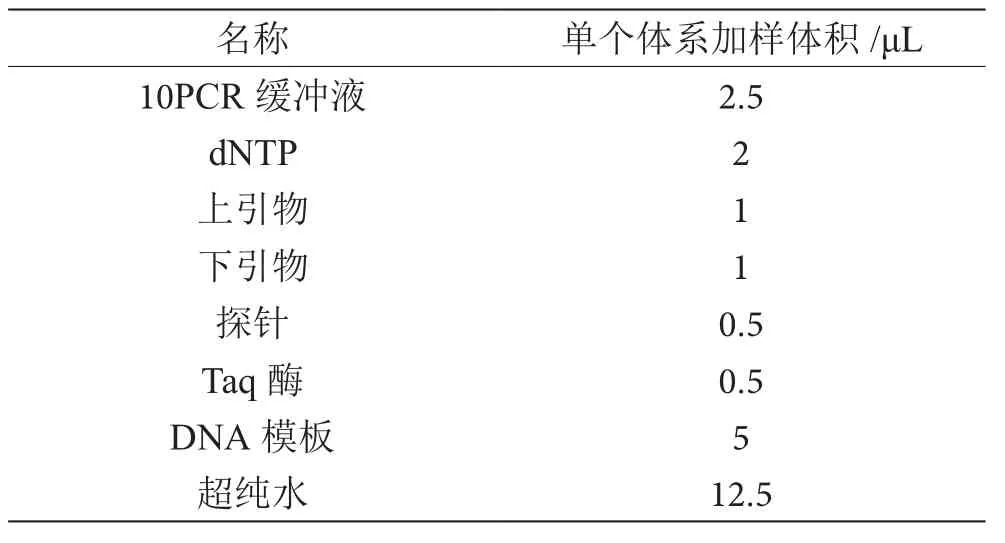
表1 实时荧光PCR反应体系表
1.3.5 实时荧光PCR反应程序
实时荧光PCR反应参数为:50 ℃/2 min,1个循环;95 ℃/10 min,1个循环;95 ℃/15 s和60 ℃/60 s,40个循环。
2 结果与分析
2.1 实时荧光定量PCR数据结果
实时荧光定量PCR数据结果见表2。由表2可知,阳性对照Ct值结果均小于30,阴性对照Ct值结果均小于30,PCR反应体系正常,结果有效。
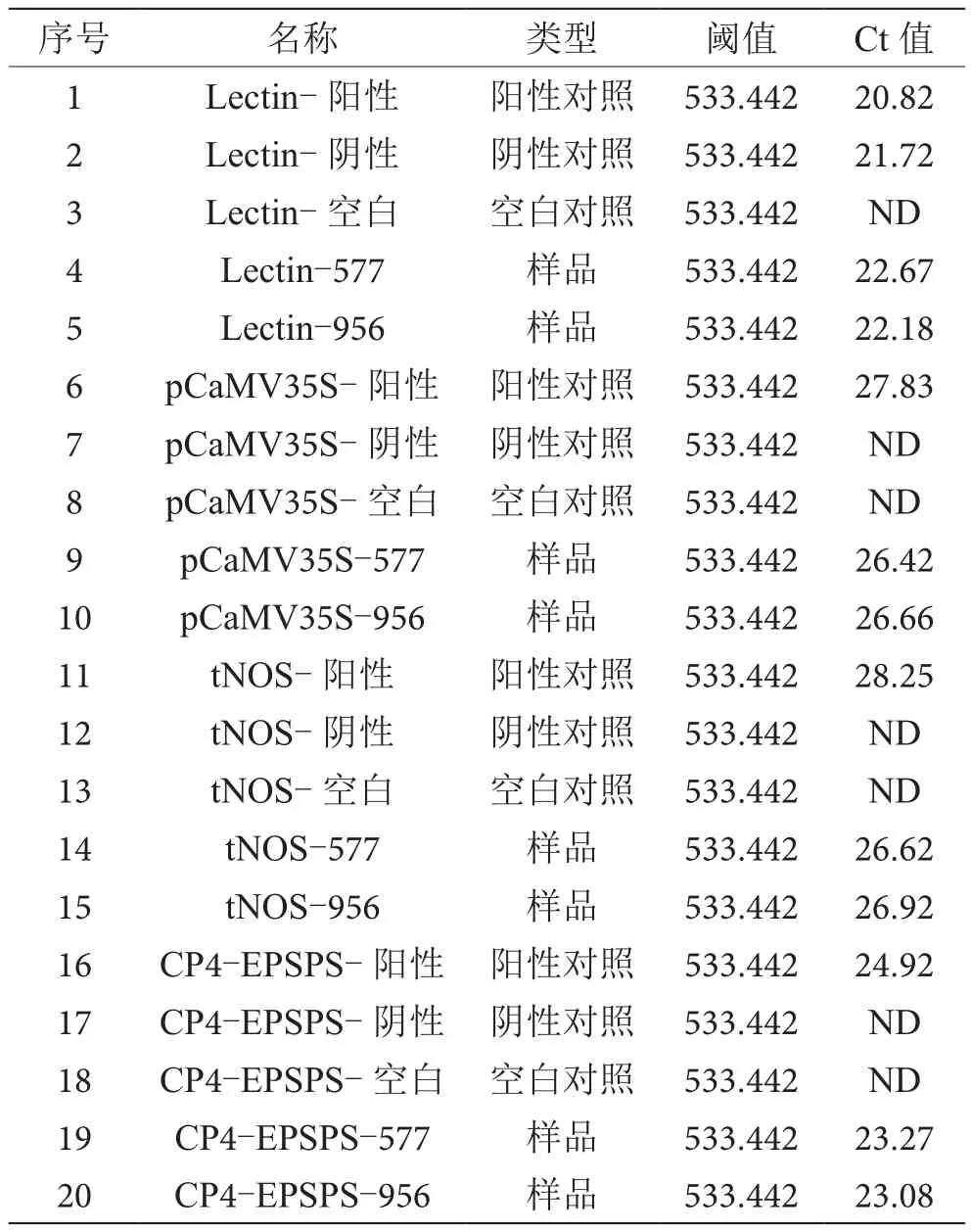
表2 实时荧光定量PCR数据结果表
2.2 样品Ct值
样品21-E577、21-F956 Ct分析结果见表3。由表3可知,编号为21-E577样品的内源基因lectin Ct值为 22.67,pCaMV35S Ct值为 26.42,tNOS Ct值为26.62,CP4-EPSPS Ct值为 23.27,编号为 21-F956样品的内源基因lectin Ct值为22.18,pCaMV35S Ct值为26.66,tNOS Ct值为 26.92,CP4-EPSPS Ct值为 23.08。
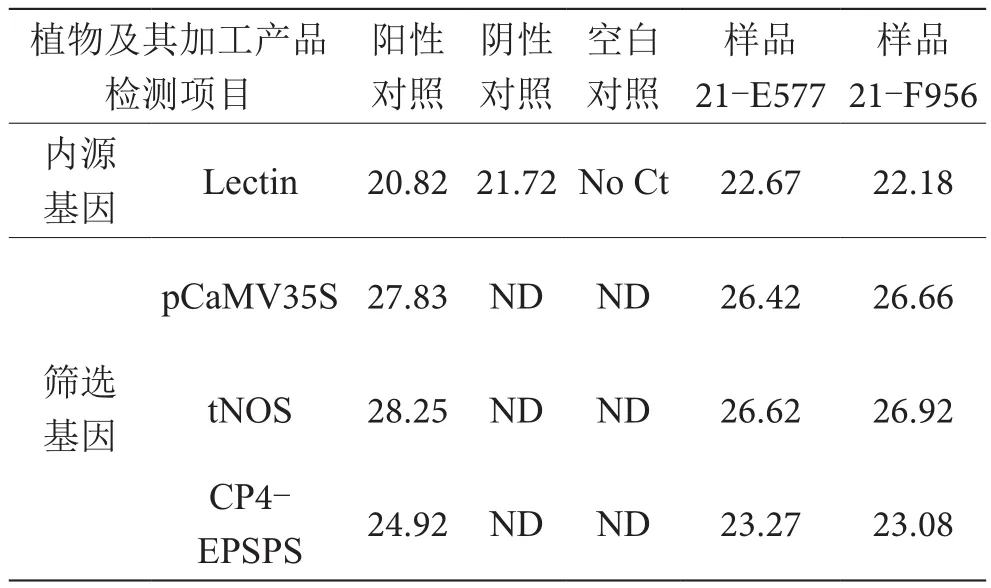
表3 样品分析Ct值
综合Ct值结果,依据SN/T 1204—2016标准中结果判定及表述,测试样品检测Ct值小于或等于36,内源基因检测Ct值小于或等于30,判定该样品含有所检基因或品系。判定21-E577检出lectin基因,检出pCaMV35S基因、tNOS基因和CP4-EPSPS基因。判定21-F956检出lectin基因,检出pCaMV35S基因、tNOS基因和CP4-EPSPS基因。
3 结论与讨论
本次能力验证取得满意结果,表明实验室已具备开展植物及其加工产品中转基因成分的检测能力。能力验证工作要求严格,需要检测人员不断提升自己的操作水平,不断积累检测经验。收到能力验证样品后,按照作业指导书要求室温保存。取样时按照要求取样,避免对环境造成污染。确保能力验证过程中所用到的设备状态正常,试剂中用到Taq酶,应提前开启制冰机,制冰后将所用的试剂放置冰盒中,保证试剂的有效性。配制体系应避免气溶胶污染,每个样品的处理均在生物安全柜内操作[5],实验人员做好防护措施,加样过程中注意移液器的使用,按照设定的顺序加样,绕开非目标管口,避免气溶胶逸散造成假阳性结果的出现,操作过后的生物安全柜应及时开启紫外灯进行消毒,避免核酸片段造成污染[6-7]。
综上,通过此次能力验证,实验室对大豆中转基因成分的实时荧光定量PCR检测方法有了更进一步的掌握和提升,对于食品转基因成分领域中的其他资质能力,本实验室会在后续的外部质量控制活动中积极寻求并主动参与,保证实验室在食品转基因成分的持续检测能力。
