食管肿瘤厚度联合中性粒细胞与淋巴细胞比值在诊断术前食管癌T4分期的临床价值
2022-11-20李婷婷
李 婷 婷
(福建医科大学附属第二医院 肿瘤放射治疗科 泉州 362000)
食管癌发病率高,预后较差。相较于欧美国家,我国食管癌病理类型以鳞癌为主[1]。2017年国际抗癌联盟-美国癌症联合会UICC-AJCC联合发布第8版食管癌TNM分期对于食管癌T分期是基于肿瘤侵犯深度[2]。对于T4食管癌考虑为初始不可切除,故术前诊断T4分期对于治疗方式选择及预后判断非常重要。胸部CT扫描、食管超声镜(EUS)是食管癌T分期常用的检查手段[3]。EUS对于食管癌侵犯深度诊断准确率高,但该检查具有侵入性,部分食管癌患者内镜无法通过管腔,且需警惕穿孔风险。胸部CT检查无创、无风险、痛苦少,但该检查灵敏度低。NLR、PLR是与全身炎症水平有关的指标。肿瘤患者NLR越高,肿瘤分期越晚、预后越差,可作为分期及预后预测指标[4]。因此,本研究探讨术前胸部CT测量食管肿瘤厚度联合NLR在诊断食管鳞癌患者T4分期的临床价值,为诊断食管鳞癌术前T4分期提供参考。
1 资料与方法
1.1 一般病人资料
选取2016年1月到2017年12月在规培医院福建省肿瘤医院胸部外科收治的361例食管鳞癌患者,研究经单位伦理委员会批准同意,患者或家属知情同意。性别:男性284例,女性77例;年龄:34-80岁,中位年龄57岁;病变部位:上段63例,中下段:298例;pT1、pT2、pT3、pT4期分别为40例、73例、206例、42例。pN0、pN1、pN2、pN3期分别为145例、90例、76例、50例。病理分期:I期30例,II期134例,III期197例;肿瘤分化程度:G1、G2、G3分别为58例、258例、45例;脉管癌栓侵犯情况:有:39例,无:322例。根据术后T分期,分为T1-3组及T4组。两组一般资料比较,差异无统计学意义 (P>0.05),具有可比性。
1.2 术前外周血NLR、PLR
术前1周当日清晨,采取所有患者空腹静脉血5ml,并进行血常规检测,检测血液中淋巴细胞、中性粒细胞、血小板计数。NLR为术前外周血中性粒细胞绝对值与淋巴细胞绝对值比值。PLR为术前外周血血小板绝对值与淋巴细胞绝对值比值。
1.3 CT扫描
应用东芝Asteion 螺旋CT进行检查,患者取仰卧位,双手抱头。平扫及增强CT扫描范围:颅底至第二腰椎。东芝螺旋CT扫描参数设置如下:层间距5mm;全电压120kVp;管电流230毫安。在Sun Ultra AW 4.0工作站进行图像重建(MPR),重建层厚为1mm。测量并记录横断面图像中食管肿瘤壁最厚区域的直径,并定义为食管肿瘤厚度。
1.4 统计学方法
所有记录的数据均采用SPSS22.0统计软件进行计算。受试者操作特征曲线(ROC)检测本研究中食管肿瘤厚度、NLR、PLR对诊断T4食管鳞癌预测价值,Spearman相关性分析指标相关性,计量资料采用 t 检验,单因素采用卡方检验,多因素分析采用二元Logistic回归分析。显著性检验采用双侧检验,P值小于0.05被认为有统计学意义。
2 结果
2.1 食管肿瘤厚度、NLR、PLR诊断T4食管鳞癌的灵敏度和特异度
采用ROC曲线得出CT测量食管肿瘤厚度、NLR、PLR在预测诊断食管肿瘤T4分期的最佳界值分别为:1.75cm,3.52,87.78,三者的灵敏度分别为:0.643,0.643,0.976;特异度分别为0.668,0.900,0.250;约登指数分别为0.311,0.543,0.227;AUC分别为0.704,0.811,0.685。
2.2 单因素及多因素分析
单因素分析显示脉管癌栓、食管肿瘤厚度 、NLR 、PLR对诊断食管鳞癌T4分期影响较大差异具有统计学意义(P<0.005)。多因素分食管肿瘤厚度 、诊断T4食管鳞癌的独立预测因子,具有统计学差异(P<0.005)。见表1。

表1 诊断为T4分期的多因素分析结果
2.3 T1-3组及T4组患者食管肿瘤厚度及NLR比较
T4组食管鳞癌患者的食管肿瘤厚度、NLR较T1-3组患者高,具有统计学差异(P<0.005)。见表2。
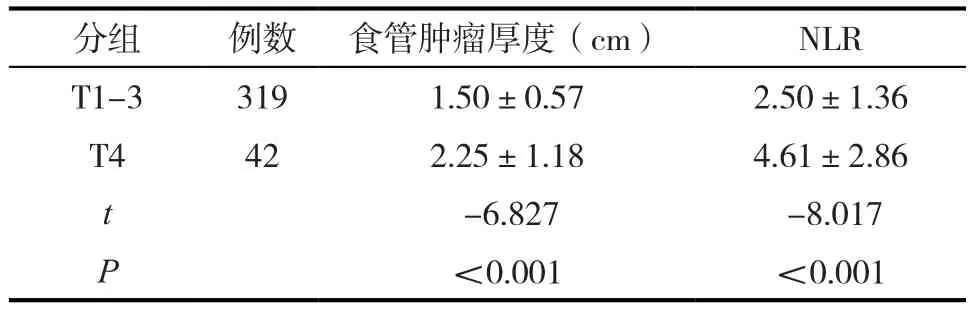
表2 361例患者不同T分期分组食管肿瘤厚度值、NLR比较
2.4 食管肿瘤厚度、NLR与T分期的相关性分析
食管肿瘤厚度、NLR与食管癌T分期呈正相关,具有统计学差异(P<0.005)。
2.5 食管肿瘤厚度、NLR对T4食管癌的预测价值
食管肿瘤厚度及NLR联合检测预测T4期食管鳞癌的AUC为0.873,诊断效能较食管肿瘤厚度及NLR单独检测T4期食管鳞癌高,差异具有统计学意义 (P<0.005)。见表3。

表3 食管肿瘤厚度、NLR对诊断T4分期的预测价值
3 讨论
食管癌发病率高,近年来随着手术、化疗、放疗、免疫治疗的不断进展,患者生存稍有提高,但预后仍较差,5年总生存仅维持30%左右[5]。对于早期食管癌,手术是首选治疗方式。对于局部晚期的食管癌,主要采取手术及化放疗联合的综合治疗。故术前准确临床分期对于食管癌诊疗方案选择非常重要[6]。
参照第8版食管癌NCCN指南,T分期主要参考肿瘤侵犯深度。对于术前T分期,目前常用的检查方法有胸部CT以及EUS检查。庞雄等[7]对比EUS、CT对于食管癌病理分期研究发现,EUS与CT对于食管T分期准确度分别为71.74%、75%; EUS和CT应该联合应用于食管鳞癌的分期。但EUS检查主观性强,穿透性差,尤其对于食管病灶范围较广过度狭窄,无法行内镜检查时存在较多局限性,且具有潜在穿孔风险,对于局部晚期食管癌的诊断存在较大的困难。
20 世纪 70 年代CT 逐渐应用于临床,使食管癌分期有了新的诊断依据标准。1981 年,Moss 首先提出以CT 所测食管壁厚作为分期标准。随后提出了具体的食管肿瘤厚度标准,以5mm,10mm,15mm为界及有无侵犯周围组织将T分期分为4期。而我国2009 年提出了非手术食管癌临床分期标准草案[8],分期草案依据肿瘤钡透长度、CT显示食管壁厚以及有无外侵进行T分期分级。大多数研究[9]表明CT测量食管肿瘤厚度对诊断T4食管鳞癌的预测准确率仅波动于66.27-75%之间,食管周围解剖结构的受侵诊断可能进一步提高T4分期的准确性。我们的研究表明CT测量的食管肿瘤厚度对T4食管癌患者诊断的灵敏度亦较低,故在安全、方便、痛苦小的检查基础上提高T4食管鳞癌诊断的准确性,是临床亟需解决的问题。
许多体内外研究表明全身炎症反应通过增加原发肿瘤侵袭范围,促进肿瘤远处转移及调整机体免疫系统,显著影响胃癌、结直肠癌、食管癌、肾癌、乳腺患者预后。具体机制为中性粒细胞升高时,抑制淋巴细胞介导的免疫反应,引起NLR显著升高,促进肿瘤细胞的生长及转移[10]。肿瘤细胞在分泌相关细胞因子,促进血小板激活,引起PLR升高,聚集成瘤栓,逃逸免疫系统的监察,促进肿瘤及侵犯及转移。本研究主要探讨术前食管肿瘤厚度、NLR及两者联合对食管鳞癌术前T4分期的预测价值,为术前T4分期诊断提供依据。外周血抽取简单、安全、经济性高,可重复性高,可靠,故外周血NLR、PLR作为检测指标,广泛应用于癌症患者全身炎症反应判断。吴风华等人[11]研究发现NLR与临床分期呈现正相关性,NLR越高,临床分期越晚,差值具有统计学意义。我们的研究也获得类似结果,同时NLR预测T4食管鳞癌的ROC曲线下面积 (AUC)为0.811,亦具有较高的预测价值。考虑食管肿瘤厚度及NLR单独用于T4食管鳞癌预测价值均有限,故本研究将食管肿瘤厚度及NLR进行联合,结果显示,联合指标的AUC为0.873,较CT厚度及NLR单独检测T4食管癌高,具有较高的预测价值(P<0.001)。食管肿瘤厚度联合NLR可作为T4食管鳞癌预测指标,为食管鳞癌术前T分期提供一定理论支持。本研究存在的不足之处在于研究样本量较小。同时作为回顾性分析,选择偏倚不可避免,后续仍需要加大样本量或是设计前瞻性实验进行进一步验证。
综上所述,食管肿瘤厚度联合NLR可有效提高T4食管鳞癌的诊断准确性,对术前诊断食管鳞癌T4分期有较高预测价值,但仍需更大样本量试验进一步证实该结果。
