牛樟芝胞外多糖抗氧化能力以及体外消化特性
2022-11-19梁丽红李辉关莹杰李哲远杨晓辰张汇王光强熊智强艾连中夏永军
梁丽红,李辉,关莹杰,李哲远,杨晓辰,张汇,王光强,熊智强,艾连中,夏永军
(上海理工大学 健康科学与工程学院,上海食品微生物工程技术研究中心,上海,200093)
牛樟芝(Antrodiacamphorata)又名牛樟菇、樟菇、窟内菰、神明菇,属多孔菌目(Polyporales),是一种原产于台湾牛樟树的,具有强烈樟香味的药食两用真菌。目前已从牛樟芝中分离得到70多种成分,包括三萜、多糖、氨基酸、二萜脂肪酸和类固醇等[1]。由于野生牛樟芝子实体生长极为缓慢且数量稀少,目前多采用液态发酵、固态发酵以及椴木培养等人工培养方式。
真菌多糖是一类从各种真菌子实体、菌丝体以及发酵液中提取得到的大分子聚合物,因其具有免疫调节[2]、抗氧化[3]、抗癌活性[4]等作用而受到广泛关注。近年来针对牛樟芝多糖的研究大多集中在其结构特性和生理活性方面,而对其消化特性研究较少。WANG等[5]从牛樟芝菌丝体细胞壁中分离得到4种中性多糖AC-MHW、AC-MCA、AC-MHA和AC-MAI,其中AC-MHW、AC-MCA因其更高含量的β-1,3-D-葡萄糖残基而具有较强体外抗氧化活性;LEE等[6]发现ZnSO4的富集能够有效提高牛樟芝多糖产量,并抑制脂多糖诱导的RAW264.7巨噬细胞炎症,并选择性阻断pAKT、pERK 和p38表达,同时有效抑制肺腺癌细胞H1957增殖;ZHANG等[7]发现牛樟芝多糖通过阻断TOP1/TDP1介导的DNA修复途径有效抑制宫颈癌HeLa细胞增殖并诱导其凋亡。
然而部分多糖对唾液-胃肠道环境极为敏感,其分子质量、化学成分、结构和生物活性可能会在消化过程中受到pH值、胆汁盐和消化酶的影响而发生改变[8]。能够到达大肠而不被人体消化酶消化的多糖则进入远端肠道组织被肠道微生物分解利用,产生短链脂肪酸(short chain fatty acids,SCFAs)等代谢产物,改善肠道健康[9]。LUO等[10]提取并研究了核桃壳多糖的体外消化特性,发现其在胃肠道消化过程中被水解为较小的糖片段。但CAO等[11]发现超声微波处理的紫菜多糖不被唾液、胃液、小肠液消化降解,而被肠道微生物利用,提高拟杆菌相对丰度、降低志贺氏菌相对丰度。一般来说,多糖复杂的结构是其发挥生物学功能的重要基础,一旦结构被降解,多糖的生理活性就会降低甚至完全消失。因此有必要研究牛樟芝胞外多糖在消化道及远端肠道中的消化和酵解特性。
课题组前期研究显示添加油类溶剂(植物油、油酸、油醇等)进行萃取发酵能够显著提高牛樟芝菌体生物量及胞内化合物产量[12]。真菌胞外多糖的产量与菌体量有着密切的联系,因此,本研究将考察油性溶剂萃取发酵对牛樟芝液态发酵产胞外多糖的影响,并对牛樟芝胞外多糖抗氧化性以及体外消化特性进行研究,为牛樟芝生物活性的进一步研究和应用提供参考。
1 材料与方法
1.1 菌株
牛樟芝菌株(Antrodiacamphorata)S-29为上海食品生物技术研究所分离所得,保藏于中国普通微生物细菌保藏管理中心,保藏编号为CGMCC 9590。
1.2 实验材料
葡萄糖、大豆蛋白胨、玉米浆、MgSO4·7H2O、KH2PO4、无水柠檬酸、油酸、油醇、人工唾液、人工胃液、人工肠液等,上海源叶生物科技有限公司;植物油,丰益贸易(中国)私人有限公司;三氯乙酸、无水乙醇,阿拉丁试剂有限公司。
1.3 仪器与设备
ML204分析天平,瑞士Mettler Toledo公司;ZAZY-B8型摇床,上海知楚仪器有限公司;KBF240型恒温恒湿培养箱,德国Binder公司;Avanti JXN-26高速冷冻离心机,美国贝克曼库尔特公司;OSB-2100型旋转蒸发仪,日本EYELA公司;HPSEC-MALLS多角度激光光散射仪,美国Wyatt Technology公司;ICS-5000+高效阴离子交换色谱仪,美国Thermo公司;7890B-7000D气相色谱-三重四级杆质谱仪,美国Agilent公司。
1.4 培养基及培养方法
牛樟芝接种于斜面培养基:葡萄糖40 g/L,豆浆60 mL/L,MgSO4·7H2O 0.5 g/L,KH2PO40.5 g/L,无水柠檬酸0.5 g/L,琼脂20 g/L,pH=5。
种子液(g/L):葡萄糖20,玉米浆2,大豆蛋白胨3, MgSO4·7H2O 0.5,KH2PO40.5,无水柠檬酸 0.5,pH=5,接种量10%(体积分数,下同),150 r/min、28 ℃培养5 d。
发酵液(g/L):葡萄糖60,玉米浆4,大豆蛋白胨5, MgSO4·7H2O 0.5,KH2PO40.5,无水柠檬酸0.5,pH=6,接种量15%,150 r/min、28 ℃培养12 d。
1.5 牛樟芝胞外多糖的提取
发酵12 d后,抽滤弃菌体,用旋转蒸发仪将发酵液浓缩至原体积的1/4,加入三氯乙酸至4%(体积分数),4 ℃放置10~12 h去除蛋白质,用3倍体积无水乙醇沉淀多糖,9 000 r/min离心15 min取沉淀,加去离子水复溶后于4 ℃透析72 h,冻干后得到牛樟芝胞外多糖。
1.6 萃取剂种类的选择
500 mL锥形瓶装液量100 mL,在发酵第4天分别加入20 mL油酸、油醇、植物油3种萃取剂,以多糖产量及菌体生物量为标准确定最适合的萃取剂。
1.7 牛樟芝胞外多糖基本组成的测定
总糖含量采用苯酚-硫酸法[13]进行测定;总蛋白含量采用考马斯亮蓝法[14]测定;总糖醛酸含量采用间羟基联苯比色法[15]测定。
1.8 牛樟芝胞外多糖分子质量和单糖组成的测定
高效尺寸排阻色谱(high performance size exclusion chromatography,HPSEC)用于测定多糖样品的分子质量,该仪器配备了示差折光检测器,串联SB-803 HQ和SB-805 HQ色谱柱。以0.1 mol /L NaNO3水溶液为流动相,多糖样品用上述流动相配成1 mg/mL溶液,系统温度40 ℃,流速0.5 mL/min。
采用Thermo ICS-5000+高效阴离子交换色谱串联脉冲安培检测器(high-performance anion-exchange chromatography with pulsed amperometric detection,HPAEC PAD)分析多糖样品的单糖组成。样品处理:称取10 mg样品,加入0.5mL 12 mol/L H2SO4溶液搅拌均匀后加入2.5 mL超纯水稀释,105 ℃加热2 h,冷却至室温后稀释100倍待用。色谱柱为串连保护管柱(3 mm×30 mm)的CarboPacTMPA20(3 mm×150 mm)。进样量25 μL;洗脱条件为:20 mmol/L NaOH 20 min,然后提高醋酸钠浓度梯度50~200 mmol/L 10 min;流速0.5 mL/min;管柱温度30 ℃。采用Chromeleon 7软件进行数据采集、处理和分析。经对照8种单糖标准品的洗脱尖峰和标准检量线进行样品单糖组成的定性和定量分析。
1.9 体外抗氧化性实验

参照文献[16]的方法并稍作改动。准确称取0.126 1 g邻苯三酚,用10 mmol/L HCl溶液溶解并定容至100 mL;吸取0.1 mL不同浓度的多糖样品,加入1.8 mL Tris-HCl缓冲液(50 mmol/L,pH=8)和2 mL去离子水,室温反应20 min,再加0.1 mL邻苯三酚溶液,室温反应4 min后在325 nm处测吸光值,以同浓度抗坏血酸为阳性对照,按公式(1)计算。

(1)
式中:As,反应液的吸光值;Ab,去离子水代替邻苯三酚反应液的吸光值;A0,去离子水代替样品的吸光值。
1.9.2 ·OH清除率的测定
参照Fenton反应体系[17]并稍作改动。吸取1 mL不同浓度多糖样品,加入2 mL FeSO4溶液(1.5 mmol/L)、0.6 mL水杨酸溶液(20 mmol/L)和1.4 mL H2O2(3%)溶液,室温反应30 min后在510 nm处测吸光值,以同浓度抗坏血酸为阳性对照,按公式(2)计算。
(2)
式中:As,反应液的吸光值;Ab,去离子水代替 H2O2反应液的吸光值;A0,去离子水代替样品的吸光值。
1.9.3 DPPH自由基清除率的测定
参考文献[18]的方法并稍作改动。吸取2 mL不同浓度多糖样品,加入1 mL 0.02 mmol/L DPPH-乙醇混合液,室温反应30 min后在517 nm处测吸光值,以同浓度抗坏血酸为阳性对照,按公式(3)计算。
(3)
式中:As,反应液的吸光值;Ab,去离子水代替DPPH-乙醇反应液的吸光值;A0,去离子水代替样品的吸光度。
1.10 牛樟芝胞外多糖的体外消化及粪便酵解特性
1.10.1 体外消化
1.10.1.1 体外模拟消化系统的建立
参考文献[19]方法并稍作改动,将AC-2溶液(2 mg/mL)与模拟唾液混合,置于37 ℃,120 r/min摇床,在0、2、4、6 h分别取样,100 ℃水浴灭活酶5 min;唾液消化后,将模拟胃液加入混合液,置于37 ℃,120 r/min摇床,在0、2、4、6 h分别取样;用NaHCO3调节胃消化液pH至6.8,加入模拟肠液,置于37 ℃,120 r/min摇床,在 0、2、4 和6 h分别取样,-80 ℃保存待用。
1.10.1.2 总糖及还原糖的测定
总糖含量采用苯酚-硫酸法[13]进行测定;还原糖含量测定采用3,5-二硝基水杨酸比色法[20]。
1.10.1.3 分子质量的测定
将体外消化后的消化溶液加入3倍体积无水乙醇沉淀多糖,去离子水复溶,4 ℃透析72 h,冻干得到不同的消化样品。按1.8的方法测定。
1.10.2 体外酵解
1.10.2.1 发酵培养液的制备
参考文献[21]的方法并稍作改动。2 g蛋白胨,2 g酵母提取物,0.5 g半胱氨酸,0.1 g NaCl,2 g NaHCO3,0.04 g K2HPO4,0.04 g KH2PO4,0.01 g MgSO4·7H2O,0.01 g CaCl2·6H2O,0.01 g血红素,0.5 g牛胆盐,2 mL吐温80,10 μL 维生素K,1 mL 1%刃天青,去离子水定容至1 L。
1.10.2.2 体外酵解模型的建立
随机选取3名志愿者的粪便样本5 g装入无菌离心管,加入50 mL 10%生理盐水混合,搅拌均匀后离心(500 r/min、4 ℃、5 min)取上清液得粪便菌悬液,放入厌氧瓶待用。空白组取90 mL发酵培养液加10 mL粪便菌悬液;实验组取90 mL 10 mg/mL AC-2培养液加10 mL粪便菌悬液;阳性对照组取90 mL 10 mg/mL菊糖培养液加10 mL粪便菌悬液。各组用牛皮纸封口后至于37 ℃厌氧培养箱中启动发酵,在0、6、12、24 h分别取样,离心(9 000 r/min、4 ℃、10 min)后收集上清液,-80 ℃保存待用。
总糖及还原糖含量测定方法参照1.10.1.2, 取发酵上清液5 mL,使用pH计测定pH值。
1.10.2.3 SCFAs含量测定
采用GC-MS对体外酵解样品中乙酸、丙酸、丁酸及总SCFAs含量进行测定,配备毛细管柱和氢火焰电离检测器(flame ionization detector,FID)。操作条件如下:载气(N2)的流速为19 mL/min,初始柱温在100 ℃下保持1 min,然后以4 ℃/min的速率升高至180 ℃,注射器和检测器的温度保持在250 ℃,空气、N2和H2分别以260、30和30 mL/min的流速用作补充气体。
1.11 统计学分析
实验重复3次,采用SPSS 17.0统计软件分析,结果以均值±标准偏差表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果与讨论
2.1 发酵萃取剂对牛樟芝胞外多糖产量及菌体量影响
如图1所示,实验采用的3种油性发酵萃取剂均能够有效提高胞外多糖产量和菌体量。与对照组相比,油酸的促进作用最为显著,胞外多糖产量和菌体生物量分别提高了178.67%、128.15%,达到236.42 mg/mL和14.67 g/L。因此,后续实验采用油酸作为发酵萃取剂。油酸、油醇、植物油等油性溶剂是良好的氧载体,能够显著提高发酵液中的溶氧水平,富集发酵液中的代谢产物,减少产物对菌体的抑制作用,并提高菌体生物量[22]。生物量的提高有利于发酵液中胞外多糖的积累,是一种有效提高胞外多糖产量的方法。
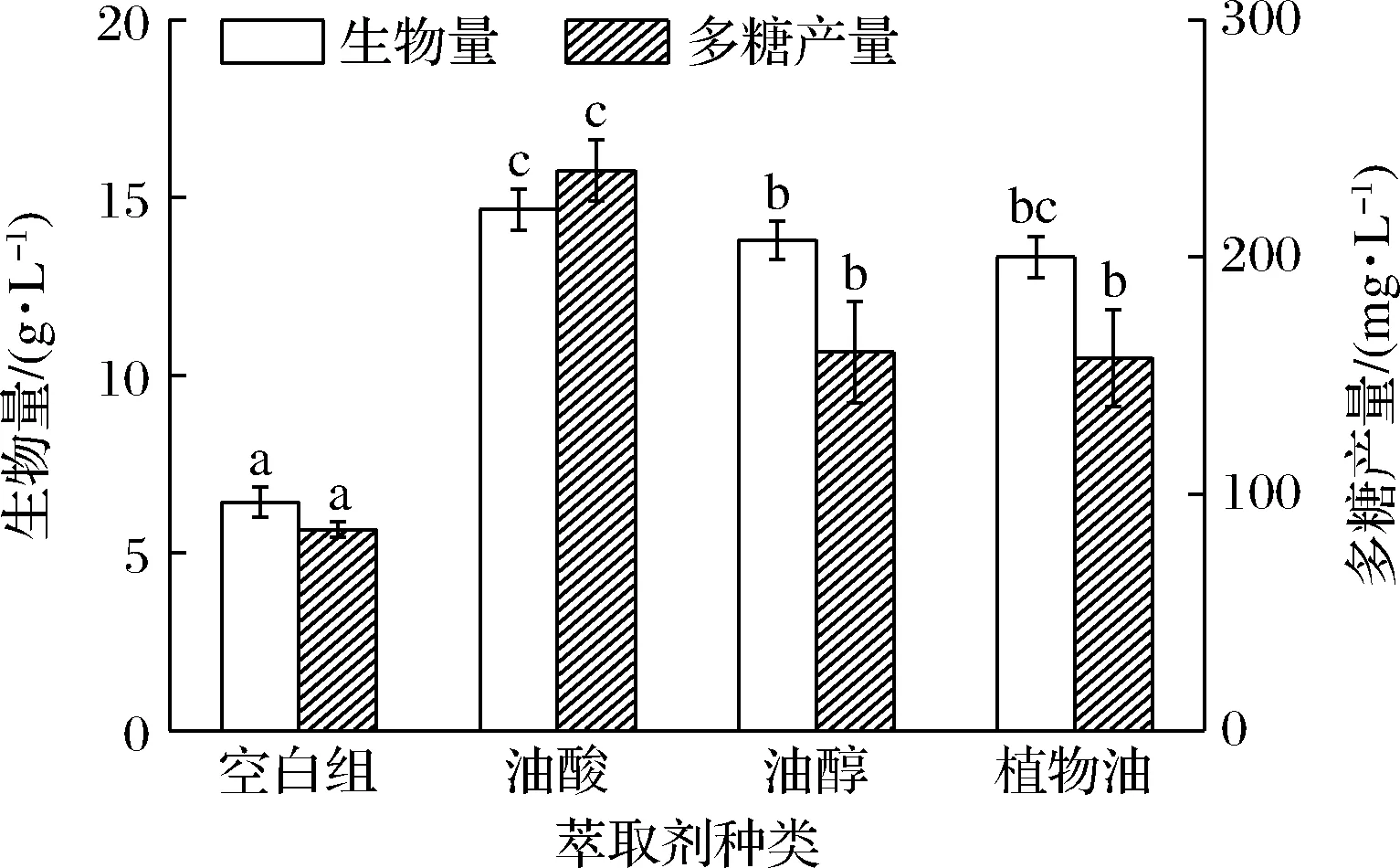
图1 萃取剂对多糖产量和菌体生物量的影响Fig.1 Effect of extractant on exopolysaccharides yield and biomass注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 牛樟芝胞外多糖的基本化学组成
如表1所示,发酵过程中油酸的添加对多糖基本化学组成的影响较小。常规发酵组得到的胞外多糖AC-1中总糖含量为85.24%,蛋白质含量为1.91%;油酸萃取发酵组得到的胞外多糖AC-2中总糖含量为90.01%,蛋白质含量为4.01%。

表1 牛樟芝胞外多糖的基本化学组成Table 1 Basic chemical compositions of Antrodia camphorata exopolysaccharides
2.3 牛樟芝胞外多糖的分子质量和单糖组成
利用HPSEC对2种胞外多糖进行分析,结果如图2-a所示,2种多糖均为单一组分,且分子质量接近,分别为26.85、23.07 kDa,说明牛樟芝S-29液态发酵产生的胞外多糖为小分子质量单一组分,经过简单的纯化过程,就能得到较高纯度的多糖,这有利于胞外多糖的大规模分离和制备。
利用HPAEC对2种胞外多糖的单糖组成进行分析,结果如图2-b所示,AC-1、AC-2的HPAEC图共出现4个峰,通过与标准品对比,从左到右依次为岩藻糖、半乳糖、葡萄糖、甘露糖,物质的量比分别为0.09∶1∶0.48∶0.24和0.09∶1∶0.49∶0.27,说明AC-1与AC-2在单糖组成方面的差异较小。

a-HPSEC图;b-HPAEC图图2 AC-1、AC-2的分子质量和单糖组成Fig.2 Molecular weight and monosaccharide compositions of AC-1, AC-2注:1-岩藻糖;2-半乳糖;3-葡萄糖;4-甘露糖
2.4 牛樟芝胞外多糖的抗氧化性
真菌多糖是一种有效的天然抗氧化剂,可用于清除体内超氧化物自由基及 ·OH等[23]。一般来说,低分子质量多糖具有更高的抗氧化性[24],这是由于它们含有更多的还原性羟基末端,更易接触并消除自由基。对AC-1和AC-2的抗氧化性进行探究,结果如图3所示。

清除率;b-·OH清除率;c-DPPH自由基清除率图3 牛樟芝胞外多糖的抗氧化活性Fig.3 Antioxidant activity of A. camphorata exopolysaccharides
2.5 牛樟芝胞外多糖AC-2的体外消化及酵解特性分析
2.5.1 人唾液-胃肠道消化液对牛樟芝胞外多糖AC-2的影响
多糖生物活性的表达与其结构密切相关[24]。多糖经口服摄入及胃肠道消化液的作用后,其分子质量与结构可能发生较大改变,甚至降解。由于AC-2具有更高的抗氧化活性,本实验通过体外模型进一步考查AC-2在唾液、胃液、胃肠液中的稳定性。如表2所示,在唾液消化过程中,分子质量和还原糖含量无显著变化,表明AC-2在唾液中没有被降解;在胃液消化2 h期间分子质量和还原糖无显著变化,而消化4 h后,还原糖含量显著上升至0.23 mg/mL,然后保持稳定,但分子质量没有发生明显变化;模拟肠道消化出现类似的趋势,消化6 h后还原糖含量显著增加。这与LI等[25]的研究结果类似,即来自沙嵩种子的多糖在体外模拟消化过程中还原糖含量显著上升,而分子质量没有出现显著变化。
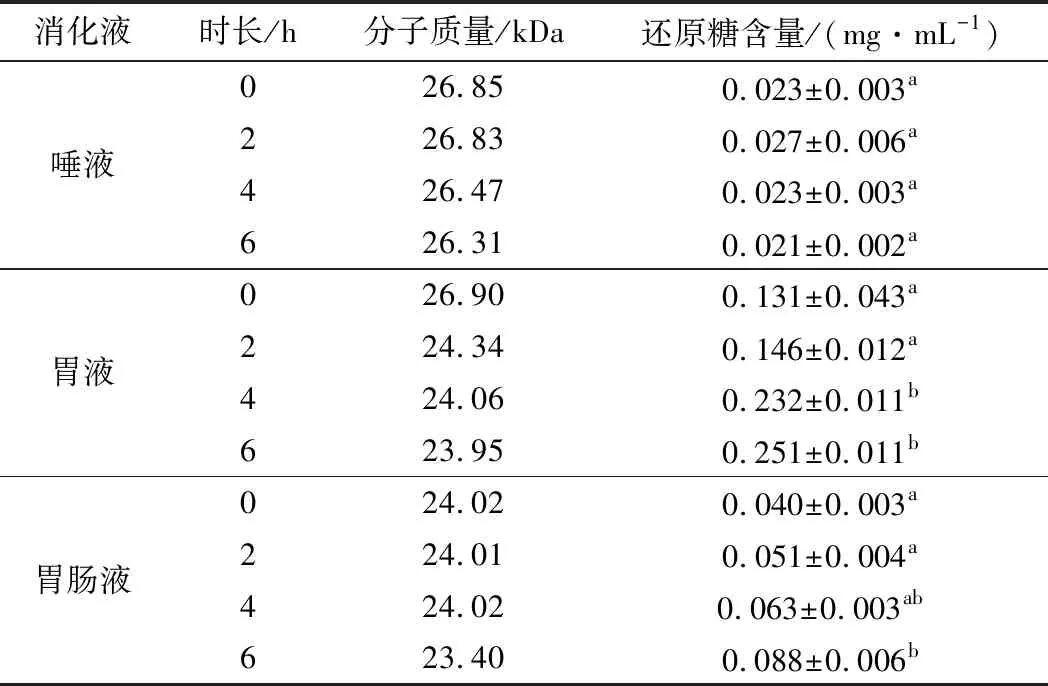
表2 消化过程中分子质量及还原糖含量的变化Table 2 Changes in molecular weight and reducing sugar content during digestion
由图4可知,在唾液、胃液、胃肠液消化的不同时间点,AC-2的HPSEC色谱图中各峰的保留时间以及峰形基本类似,这说明多糖在体外模拟消化过程中没有实质性变化,能够保持原有结构特征进入远端肠道组织。

a-模拟唾液消化;b-模拟胃液消化;c-模拟胃肠液消化图4 消化过程中HPSEC色谱图Fig.4 HPSEC chromatogram during the digestion process
2.5.2 肠道菌群对牛樟芝胞外多糖的影响
2.5.2.1 总糖及还原糖的变化
由于缺乏分解复杂碳水化合物的酶,经口服摄入的多糖主要由人体肠道微生物编码的碳水化合物活性酶分解并利用。总糖含量及还原糖含量的变化是肠道微生物利用碳源发酵过程中最直观的指标之一。由图5-a可知,在空白组中仍含有少量糖类物质,含量为0.64 mg/mL,而在24 h时,总糖含量没有出现显著下降;在AC-2与菊糖组中,总糖含量随着发酵过程的进行由最初的6.7和7.05 mg/mL显著下降至4.26和3.81 mg/mL,其碳水化合物消耗率分别为36.42%和45.96%。由图5-b可知,空白组还原糖在0~24 h没有显著变化;AC-2组与菊糖组还原糖含量均在6 h时达到最高,分别为0.20和0.36 mg/mL,说明AC-2能够被肠道微生物降解并形成新的还原性末端;在6~24 h内还原糖含量显著下降,这归因于肠道微生物对还原糖的利用。以上结果表明AC-2与菊糖均可被肠道微生物利用,且在6 h时降解速度最快,但AC-2的降解程度较低。
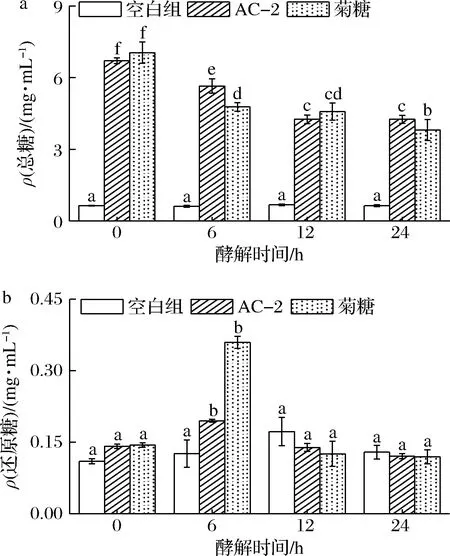
a-总糖;b-还原糖图5 酵解过程中总糖及还原糖含量变化Fig.5 Changes in the total sugar and reducing sugar content during fermentation
2.5.2.2 酵解液pH
多数活性多糖被肠道微生物降解和利用后,会产生酸性物质,降低肠道中的pH环境。由图6可知,各组在模拟发酵初始阶段pH无显著性差异;在发酵开始后6 h时,各组pH均出现显著下降;但在发酵6 h后,空白组pH不再下降,这是由于发酵液中缺乏足够的碳源;而AC-2组与菊糖组pH持续下降,在24 h时,AC-2组降至6.08,菊糖组降至4.26。这说明肠道微生物在发酵过程中利用AC-2与菊糖产生了酸性物质。
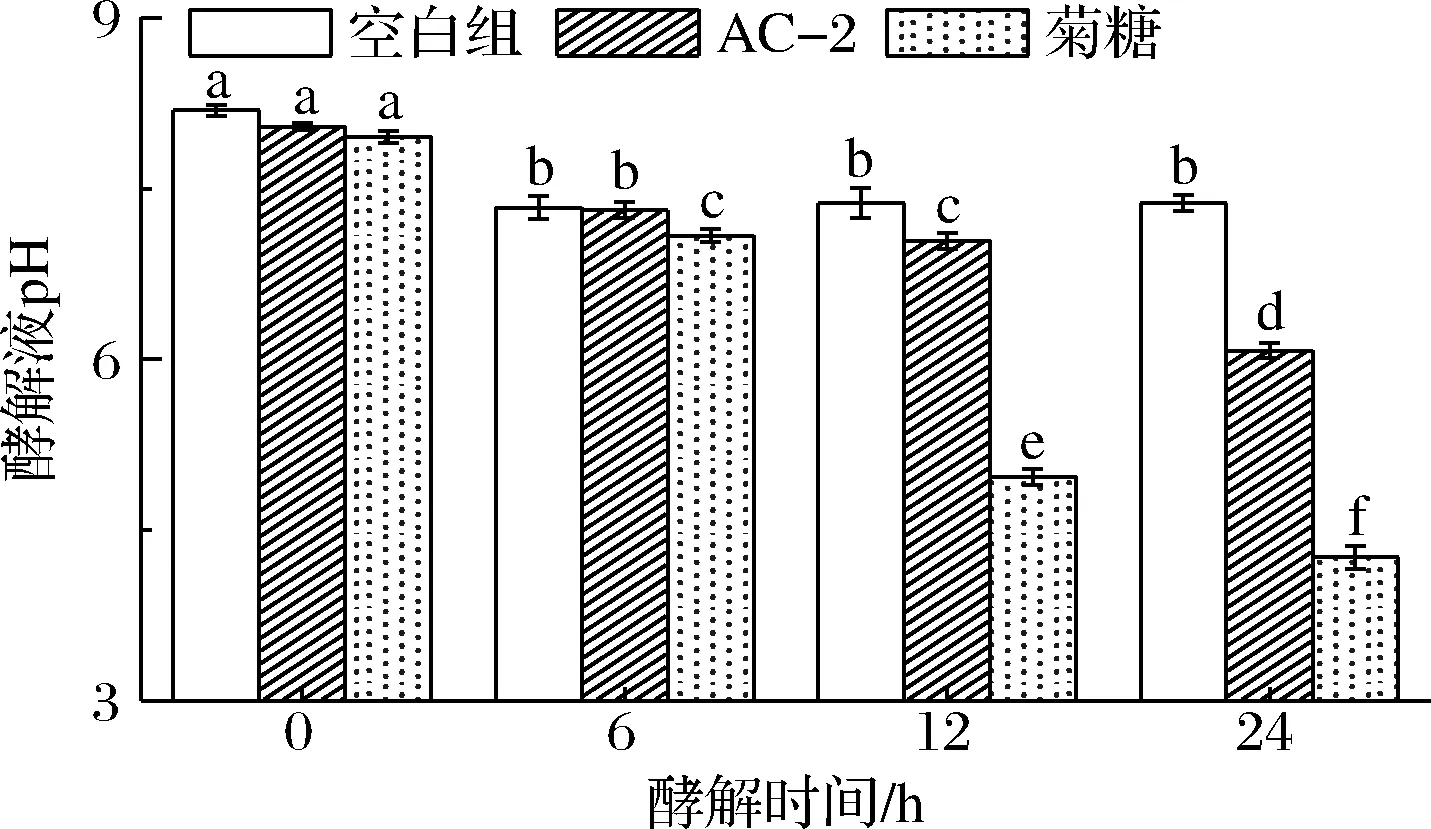
图6 酵解过程中pH的变化Fig.6 Changes in pH during fermentation
2.5.2.3 酵解过程中SCFAs含量
SCFAs是肠道微生物在利用多糖进行发酵时产生的主要酸性物质,可作为肠上皮细胞的直接能量来源,从而改善宿主肠道健康[26]。因此对发酵过程中各阶段SCFAs的含量进行测定。由图7可知,发酵24 h后,AC-2组总SCFAs含量达到165.28 μg/mL,比菊糖组(145.28 μg/mL)的提升效果更高,说明与菊糖相比,尽管AC-2降解程度较低,但更有利于肠道微生物发酵产生SCFAs。在脂肪代谢和糖异生过程中,乙酸是一种信号分子,丙酸参与肝脏中脂肪酸的生成,丁酸是一种重要的能量来源[11],在发酵24 h后,AC-2组的乙酸、丙酸、丁酸含量分别为76.83、27.5、16.03 μg/mL,始终高于空白组,这与长根菇多糖[8]、江蓠多糖[9]和沙嵩种子多糖[25]的体外实验结果一致。综上所述,AC-2具有促进肠道微生物产生SCFAs的益生元潜力。

a-乙酸;b-丙酸;c-丁酸;d-总SCFAs图7 酵解过程中SCFAs含量的变化Fig.7 Changes in the content of SCFAs during fermentation
3 结论
本实验采用原位萃取发酵技术进行牛樟芝液态发酵,油酸的添加能够显著提高牛樟芝菌体生物量以及胞外多糖产量,分别达到14.67 g/L和236.42 mg/mL。进一步分析显示添加油酸发酵与对照组所产的胞外多糖基本组成、分子质量与单糖组成相似,但是油酸发酵的多糖AC-2具有更好的自由基清除能力。通过建立体外模拟消化系统发现牛樟芝胞外多糖AC-2是一种稳定性良好,不被胃肠道特殊pH条件以及相关消化酶降解的小分子多糖;粪便发酵实验表明AC-2能够被肠道微生物部分降解,并有效提高总SCFAs含量至165.28 μg/mL。本研究为牛樟芝的人工培养及其胞外多糖生物活性的研究和应用提供理论依据和数据支持,具有较好的参考价值。
