响应面优化超声辅助酶法提取石榴皮多糖的工艺
2022-11-18陈红玲徐蓓蓓武进雨赵苏源
程 朗,陈红玲,徐蓓蓓,武进雨,赵苏源
(宿州学院生物与食品工程学院,安徽宿州 234000)
0 引言
石榴果实美味可口,含有丰富的营养成分,石榴的根、花、果实、果皮、种子等均可作为药材[1],石榴皮具有涩肠止泻、止血、驱虫等一些药理作用[2],石榴皮中含有丰富的化学成分,主要有鞣质、没食子酸、黄酮类及多糖类物质,含有生物碱、甾类、蛋白质类化合物等[3]。石榴皮多糖具有生物活性免疫调节[4]、抗肿瘤[5]、抗菌抗病毒[6]等临床医学作用,还有降血脂、降血糖[7]、保护肝脏等保健作用。石榴皮中黄酮、多酚类物质研究较为广泛,如研究总黄酮[8]、多酚含量[9]及抗氧化能力等。然而,关于优化多糖提取过程的报道却很少。其中,安徽怀远生产的石榴最为出名[10],每年有大量石榴及相关制品产出,因此会产出大量的石榴皮渣和石榴种子等副产品,为避免资源浪费,可充分利用被丢弃的石榴皮进行深入研究。采用响应面优化石榴皮多糖提取工艺,最终能够有效地提高石榴皮多糖得率,为开发利用石榴皮提供试验依据,提高石榴皮资源的利用价值。
1 材料与仪器
1.1 试验材料
怀远石榴,购自安徽怀远县当地水果市场。
试剂:纤维素酶、果胶酶、葡萄糖标准溶液,上海源叶生物科技有限公司提供;无水乙醇、氢氧化钠、蒽酮、浓硫酸、均为国产分析纯,国药集团提供。
1.2 试验仪器
XM-250UVF 型超声波清洗机,小美超声仪器昆山有限公司产品;Multiscan Go 型多功能酶标仪,美国Thermo 公司产品;1706 型高速台式冷冻离心机,德国Hettich 公司产品;JRA-6 型数显恒温水浴锅,金坛市杰瑞尔电器有限公司产品;BSA124S 型电子天平,北京赛多利斯科学仪器有限公司产品;pH818型pH 计,希玛仪表产品。
2 试验方法
2.1 工艺流程
称取石榴皮粉末→称取纤维素酶、果胶酶→加入蒸馏水→调节pH 值→复合酶解提取→灭酶(80℃,15 min)→超声辅助处理→离心取上清液(转速5 500 r/min,时间10 min)→4 倍量醇沉→低温静置过夜→离心(转速5 500 r/min,时间10 min)→取沉淀得到多糖待测品[16]。
2.2 操作要点
①酶解。称取1 g 石榴皮粉,加入复合酶0.3 g(纤维素酶与果胶酶之比为1∶1),根据不同料液比,加入不同量的蒸馏水,用1 mol/L 氢氧化钠调节pH 值至6,放置在50 ℃水浴中酶解。②灭酶。在80 ℃水浴中灭酶15 min。③超声。根据设定的不同超声时间、温度、功率,放至超声清洗机里进行超声处理。④测糖。对超声处理液进行离心处理,取上清液,加入4 倍量体积的80%乙醇溶液,4 ℃下过夜,离心取沉淀,最后用蒸馏水溶解沉淀,采用蒽酮-硫酸法测糖的含量。
2.3 多糖含量的测定
结合蒽酮-浓硫酸法[11]测定初始提取物中多糖含量。标准曲线的绘制:精密量取1 mg/L 标准葡萄糖溶液0.2,0.4,0.6,0.8,1.2,1.6 mL 分别置于试管中,加蒸馏水至2 mL,从中移取1 mL 置具塞比色管中,分别加入2 mg/mL 蒽酮-硫酸溶液(现用现配)1 mL,混匀,沸水浴10 min,冰水浴冷却至室温,在波长620 nm 处测吸光度。横坐标、纵坐标分别为葡萄糖浓度和吸光度,以此绘制标准曲线[12]。得到标准曲线线性回归方程为Y=0.008 1X+0.082 7,相关系数R2=0.996 7。
多糖得率的测定:取1 mL 经稀释后的多糖溶液,按照上述方法,反应完成后,于波长620 nm 下进行吸光度的测定,代入标准曲线方程,计算多糖得率[13]。
葡萄糖标准曲线见图1。
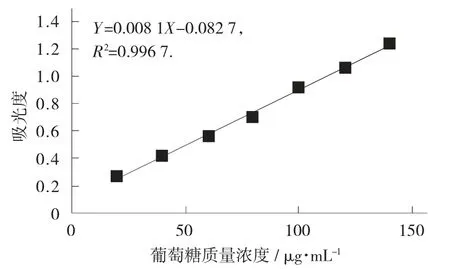
图1 葡萄糖标准曲线
2.4 单因素试验设计
2.4.1 不同料液比对多糖得率的影响
称取1 g 石榴皮粉,按照不同料液比(1∶20,1∶30,1∶40,1∶50,1∶60)加入蒸馏水,加入纤维素酶和果胶酶,调pH 值6.0,在50 ℃下酶解1 h,结束后在80 ℃下灭酶15 min,接着在温度70 ℃,功率为225 W 条件下超声处理60 min。
2.4.2 不同酶解时间对多糖得率的影响
称取1 g 石榴皮粉,加入30 mL 蒸馏水,加入纤维素酶和果胶酶,调pH 值6.0,在50 ℃下按照不同酶解时间(30,60,90,120,150 min)酶解,结束后在80 ℃灭酶15 min,接着在温度70 ℃,功率为225 W 条件下超声处理60 min。
2.4.3 不同酶解pH 值对多糖得率的影响
称取1 g 石榴皮粉,加入30 mL 蒸馏水,加入纤维素酶和果胶酶,按照不同酶解pH 值(4.5,5.0,5.5,6.0,6.5)进行调节,在50 ℃酶解1 h,结束后在80 ℃下灭酶15 min,接着在温度70 ℃,功率为225 W 条件下超声处理60 min。
2.4.4 不同酶解温度对多糖得率的影响
称取1 g 石榴皮粉,加入30 mL 蒸馏水,加入纤维素酶和果胶酶,调pH 值6.0,按照不同酶解温度(30,40,50,60,70 ℃)酶解1 h,结束后在80 ℃灭酶15 min,接着在温度70 ℃,功率为225 W 条件下超声处理60 min。
2.4.5 不同超声温度对多糖得率的影响
取1 g 石榴皮粉,加入30 mL 蒸馏水,加入纤维素酶和果胶酶,调pH 值6.0,在50 ℃下酶解1 h,结束后在80 ℃下灭酶15 min,接着按照不同超声温度(40,50,60,70,80 ℃),功率为225 W 条件下超声处理60 min。
2.4.6 不同超声时间对多糖得率的影响
取1 g 石榴皮粉,加入30 mL 蒸馏水,加入纤维素酶和果胶酶,调pH 值6.0,在50 ℃下酶解1 h,结束后在80 ℃下灭酶15 min,接着在温度70 ℃,功率为225 W 条件下按照不同超声时间(30,40,50,60,70 min)处理。
2.4.7 不同超声功率对多糖提取率的影响
2.4.8 响应面优化设计
根据单因素试验结果,选取影响较大的因素,以多糖得率为响应值,根据Box-behnken 设计原理,通过响应面分析法对提取条件进行优化设计。
3 结果与分析
3.1 单因素试验
3.1.1 不同料液比对多糖得率的影响
由于溶剂的比例会影响溶液的黏度和浓度,从而影响多糖的传质扩散。因此,选取5 个不同水平的料液比进行影响多糖得率的考查。
不同料液比对多糖得率的影响见图2。
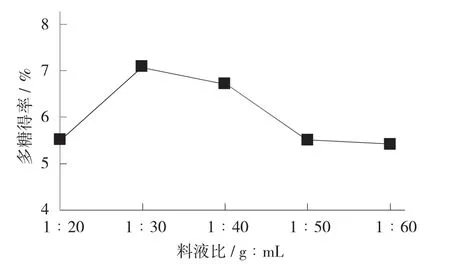
图2 不同料液比对多糖得率的影响
由图2 可知,在料液比1∶20~1∶30(g∶mL)时,多糖得率逐步增大。继续增加料液比,多糖得率开始逐渐下降,这是由于溶剂过多,不利于多糖的浓缩[14]。并且在后续乙醇浸提时,乙醇用量也随之增加,从而导致在离心处理时会浪费更多提取物。因此,料液比最适比例为1∶30(g∶mL)。
3.1.2 不同酶解时间对多糖得率的影响
渥巴锡之仲兄作为人质死于阿斯特拉罕,史载明确。具体拘禁之地、死亡之地,未留下史载,但人质不是普通的囚犯,将萨赖安置在作为当年阿斯特拉罕衙署所在地的小克里姆林宫、居住在这座白色大楼里,似也不失是一种合理的推测。若如此,小克里姆林宫也是土尔扈特人又一处伤心之地。
由于底物用量固定,酶解时间会有一个最适值。因此,选取5 个不同的酶解时间梯度进行多糖得率的考查。
不同酶解时间对多糖得率的影响见图3。
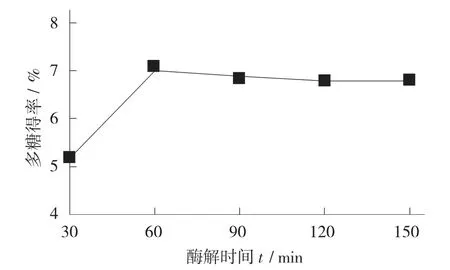
图3 不同酶解时间对多糖得率的影响
由图3 可知,在30~60 min 内,多糖得率逐渐升高。当酶解时间达到1 h 时,多糖得率最大,而随时间逐渐加长,多糖得率不再有上升的趋势,这可能是由于在反应初期阶段,酶与一定量的底物已经完全反应,后期增加反应时间也无法继续提高得率。因此,最适酶解时间定为60 min。
3.1.3 不同酶解pH 值对多糖得率的影响
纤维素酶和果胶酶的最适酶解pH 值为中性偏酸。因此,选取5 个不同的酶解pH 值梯度进行影响多糖得率的考查。
不同酶解pH 值对多糖得率的影响见图4。
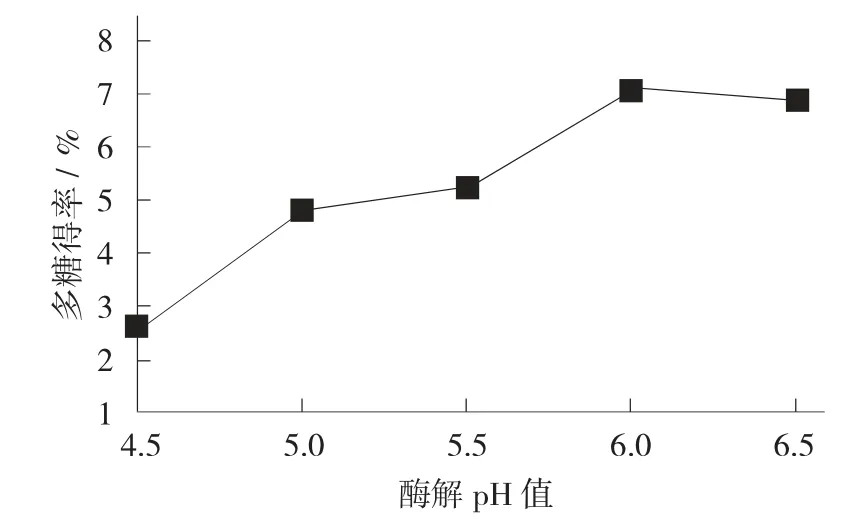
图4 不同酶解pH 值对多糖得率的影响
由图4 可知,当酶解pH 值到达6 时,多糖得率最高,随后开始降低,这是由于pH 值已经超过上述2 种酶的最适pH 值,造成酶活降低,从而影响多糖得率。因此,酶解最适pH 值为6。
3.1.4 不同酶解温度对多糖得率影响
酶活性对温度的要求较高,因此设置5 个不同的酶解温度梯度考查其对多糖得率的影响。
不同酶解温度对多糖得率的影响见图5。
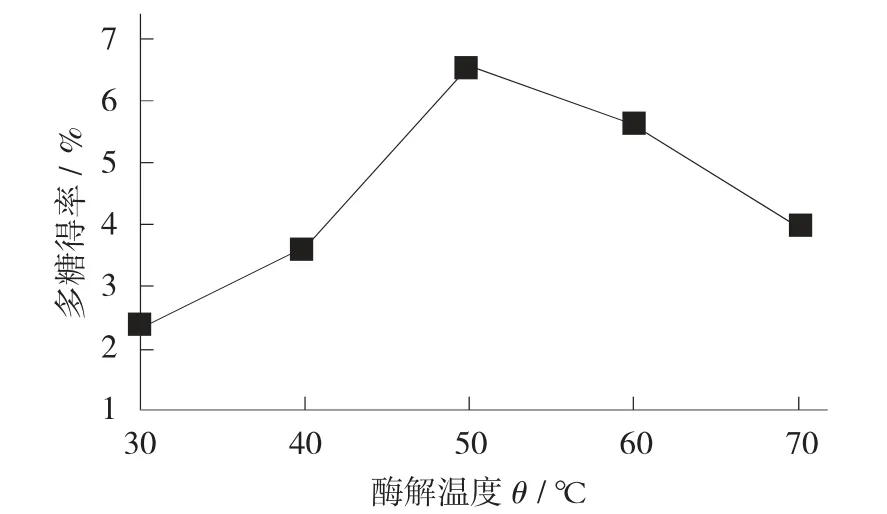
图5 不同酶解温度对多糖得率的影响
由图5 可知,在温度为50 ℃时,酶分解能力最佳,多糖得率达到峰值,随后温度升高,2 种酶开始逐渐失活,多糖得率也开始降低。因此,最适酶解温度为50 ℃。
3.1.5 不同超声时间对多糖得率的影响
超声时间的长短对提取得率也有一定影响,因此设置5 个不同的超声时间梯度考查其对多糖得率的影响。
不同超声时间对多糖得率的影响见图6。
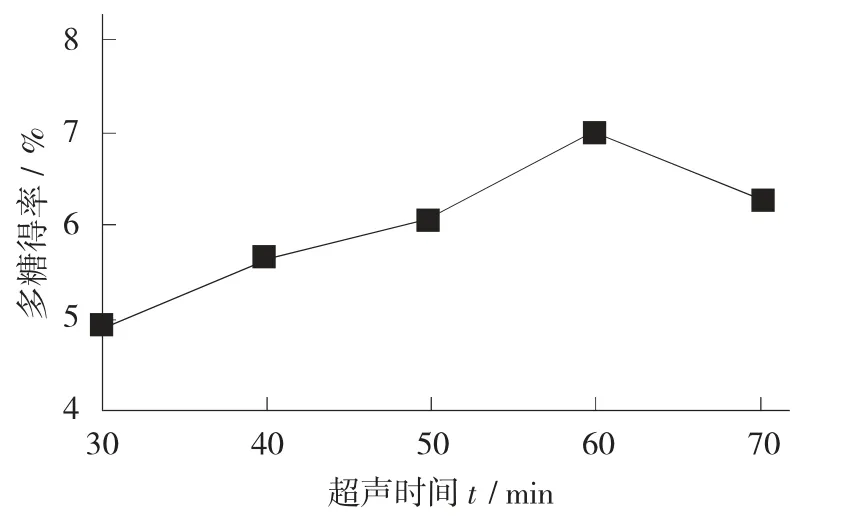
图6 不同超声时间对多糖得率的影响
由图6 可知,超声时间为30~60 min 时,多糖得率数值随时间增加而逐渐攀升,当达到60 min 后,多糖得率开始下降,这可能是由于超声波长时间的机械振动和切割作用[15],导致其中多糖成分遭到破坏。从而造成多糖得率降低。因此,超声处理最佳时间为55~65 min。
3.1.6 不同超声温度对多糖得率的影响
合适的超声温度可以保护样品中的有效成分免遭破坏。
不同超声温度对多糖得率的影响见图7。
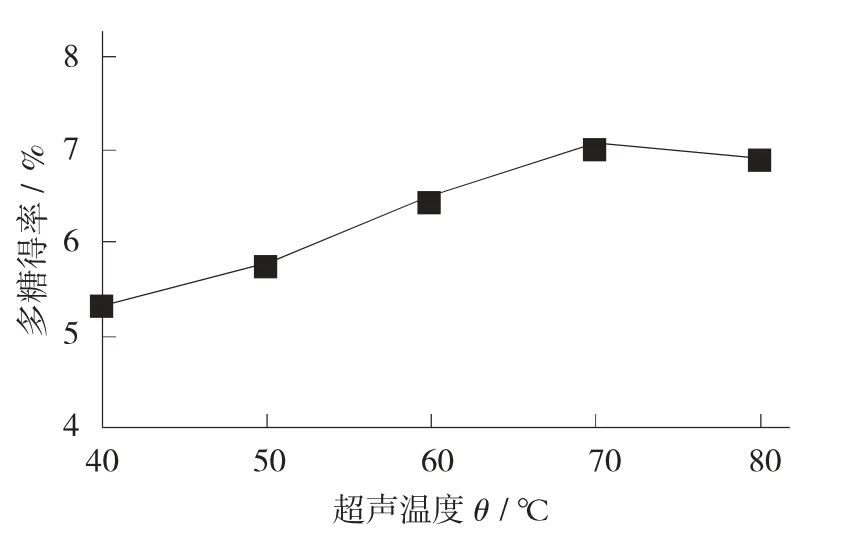
图7 不同超声温度对多糖得率的影响
由图7 可知,在超声温度为40~70 ℃时,多糖得率随温度升高而逐渐增大,而多糖是活性物质,当温度进一步升高时,其结构可能会遭到破坏,多糖得率反而降低。因此,最适超声温度为65~75 ℃。
3.1.7 不同超声功率对多糖得率的影响
不同超声功率辅助提取细胞中多糖物质溶出的效果不同。
不同超声功率对多糖得率的影响见图8。
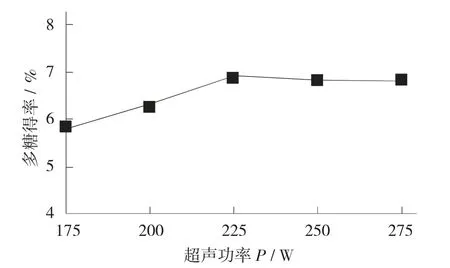
图8 不同超声功率对多糖得率的影响
由图8 可知,超声功率在225 W 以下时,随着超声功率增大,石榴皮多糖的提取效果越来越好,当超声功率超过225 W 后,多糖得率开始逐渐降低,因此,最适超声功率为200~250 W。
3.2 响应面结果分析
3.2.1 响应面因素水平设计
根据对单因素试验数据的分析,选取对石榴皮多糖得率影响较为显著的3 个榴皮多糖得率影响较为显著的3 个因素,即超声时间、超声温度、超声功率,通过响应面优化石榴皮多糖的最佳提取工艺。
响应面优化试验因素与水平设计见表1。
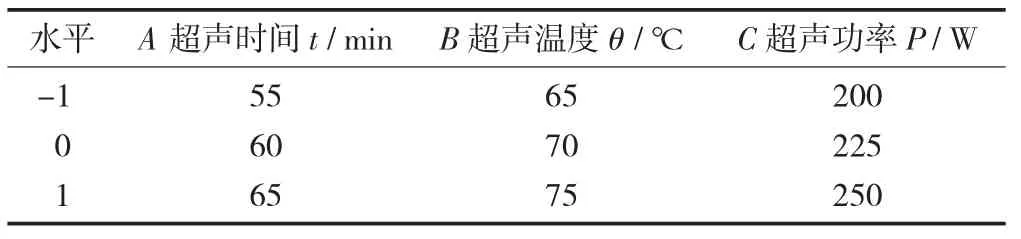
表1 响应面优化试验因素与水平设计
3.2.2 响应面结果及其方差分析
响应面设计的试验结果见表2。
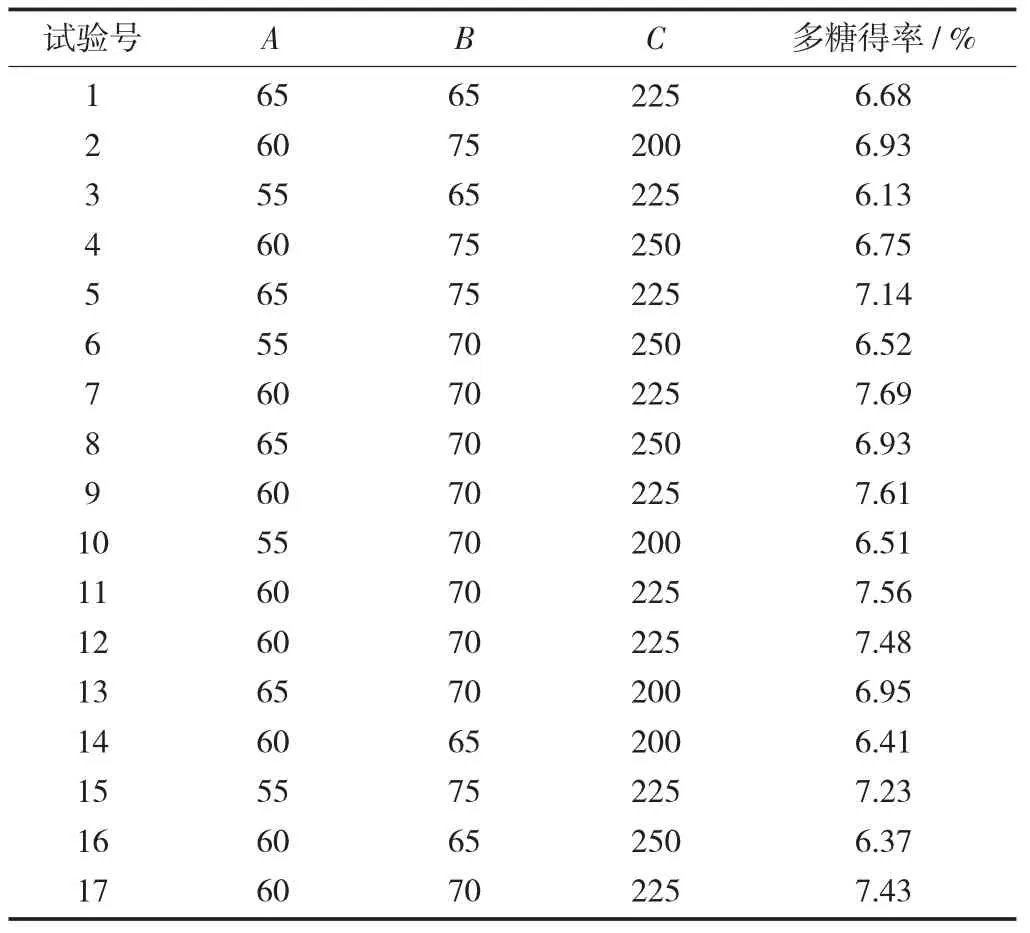
表2 响应面设计的试验结果
通过Design Expert 8.0.6 软件对试验数据进行多元回归拟合[15],得到响应面拟合方程:
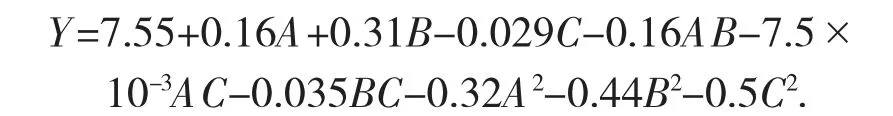
式中:Y——石榴皮总多糖得率,%。
拟合二次多项式模型方差分析见表3。
由表3 可知,此模型(Model)的F 值为23.37,均方差p=0.000 2<0.01,说明该试验响应面拟合方程回归模型极为显著;失拟项p=0.200 8>0.05,说明失拟度在统计意义上不显著,即表明模型拟合度较好,综合以上分析,说明可使用该模型对石榴皮总多糖得率进行分析和预测。另外,由表3 还可知,模型的一次项A、B、C 及二次项A2、B2、C2的p 值均小于0.01,为极显著水平,交互项AB 的p 值小于0.05,达到显著水平,其余项均不显著。根据F 值的大小,各因素对石榴皮多糖的影响顺序依次为超声温度(B)>超声时间(A)>超声功率(C)。
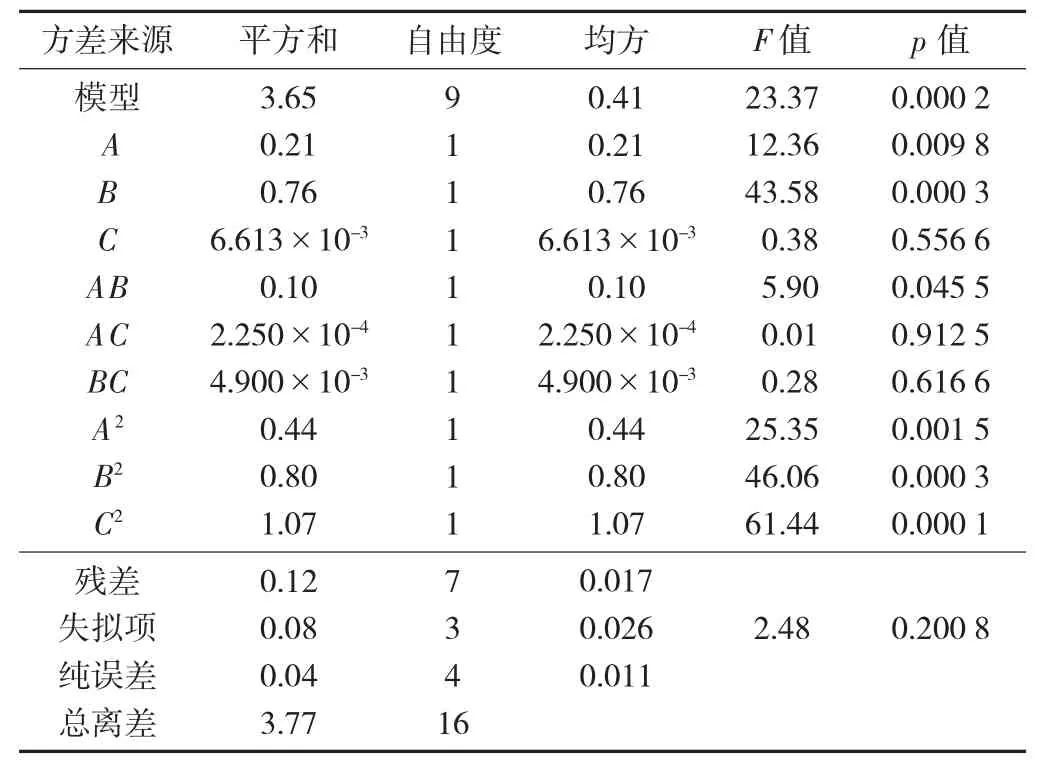
表3 拟合二次多项式模型方差分析
3.2.3 响应面三维图形分析
根据试验结果,用响应面软件分析得到三维曲面图及等高线图。通过观察曲面的倾斜程度和等高线的形状分析各因素变量间的交互作用。
超声时间和超声温度对多糖得率影响的三维曲面图和等高线图见图9,超声时间和超声功率对多糖得率影响的三维曲面图和等高线图见图10,超声温度和超声功率对多糖得率影响的三维曲面图和等高线图见图11。

图9 超声时间和超声温度对多糖得率影响的三维曲面图和等高线图
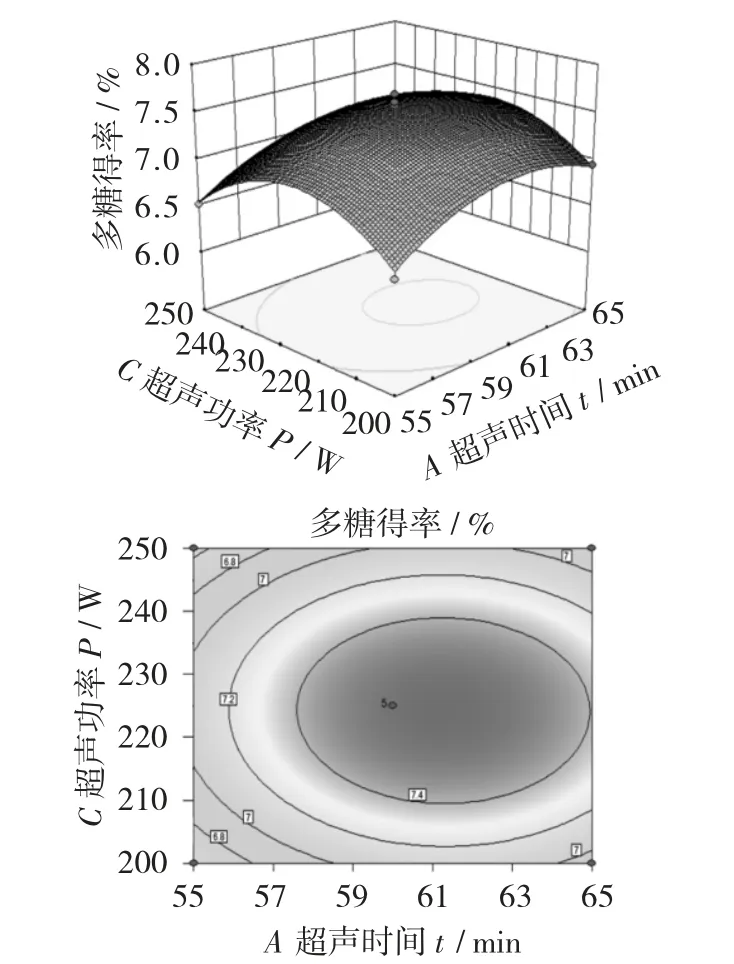
图10 超声时间和超声功率对多糖得率影响的三维曲面图和等高线图

图11 超声温度和超声功率对多糖得率影响的三维曲面图和等高线图
由图9 可知,曲面图曲线弯曲程度高,说明超声时间和超声温度对响应值影响大,等高线形状呈椭圆形,结合方差分析结果,说明超声时间和超声温度的交互作用影响显著。
由图10 可知,曲面图曲线弯曲程度较图9 来说,弯曲程度不是很高,说明超声时间和超声功率对响应值影响不大,等高线形状已开始接近圆形,结合方差分析结果,说明超声时间和超声温度的交互作用影响不显著。
由图11 可知,曲面图曲线弯曲程度较前两张图来说,弯曲程度不是很高,说明超声温度和超声功率对响应值影响不大,等高线形状约近于圆形,结合方差分析结果,说明超声功率和超声温度的交互作用影响不显著。
3.2.4 模型的优化与验证结果
通过Design Expert 8.0.6 软件对响应面模型的优化,得到了提取石榴皮多糖条件的最佳方案为超声时间60.87 min,超声温度71.61 ℃,超声功率223.98 W,在此条件下,得到理想的最佳多糖得率为7.618%。考虑到实际操作条件的可行性,对试验最佳方案进行如下调整:超声时间为61 min,超声温度为72 ℃,超声功率为225 W。根据调整后方案进行验证试验,设置3 组平行,得到石榴皮多糖得率平均值为7.53%,与理论值7.618%相比,相对误差为0.088%,结果与理论值非常接近,说明模型拟合效果较好,结果可靠性较高。
4 结论
采用纤维素酶和果胶酶协同处理石榴皮粉末样品进行多糖提取,可以有效地使植物细胞分离、破裂,从而提高石榴皮多糖得率。同时,结合超声波加速提取技术,并运用响应面法优化提取工艺,得到优化后的提取工艺条件为料液比1∶30(g∶mL),pH 值6,酶解时间1 h,酶解温度50 ℃,超声时间61 min,超声温度72 ℃,超声功率225 W。在此提取条件下,石榴皮总多糖得率为7.53%。与优化前的单因素试验结果相比,石榴皮多糖得率明显得到提高。与传统单一的提取方法相比,此优化方法实用可靠,可用于石榴皮多糖提取。
