新疆红枣中总黄酮的提取及抗氧化活性研究
2022-11-18朱焱超涂世伟于梦瑶张春兰
朱焱超,涂世伟,于梦瑶, 张春兰,2
(1.塔里木大学食品科学与工程学院,新疆阿拉尔 843300;2.南疆特色农产品深加工兵团重点实验室,新疆阿拉尔 843300)
红枣(Ziziphus jujube Mill.)又称中华大枣、华枣,可药食两用,具有极高的营养价值,有补胃健脾、补血益气、润肺止咳、镇静安眠、减轻毒性、提高免疫力等功效[1]。
红枣中富含黄酮、皂苷、色素、各种维生素和抗氧化酶等活性成分[2-5]。其中,黄酮类化合物具有多种生物保健功能,具有抗氧化、抗炎、抗癌、抗血管增生和抗病毒等作用[6]。黄酮类化合物难溶于水,易溶于有机溶剂和稀碱溶液,提取黄酮的工艺包括溶剂提取法[7]、超临界提取法[8]、微波辅助提取法[9]、碱溶酸沉法[10]、超声辅助提取法[11]等。因此,红枣黄酮的提取可提高农副产品的经济效益,对红枣资源的综合利用具有重要意义。
采用超声辅助乙醇溶液提取红枣中的黄酮类化合物,以乙醇体积分数、料液比、超声时间、超声温度4 个因素为影响提取的条件,研究红枣中黄酮类化合物体外抗氧化活性,为新疆红枣资源进一步开发和利用提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
骏枣,市售;芦丁(98%)、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、DPPH(1,1 -二苯基-2 -三硝基苯肼)、Tris(三羟甲基氨基甲烷)等,均为国产分析纯。
1.1.2 仪器与设备
TGL-20B 型高速台式离心机,上海安亭科学仪器厂产品;J6 型紫外可见分光光度计,上海菁华科技仪器有限公司产品;RE-3000 型旋转蒸发器,上海亚荣生化仪器厂产品;Biolog ELx808TM 型多功能酶标仪,Biotek Instruments 公司产品;Lab-1C-80 型真空冷冻干燥机,北京博医康实验仪器有限公司产品。
1.2 试验方法
1.2.1 样品预处理
红枣,清洗、去核,于55 ℃下烘干,粉碎后60 目过筛,4 ℃下冷藏保存。称取适量红枣粉,根据单因素试验提取红枣中黄酮类化合物,提取液以转速4 000 r/min 离心10 min,收集上清液浓缩冷冻干燥,备用。
1.2.2 标准曲线的绘制
配制质量浓度为0.4 mg/mL 的芦丁标准液,取0,1,2,3,4,5 mL 置于25 mL 容量瓶中,加入质量分数为5%的NaNO2溶液1 mL,混匀静置6 min;加入质量分数为10%的Al(NO3)3溶液1 mL,混匀静置6 min;加入质量分数为4%的NaOH 溶液10 mL,体积分数为60%的乙醇溶液定容,混匀静置15 min,于波长510 nm 处测定吸光度[12]。以芦丁溶液的质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到标准曲线方程Y=10.814X+0.006 8,R2=0.999 6。
1.2.3 单因素试验设计
分别以乙醇体积分数40%,50%,60%,70%,80%;料液比(g∶mL)1∶10,1∶15,1∶20,1∶25,1∶30;超声时间10,20,30,40,50 min;超声温度30,40,50,60,70 ℃作为条件提取黄酮类化合物,于波长510 nm 处测定提取液吸光度,根据标准曲线计算提取液中黄酮类化合物质量浓度,每组试验平行3 次,求平均值。
1.2.4 总黄酮含量测定
将提取液稀释后,于波长510 nm 处测定吸光度,根据标准曲线线性方程计算样品中黄酮含量。

式中:C——稀释后黄酮提取液的质量浓度,mg/mL;
V——提取液体体积,mL;
n——稀释倍数;
W——样品质量,g。
1.2.5 DPPH 自由基清除能力的测定
配制浓度为0.1 mmol/L 的DPPH 溶液,避光30 min;总黄酮提取液冻干,配制质量浓度分别为2,4,6,8,10 mg/mL 的黄酮提取液。
取不同质量浓度黄酮提取液与DPPH 溶液按1∶3的比例混合,避光30 min,于波长517 nm 处测定其吸光度A1;测定不同质量浓度黄酮提取液与无水乙醇混合液的吸光度A2,DPPH 溶液与无水乙醇混合液的吸光度A0[13]。按公式(2)计算DPPH 自由基清除率。

1.2.6 羟自由基清除能力的测定
取1 mL 不同质量浓度黄酮提取液,按顺序加入浓度为0.006 mol/L 的FeSO4溶液1 mL、0.006 mol/L的H2O2溶液1 mL、0.006 mol/L 水杨酸-乙醇溶液1 mL,混匀后,37 ℃下水浴30 min,于波长510 nm处测定吸光度A1;其他操作条件不变,用去离子水替换H2O2溶液,于波长510 nm 处测定吸光度A2;其他操作条件不变,用去离子水替换黄酮提取液,于波长510 nm 处测定吸光度A0[4]。按公式(3)计算羟自由基清除率。

1.2.7 超氧阴离子清除能力的测定
配制pH 值8.2,浓度0.05 mol/L Tris-HCl 缓冲溶液、0.005 mol/L 邻苯三酚溶液、10 mol/L HCl 溶液。分别取Tris-HCl 缓冲溶液5 mL,在25 ℃恒温水浴锅中预热15 min,按顺序加入不同质量浓度黄酮提取液2 mL、邻苯三酚溶液1 mL,混合摇匀,在25 ℃下水浴8 min,加入2 滴HCl 溶液终止反应,以去离子水做参比溶液,于波长320 nm 处测定吸光度A1;其他操作条件不变,用去离子水替换邻苯三酚溶液,于波长320 nm 处测定吸光度A2;其他操作条件不变,用去离子水替换黄酮提取液,于波长320 nm 处测定吸光度A0[14]。按公式(4)计算超氧阴离子清除率。
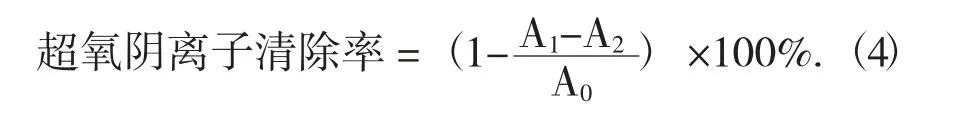
1.2.8 Fe2+还原能力的测定
配制pH 值6.6,0.2 mol/L 磷酸缓冲液、1%铁氰化钾溶液、10%三氯乙酸溶液、1%三氯化铁溶液。取不同质量浓度黄酮提取液1 mL,按顺序加入磷酸缓冲液1 mL、铁氰化钾溶液1 mL,50 ℃下水浴20 min后,加入三氯乙酸溶液1 mL,以转速3 000 r/min 离心10 min,取上清液1 mL,加入去离子水1 mL、三氯化铁溶液0.2 mL,混匀放置10 min,于波长700 nm处测定吸光度,以空白试剂作为参比液,吸光度越大,则说明对Fe2+的还原能力越强。
1.2.9 ABTS 自由基清除能力的测定
别呦呦是个很怪的人。她心情好的时候,像水一样,能把我融化了,心情不好的时候,就发火,无缘无故地发火。问她为什么这样?她说,我没灵感,一句诗写不出来,你说我能不来火吗?
配制0.007 mol/L ABTS 溶液、0.002 45 mol/L 过硫酸钾溶液,按1∶1 混合配制ABTS 自由基母液,在避光静置16 h,于波长734 nm 处,乙醇稀释,将ABTS 自由基母液吸光度控制在0.7±0.02,取0.4 mL不同质量浓度黄酮提取液,加入ABTS 自由基稀释液3 mL,避光静置30 min,于波长734 nm 处测定吸光度A1;其他操作处理条件不变,将ABTS 自由基稀释液替换成去离子水,测定吸光度A2;其他操作处理条件不变,将黄酮提取液替换成无水乙醇,测定吸光度A0[15]。以相同浓度的抗坏血酸作阳性对照。按公式(5)计算红枣黄酮提取液的ABTS 自由基清除率。

2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对红枣总黄酮提取量的影响
乙醇体积分数对红枣总黄酮提取量的影响见图1。
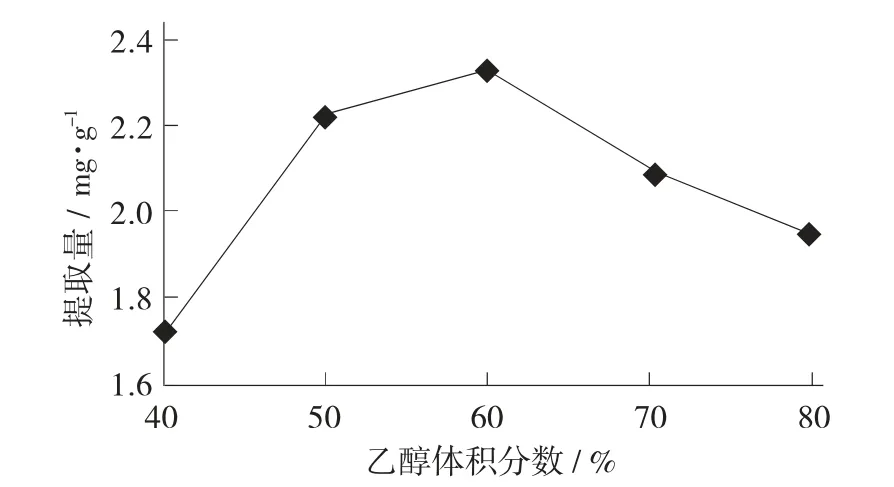
图1 乙醇体积分数对红枣总黄酮提取量的影响
由图1 可知,乙醇体积分数为40~60%时,总黄酮提取量呈上升趋势;乙醇体积分数高于60%,总黄酮提取量呈下降趋势,总黄酮提取量在60%乙醇体积分数时提取率最高。这可能是因为乙醇体积分数越高,醇溶性杂质、色素及亲脂性强的组分浸出量会增加,导致总黄酮类化合物提取率下降。
2.1.2 料液比对红枣总黄酮提取量的影响
料液比对红枣总黄酮提取量的影响见图2。

图2 料液比对红枣总黄酮提取量的影响
由图2 可知,在料液比为1∶25(g∶mL)时达到最高,随着溶剂体积的增大,总黄酮提取量降低。这可能是因为适当增加溶剂体积,总黄酮提取量增加;当提取溶剂的体积到达一定值时,总黄酮提取量就会达到饱和,随着溶剂体积增大,可能溶出了其他醇溶性的杂质,影响显色反应降低吸光度。
2.1.3 超声时间对红枣总黄酮提取量的影响
超声时间对红枣总黄酮提取量的影响见图3。
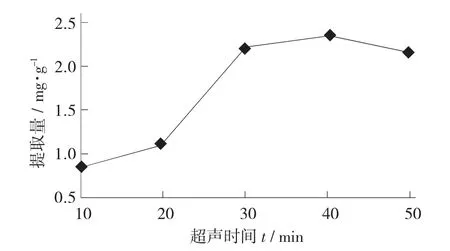
图3 超声时间对红枣总黄酮提取量的影响
由图3 可知,其他单因素条件不变,红枣总黄酮的提取量在超声时间10~40 min 内呈上升趋势,当超声时间超过40 min,总黄酮提取量降低,总黄酮提取量在超声40 min 时提取效果最佳。这可能是因为红枣总黄酮随着超声时间变长,能在提取溶剂中充分析出,当超声时间到达一定值时,超声时间过长会使本身具有抗氧化性的黄酮类化合物部分氧化,会使得提取量变低。
2.1.4 超声温度对红枣总黄酮提取量的影响
超声温度对红枣总黄酮提取量的影响见图4。

图4 超声温度对红枣总黄酮提取量的影响
由图4 可知,其他单因素提取条件不变,红枣总黄酮提取量随着超声温度升高而逐渐增大,当超声温度超过60 ℃后,总黄酮提取量呈下降趋势,提取效果在60 ℃达到最佳。温度升高,会促进分子的运动加快,从而促进黄酮类化合物溶出;温度超过60 ℃后,过高的温度可能会破坏黄酮类物质的分子结构,同时可能促使其他杂质溶出,故总黄酮提取量会受到影响。
综上所述,选取在超声温度60 ℃,料液比1∶25(g∶mL),乙醇体积分数60%,超声时间40 min条件下提取红枣总黄酮,红枣总黄酮提取量可达到2.36 mg/g。
2.2 抗氧化活性试验结果
2.2.1 红枣总黄酮对DPPH 自由基的清除作用
红枣总黄酮对DPPH 自由基的清除作用见图5。
由图5 可知,红枣总黄酮提取液质量浓度为2~10 mg/mL 内时,对DPPH 自由基的清除效果呈上升趋势,质量浓度为10 mg/mL 时清除率最高为76.89%,表明红枣总黄酮提取液对DPPH 自由基具有明显的清除效果。
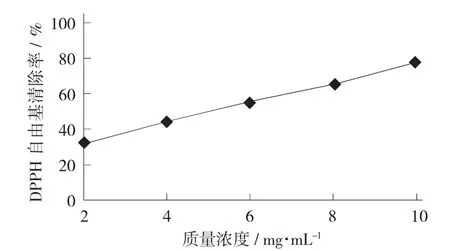
图5 红枣总黄酮对DPPH 自由基的清除作用
2.2.2 红枣总黄酮对羟自由基的清除作用
红枣总黄酮对羟自由基的清除作用见图6。

图6 红枣总黄酮对羟自由基的清除作用
羟自由基是在人体新陈代谢过程中产生毒性与危害最大的一种自由基,其可以使组织的糖类、氨基酸、蛋白质、核酸等物质遭受氧化性损伤和破坏,导致细胞坏死或突变。由图6 可知,红枣总黄酮提取液对羟自由基的清除率随着样液质量浓度增大而上升,在10 mg/mL 时清除率最高为65.71%,红枣总黄酮提取液具有一定的抗清除羟基自由基能力。
2.2.3 红枣总黄酮对超氧阴离子的清除作用
红枣总黄酮对超氧阴离子的清除作用见图7。
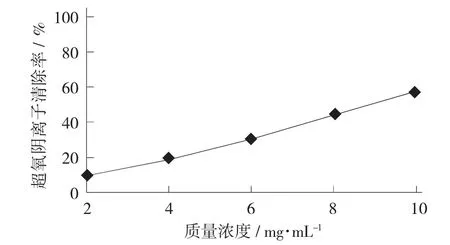
图7 红枣总黄酮对超氧阴离子的清除作用
由图7 可知,在质量浓度为2~10 mg/mL 时,红枣总黄酮提取液对超氧阴离子的清除作用随着质量浓度增大而增加,在10 mg/mL 时达到最大57.17%,表明红枣总黄酮提取液本身对超氧阴离子具有较好清除能力。
2.2.4 红枣总黄酮对Fe2+的还原能力测定
红枣总黄酮对Fe2+的还原能力测定见图8。

图8 红枣总黄酮对Fe2+的还原能力测定
由图8 可知,随着红枣总黄酮提取液质量浓度变大,吸光度增加,这表明红枣总黄酮提取液对Fe2+的还原能力随着红枣总黄酮质量浓度增大而增强,表明红枣总黄酮提取液对Fe2+具有较好的还原能力。范艳丽等人[12]研究的红枣核总黄酮对Fe2+的还原能力,红枣核总黄酮在0.1~0.5 mg/mL 质量浓度范围内的吸光度在0.1~0.4,还原能力且随质量浓度增大而提升至稳定。试验中红枣总黄酮提取液与参考中的红枣核总黄酮对Fe2+的还原能力相近时,质量浓度不同,说明试验中可能红枣总黄酮提取液纯度太低,且红枣果肉总黄酮与红枣核总黄酮差异比较大。
2.2.5 红枣总黄酮对ABTS 自由基的清除作用
红枣总黄酮对ABTS 自由基的清除作用见图9。

图9 红枣总黄酮对ABTS 自由基的清除作用
由图9 可知,红枣总黄酮提取液对ABTS 自由基的清除率与样液质量浓度呈正比例关系,在质量浓度为1 g/mL 时,清除率达到了最高为82.19%,表明红枣总黄酮提取液对ABTS 自由基有较好清除效果。范艳丽等人[12]研究红枣核总黄酮对ABTS 自由基的清除能力,红枣核总黄酮在0.1~0.5 mg/mL 质量浓度范围内对ABTS 自由基的清除率最高达到91%,且随浓度增加而显著提高红枣总黄酮提取液清除ABTS 自由基能力增强。
3 结论
通过单因素试验,确定以超声温度60 ℃,料液比1∶25(g∶mL),乙醇体积分数60%,超声时间40 min 条件下提取红枣总黄酮,研究了该提取方法对提取红枣总黄酮影响,红枣总黄酮提取量可达到2.360 mg/g。通过红枣总黄酮提取液对DPPH 自由基、羟自由基、超氧阴离子、ABTS 自由基的清除效果及铁离子的还原能力进行考查,红枣总黄酮提取液具有一定的抗氧活性,随着提取液质量浓度增大而增加,在质量浓度为10 mg/mL 时,DPPH 自由基、羟自由基、超氧阴离子的清除率达到最高,分别为76.89%,65.71%,57.17%,在质量浓度为1 mg/mL时对ABTS 自由基清除率为82.19%。
试验所得为红枣总黄酮提取液为粗提物,含有较多其他杂质。红枣作为新疆的特色果品,可寻求更多的开发途径将红枣资源充分开发利用,试验研究结果可为红枣的进一步深加工开发提供一定的参考依据。
