青稞不同组分蛋白提取方法比较研究
2022-11-18张文刚杨希娟
邓 婷,党 斌,张文刚,迟 明, 杨希娟
(1.青海大学农林科学院/青海省青藏高原农产品加工重点实验室,青海西宁 810016;2.青藏高原种质资源研究与利用实验室,青海西宁 810016;3.青海省轻工业研究所有限公司,青海西宁 810001)
青稞是禾本科大麦属大麦栽培的变种,俗称裸大麦[1],是青藏高原特有农作物,生长在海拔4 000 多m的青藏高原,是我国高寒农业区主要粮食作物,也是藏族群众赖以生存的基本口粮[2-4]。青稞相比一般谷物具有“三高两低”的独特优势(如高蛋白、高纤维、高维生素、低脂肪、低糖),且富含β -葡聚糖、多酚、淀粉等活性成分[5-7]。目前,青稞营养组分的研究多关注淀粉[8]、β -葡聚糖[9]、多酚[10]等活性成分,对于青稞蛋白的研究相对较少。
青稞中蛋白质含量较高,氨基酸配比合理,蛋白质平均含量约13.08%[11],是水稻的2 倍,是高粱和玉米的1.5 倍[12],极具有开发利用价值。目前,关于青稞蛋白的研究主要集中于青稞分离蛋白的提取工艺优化及功能性质研究[13-14]、蛋白酶解多肽的制备[15]等方面,而关于青稞组分蛋白的研究较少。根据溶解度的不同,青稞蛋白分为清蛋白、球蛋白、醇溶蛋白、谷蛋白4 种组分。已有研究报道了不同品种青稞中4 种组分蛋白的含量[16],但是其提取方法均是按照小麦组分蛋白的方法进行的。虽然青稞和小麦中均含有以上4 种蛋白组分,但是其含量、分子量大小存在明显差异[17]。因此,优化比较传统Osborne 提取方法与超声波法提取青稞中组分蛋白的工艺,旨在探寻一种适合青稞中组分蛋白的提取方法。以期为青稞品质的功能评价提供理论依据,同时为青稞蛋白的深度开发利用提供技术支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
青稞(西宁昆仑15 号),青海省农林科学院作物所提供。
无水乙醇、磷酸、过硫酸铵,均为分析纯,天津市富宇精细化工有限公司提供;氢氧化钠、氯化钠,均为分析纯,国药集团化学试剂有限公司提供;考马斯亮蓝(G250、R250)、牛血清蛋白、电泳制胶液、十二烷基硫酸钠(SDS)、三羟甲基氨基甲烷(TRIS)、甘氨酸、四甲基乙二胺(TEMED)、蛋白Marker(11-245 kDa)均为生化试剂,北京索莱宝科技有限公司提供。
1.1.2 主要仪器设备
AL204 型电子天平,梅特勒-托利多仪器有限公司产品;KQ-500DE 型数控超声波清洗器,昆山市超声波仪器有限公司产品;DL-5M 型低速冷冻离心机,湖南长沙湘仪离心机仪器有限公司产品;N4S 型紫外线可见分光光度计,上海仪电分析仪器有限公司产品;DYY-6D 型电脑三恒多用电泳仪电源、DYCZ-30C 型电泳仪,北京市六一仪器厂产品;PD-A 型X线胶片观察灯,汕头市粤华医疗器械厂有限公司产品。
1.2 试验方法
1.2.1 组分蛋白提取率的测定
采用考马斯亮蓝法(G250 显色法)测定蛋白质质量浓度[18],以吸光度A 为纵坐标(Y),牛血清蛋白标准液质量浓度(mg/mL)为横坐标(X),绘制蛋白质标准曲线,建立回归方程为Y=5.74X+0.019 3(R2=0.998 3)。按以下公式计算组分蛋白提取率:
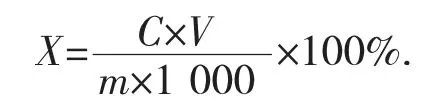
式中:X——蛋白提取率,%;
C——提取液蛋白溶液质量浓度,mg/mL;
V——提取液体积,mL;
m—样品中蛋白含量,g。
1.2.2 传统Osborne 法提取青稞各组分蛋白
(1)提取流程。青稞全籽粒粉碎后即为试验样品。准确称取2 g 样品于50 mL 离心管中,按设定的料液比加入去离子水,搅拌均匀,在一定温度下,恒温水浴振荡浸提,以转速4 000 r/min 离心20 min得到上清液A 和残渣A,收集上清液A,即为清蛋白提取液;残渣A 中加入NaCl 溶液,重复上述提取步骤,得到上清液B 和残渣B,收集上清液B,即为球蛋白提取液;依次向残渣B 中加入乙醇溶液,提取醇溶蛋白,即得到上清液C 和残渣C,再向残渣C中加入NaOH 溶液提取谷蛋白,重复上述操作即得上清液D 和残渣D;按照1.2.1 所述方法计算各组分蛋白提取率。
(2)正交试验方法。在单因素试验结果基础上,以蛋白提取率为指标,选取提取剂质量分数(A)、料液比(B)、提取温度(C)、提取时间(D)为因素,设计L9(34)正交试验。
传统Osborne 法提取组分蛋白正交试验因素与水平见表1。
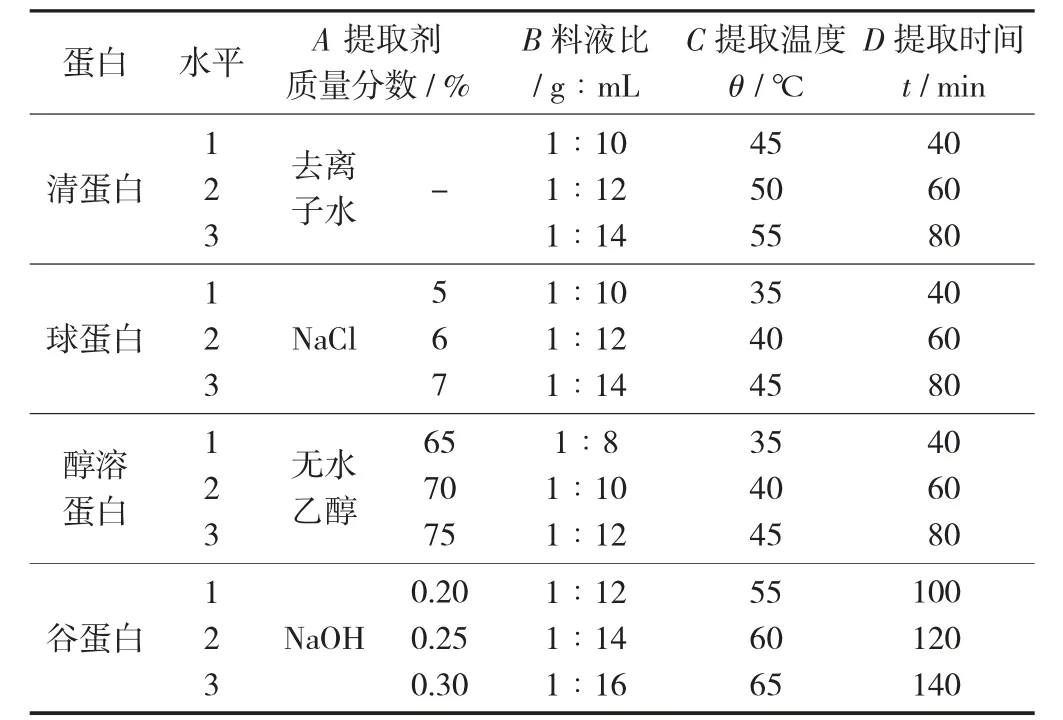
表1 传统Osborne 法提取组分蛋白正交试验因素与水平
1.2.3 超声波提取青稞各组分蛋白工艺
(1)提取流程。准确称取2 g 样品于50 mL 离心管中,按料液比1∶16 加入去离子水,搅拌均匀,设置超声波清洗机功率250 W,温度50 ℃,浸提30 min后,以转速4 000 r/min 离心20 min,上清液即为清蛋白提取液;再向提取过清蛋白的残渣中按料液比1∶14 加入5% NaCl 溶液,在超声功率300 W,温度30 ℃,超声时间40 min 条件下提取并离心得球蛋白提取液;依次向球蛋白提取液残渣中加入65%乙醇溶液,在料液比1∶12,超声功率300 W,温度35 ℃,超声时间50 min 条件下提取并离心得到醇溶蛋白提取液;再向提取过醇溶蛋白的残渣中按料液比1∶16加入质量分数为0.25%的NaOH 溶液,在超声功率450 W,温度55 ℃,超声时间45 min 条件下提取并离心得谷蛋白提取液。
(2)正交试验方法。以蛋白提取率为指标,选取料液比(A')、超声功率(B')、提取温度(C')、超声时间(D')为因素,固定NaCl 质量分数为5%,乙醇体积分数为65%,NaOH 质量分数为0.25%,设计L9(34)水平正交试验。
超声波提取组分蛋白正交试验因素与水平见表2。

表2 超声波提取组分蛋白正交试验因素与水平
1.2.4 组分蛋白等电点测定
参考孙媛等人[19]的方法,将提取的青稞各组分蛋白上清液,等量分别取7 份各5 mL 上清液于10 mL离心管中,用浓度0.1 mol/L HCl 溶液或0.1 mol/L NaOH 溶液调节pH 值至2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,静置离心后取上清液,用考马斯亮蓝法测样品于波长595 nm 处的吸光度,吸光度越小,说明上清液中蛋白质含量越低,对应的pH 值即为等电点。
1.2.5 青稞组分蛋白分子量分布的SDS-PAGE 凝胶电泳分析
参考张文刚等人[20]的方法稍作调整,采用蛋白质凝胶电泳(SDS-PAGE)来分析青稞不同组分蛋白的分子量分布。分离胶质量分数为12%,浓缩胶为4%,取40 μL 青稞组分蛋白提取液加入160 μL 上样缓冲液(变性电泳组含5%巯基乙醇),沸水浴5 min。取15 μL 处理后的样品上样后进行电泳,电泳结束后将分离凝胶置于含有0.25%考马斯亮蓝R-250 的染色液中染色1 h,再用含有甲醇-乙酸的水溶液进行脱色,在X 线胶片观察灯下观察条带。
1.2.6 数据处理
所有试验均重复3 次,采用SPSS 26.0 软件进行正交试验设计与分析,运用Excel 和Origin 2019b 软件进行数据统计分析及绘图。
2 结果和分析
2.1 正交试验结果及分析
2.1.1 传统Osborne 法提取青稞组分蛋白正交试验设计及结果
(1)清蛋白提取工艺参数正交试验结果。
清蛋白提取正交试验结果见表3,清蛋白提取方差分析见表4。
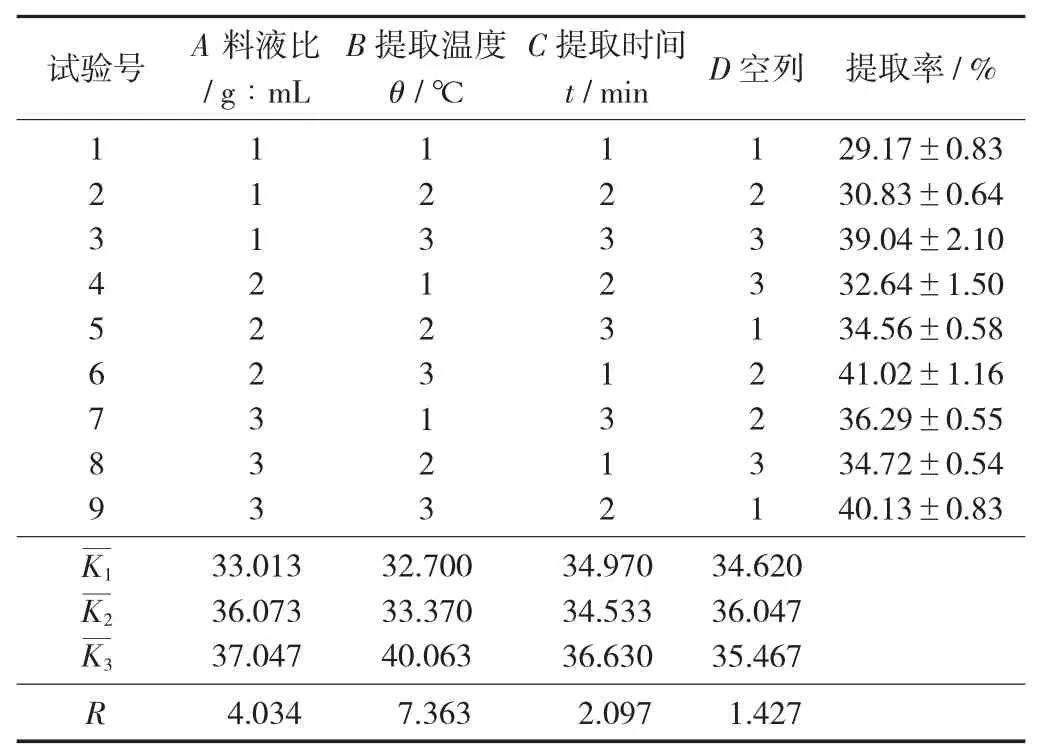
表3 清蛋白提取正交试验结果

表4 清蛋白提取方差分析
由表3 可知,各因素对清蛋白Osborne 法提取率的影响依次为提取温度>料液比>提取时间,最优组合为A3B3C3。由表4 可知,提取温度为显著因素,料液比和提取时间对提取率的影响不显著。最佳工艺参数为料液比1∶14,提取温度55 ℃,提取时间80 min。在该最优条件下提取率达到41.79%,高于正交试验中所有组合。
(2)球蛋白提取工艺参数正交试验结果。
球蛋白提取正交试验结果见表5,球蛋白提取方差分析见表6。
由表5 可知,各因素对球蛋白传统Osborne 法提取率的影响依次为料液比>提取时间>提取温度>NaCl 质量分数,最优组合为A1B3C3D3。由表6 可知,提取时间和料液比为显著因素,NaCl 质量分数和提取温度对提取率的影响不显著。最佳工艺参数为料液比1∶14,提取时间80 min,提取温度45 ℃,NaCl 质量分数5%,此最优条件下球蛋白提取率达到36.72%。

表5 球蛋白提取正交试验结果

表6 球蛋白提取方差分析
(3)醇溶蛋白提取最佳工艺参数正交试验结果。
醇溶蛋白提取工艺参数正交试验见表7,醇溶蛋白提取方差分析见表8。
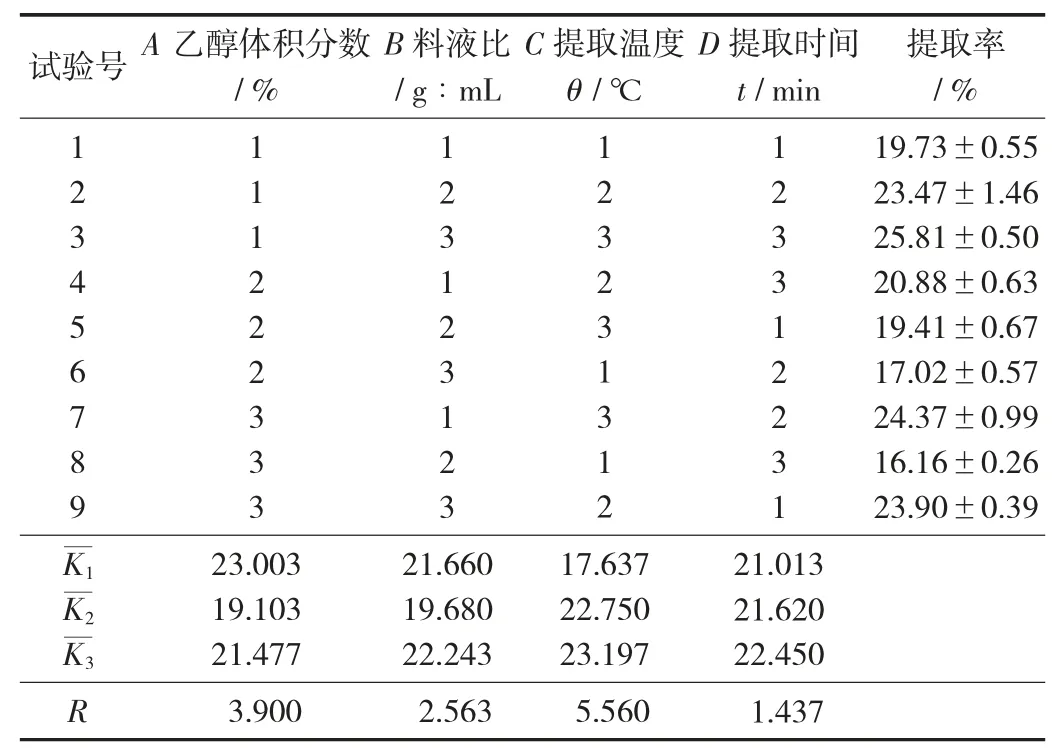
表7 醇溶蛋白提取工艺参数正交试验

表8 醇溶蛋白提取方差分析
由表7 可知,各因素对醇溶蛋白传统Osborne 法提取率的影响依次为提取温度>乙醇体积分数>料液比>提取时间,最优组合为A1B3C3D3。由表8 可知,提取温度和乙醇体积分数为显著因素,料液比和提取时间对提取率的影响不显著。最佳工艺参数为乙醇体积分数65%,料液比1∶12,提取温度45 ℃,提取时间80 min,此最优条件下醇溶蛋白提取率达到25.81%。
(4)谷蛋白提取最佳工艺参数正交试验结果。
谷蛋白提取工艺参数正交试验见表9,谷蛋白提取方差分析见表10。

表9 谷蛋白提取工艺参数正交试验
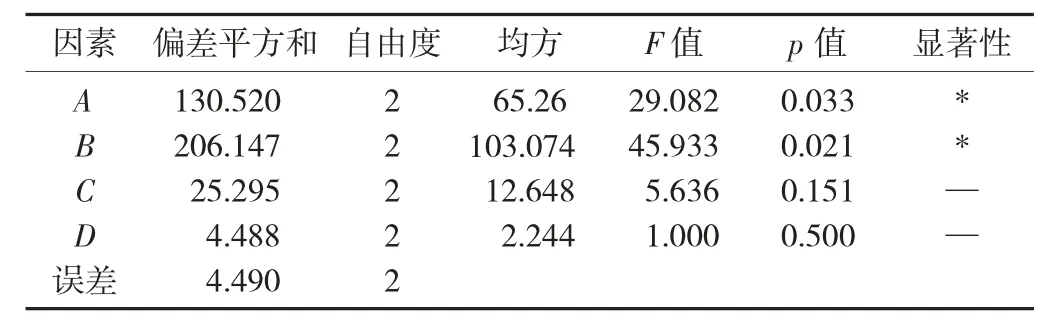
表10 谷蛋白提取方差分析
由表9 可知,各因素对谷蛋白传统Osborne 法提取率的影响依次为料液比>NaOH 质量分数>提取温度>提取时间,最优组合为A2B3C3D2。由表10 方差分析可知,NaOH 质量分数和料液比为显著因素,提取温度和提取时间对提取率的影响不显著。最佳工艺参数为料液比1∶16,NaOH 质量分数0.25%,提取温度65 ℃,提取时间120 min,在此最优条件下提取率达到89.21%。
2.1.2 超声波提取青稞组分蛋白正交试验设计及结果
(1)清蛋白提取工艺参数正交试验结果。
清蛋白提取工艺参数正交试验见表11,清蛋白提取方差分析见表12。
由表11 可知,各因素对清蛋白超声法提取率的影响为料液比>提取温度>超声时间>超声功率,最优组合为由表12 可知,料液比为显著因素,超声功率、提取温度、超声时间对提取率的影响不显著。最佳工艺参数为料液比1∶14,提取温度50 ℃,超声时间30 min,超声功率250 W,在此最优条件下提取率达到60.13%。
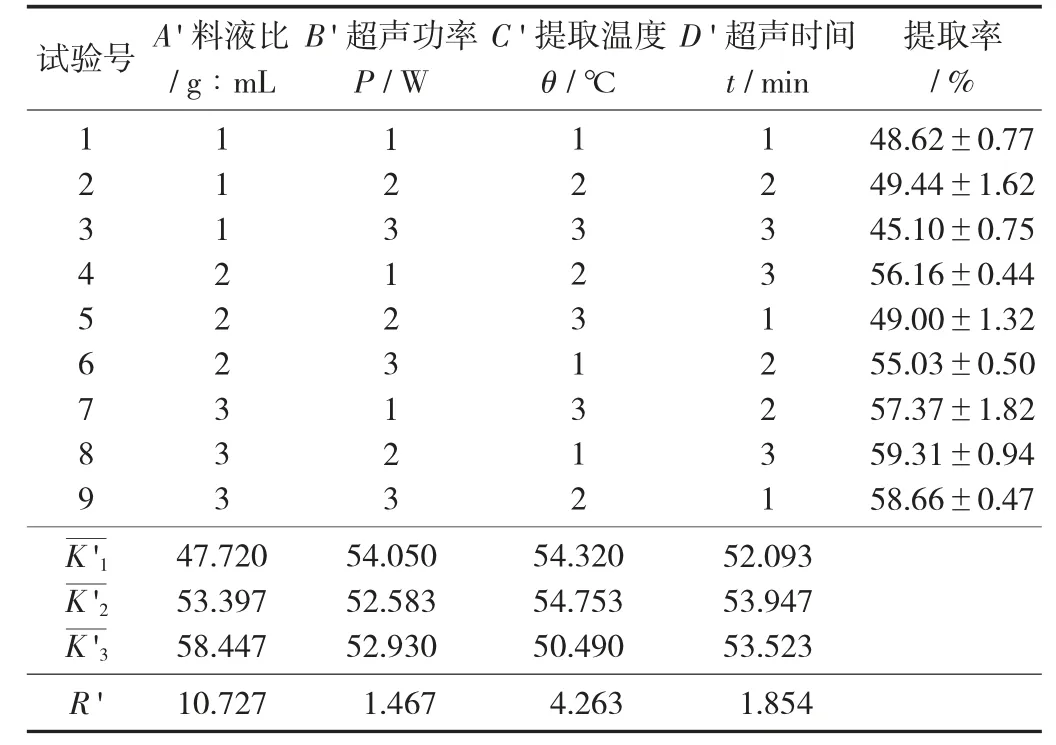
表11 清蛋白提取工艺参数正交试验

表12 清蛋白提取方差分析
(2)球蛋白提取工艺参数正交试验结果。
球蛋白提取工艺参数正交试验见表13,球蛋白提取方差分析见表14。

表13 球蛋白提取工艺参数正交试验

表14 球蛋白提取方差分析
由表13 可知,各因素对球蛋白超声法提取率的影响依次为超声功率>提取温度>超声时间>料液比,最优组合为A''2B''2C''1D''2。由表14 可知,超声功率、提取温度为显著因素,料液比和超声时间对提取率的影响不显著。最佳工艺参数为料液比1∶14,超声功率300 W,提取温度25 ℃,超声时间40 min,在此最优条件下提取率达到49.82%。
(3)醇溶蛋白提取工艺参数正交试验结果。
醇溶蛋白提取工艺参数正交试验见表15,醇溶蛋白提取方差分析见表16。
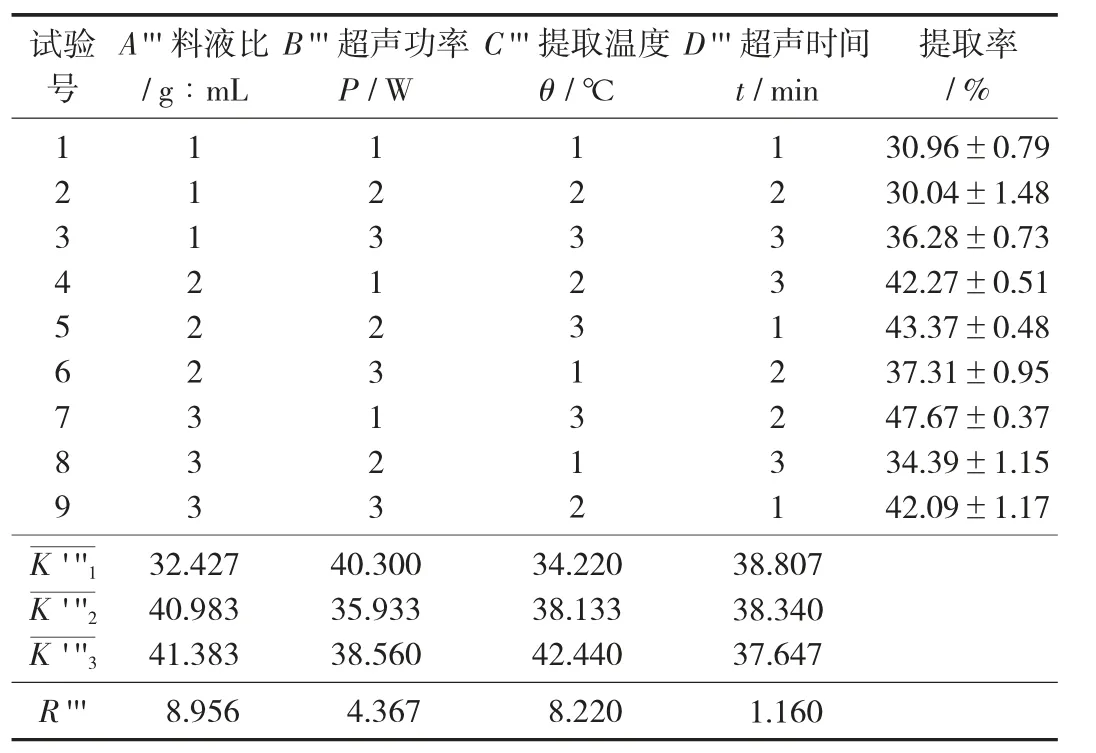
表15 醇溶蛋白提取工艺参数正交试验
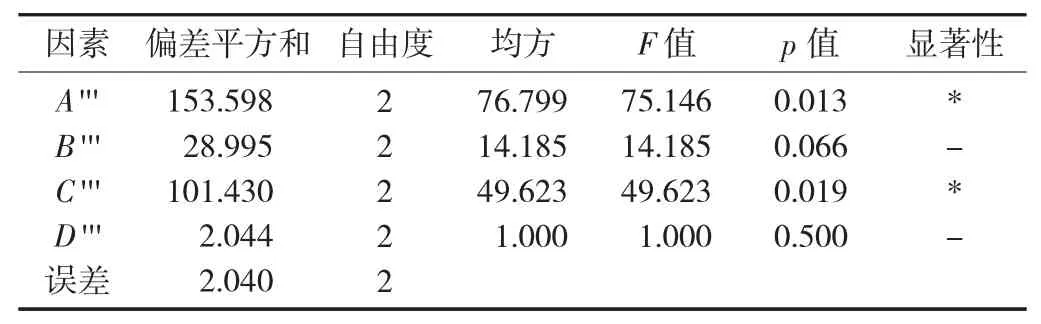
表16 醇溶蛋白提取方差分析
由表15 可知,各因素对醇溶蛋白超声法提取率的影响依次为料液比>提取温度>超声功率>超声时间,最优组合为A'''3B'''1C'''3D'''1。由表16 方差分析可知,料液比和提取温度为显著因素,超声功率和超声时间对提取率的影响不显著。最佳工艺参数为料液比1∶14,超声功率300 W,提取温度35 ℃,超声时间45 min,在此最优条件下提取率达到48.18%。
(4)谷蛋白提取工艺参数正交试验结果。
谷蛋白提取工艺参数正交试验见表17,谷蛋白提取方差分析见表18。
由表17 可知,各因素对谷蛋白超声法提取率的影响依次为料液比>超声功率>提取温度>超声时间,最优组合为A''''3B''''3C''''3D''''2。由表18 可知,料液比为显著因素,超声功率、提取温度、超声时间对提取率的影响不显著。最佳工艺参数为料液比1∶16,超声功率450 W,提取温度55 ℃,超声时间40 min,在此最优条件下提取率达到97.63%。

表17 谷蛋白提取工艺参数正交试验

表18 谷蛋白提取方差分析
2.2 青稞组分蛋白等电点测定结果
青稞组分蛋白等电点见图1。
由图1 可知,4 种青稞蛋白质在不同pH 值下的吸光度存在差异。醇溶蛋白和谷蛋白在pH 值2.0~4.0 吸光度呈下降趋势,而清蛋白和球蛋白吸光度在该pH 值范围内有所波动且总体变化相反,当pH 值高于4.0 后4 种青稞蛋白质的吸光度均有明显增大趋势,上述结果与孙媛[21]关于小麦4 种蛋白分离分级的报道相类似。当pH 值分别为2.5,3.5,4.0 和4.0 时清蛋白、球蛋白、醇溶蛋白和谷蛋白溶液吸光度最小,各蛋白质形成的沉淀最多,推测上述pH 值即为青稞不同组分蛋白的等电点。溶液中蛋白质以两亲性离子形式存在,在远离等电点时蛋白颗粒带同种电荷较多,颗粒之间静电斥力强,不易聚集沉淀,溶解度较高;但在等电点附近时,蛋白质颗粒净电荷趋于0,颗粒之间相互作用力小,易于聚集沉淀,导致溶解度显著降低。
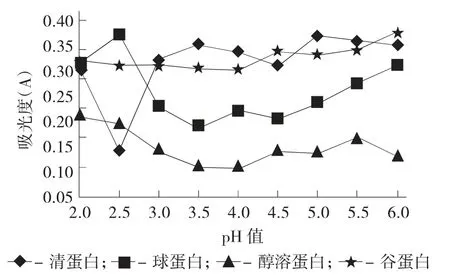
图1 青稞组分蛋白等电点
2.3 2 种提取方法蛋白提取率比较及SDS-PAGE 电泳图谱
2.3.1 2 种提取方法蛋白提取率比较
2 种提取方法不同组分蛋白提取率比较见表19。

表19 2 种提取方法不同组分蛋白提取率比较
由表19 可知,超声波提取能显著提高青稞不同组分蛋白的提取率,相比传统Osborne 提取法而言,提取率分别提高了约19.94%(清蛋白),11.81%(球蛋白),16.6%(醇溶蛋白),7.92%(谷蛋白),且极大缩短了各组分蛋白的提取时间,其中清蛋白、球蛋白、醇溶蛋白、谷蛋白提取时间分别缩短了50,40,30,75 min。李茉等人[22]采用超声波法提取辣椒籽蛋白,与传统提取法相比蛋白提取量增加了0.81 g/100 g;张兆云等人[23]采用超声波辅助 提取藜麦清蛋白,发现提取率增大至40.1%,即超声处理可以有效提高蛋白提取率,与试验结果基本一致。Ahmed Taha 等人[24]研究了超声波提取对核桃不同组分蛋白提取率和理化性质的影响,发现超声波极大地提高了核桃组分蛋白提取率并有效改善其功能性质。超声波的强烈振动、空化效应和搅拌作用可以破坏植物的细胞,使细胞内蛋白质的溶出速率和溶出量增大,从而显著提升植物蛋白的提取效率。
2.3.2 青稞不同组分蛋白SDS-PAGE 电泳图谱
不同提取方法下青稞组分蛋白的SDS-PAGE 电泳图谱见图2。
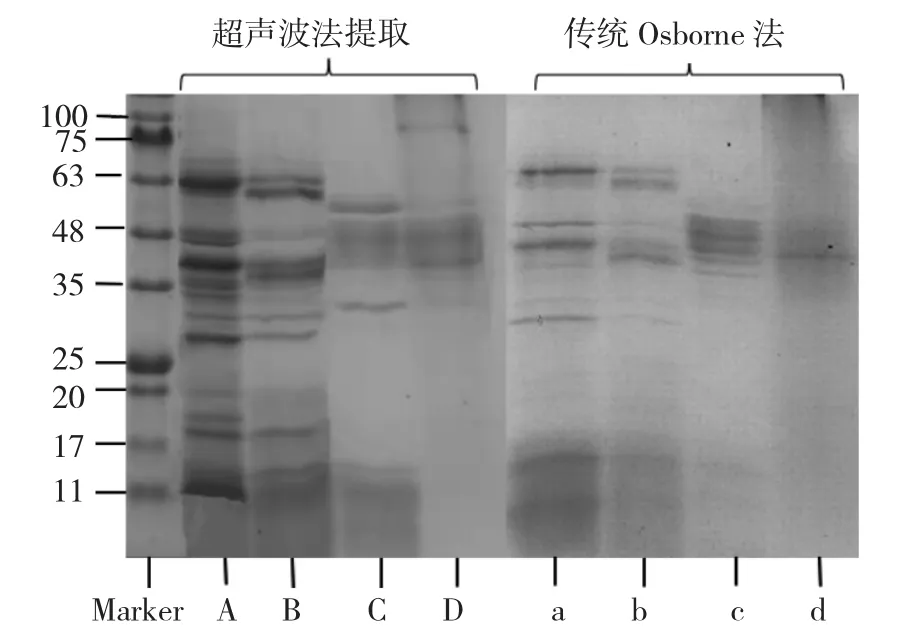
图2 不同提取方法下青稞组分蛋白的SDS-PAGE 电泳图谱
由图2 可知,4 种蛋白的亚基分布主要集中在11~75 kDa。清蛋白亚基主要集中在11~66 kDa;球蛋白主要集中在12~63 kDa;醇溶蛋白条带细少,主要分布在32~55 kDa 和小于15 kDa;谷蛋白亚基条带最少,主要分布在37~50 kDa 和70 kDa。超声提取青稞蛋白的条带清晰且各亚基分离较好,说明所得蛋白含量和纯度相对较高[25]。2 种提取方法下蛋白的亚基数量和含量有明显差别,超声法提取的各蛋白亚基条带均多于传统Osborne 法。相较而言,传统Osborne 法提取的清蛋白、球蛋白、醇溶蛋白和谷蛋白分别在分子量30~48 kDa,28~32 kDa,30 kDa 和35~48 kDa/75 kDa 存在条带缺失。在分子量低于40 kDa区域,传统Osborne 法所得蛋白亚基条带较少,可能原因是水浴提取所需的温度较高,蛋白存在一定程度的损失和降解,同时该区域蛋白亚基条带颜色浅且模糊,可能是随着提取时间的延长,蛋白质和小分子等活性物质发生了相互作用[26]。张舒等人[27]通过2 种不同处理提取出绿豆蛋白,经SDS-PAGE 分析发现,随着热处理时间的延长,绿豆蛋白亚基条带均变浅,且有不同分子质量的亚基条带逐渐消失,这与本试验结果相类似。综上,超声波法提取蛋白的含量更高且组成更丰富,可以更好地分离出青稞高分量组分蛋白。
3 结论
优化了传统Osborne 法和超声波法提取青稞4 种蛋白的工艺,并比较了2 种方法的提取性能。在最佳条件下,2 种方法均能有效提取青稞清蛋白、球蛋白、醇溶蛋白和谷蛋白,且4 种蛋白的等电点分别为2.5,3.5,4.0,pH 值4.0。超声波提取法制备的不同蛋白含量和纯度更高、组成更丰富,包含的大分子量蛋白更多。相比传统Osborne 提取法,超声提取法可以显著提升蛋白的提取效率,缩短提取时间,可作为青稞组分蛋白的良好提取技术。比较分析了青稞蛋白的2 种提取工艺,对2 种方法下不同组分蛋白的理化和功能特性还需进一步探讨,以期为青稞蛋白质的高效分离制备与应用提供理论支撑。
