Fe掺杂g‐C3N4光催化活化过硫酸钠降解偶氮染料
2022-11-17马会强
亢 春,马会强,李 爽
(辽宁石油化工大学 环境与安全工程学院,辽宁 抚顺 113001)
随着工业化进程的逐步加快,人们对物质的追求逐渐上升,形形色色的染料产品在人们的日常生活中使用。我国是染料使用大国,偶氮染料使用量是其他染料使用量的两倍。偶氮染料在生产过程中会产生具有复杂成分、高毒性、高色度、低生化性等特点的污染废水,而这些废水大多使人致癌、致畸或致突变[1]。因此,寻找合适的方法降解偶氮染料废水是目前急需解决的问题。
化学氧化技术在有机物污染降解方面使用广泛,选择合适的氧化剂是决定有机污染物降解效率的关键因素之一[2]。对于氧化剂,不仅要求其本身具有强氧化性,而且氧化剂本身和发生氧化反应之后的产物对环境危害小[3]。活化过硫酸钠是一种新型的高级氧化技术,其氧化性强、反应迅速快、适应范围广,可弥补其他氧化剂的不足[4]。现阶段常用的活化方法有碱活化[5]、过度金属活化[6]、热活化[7]等,同时,超声[8]、电子束[9]、微波[10]、活性炭[11]、光等都可以使过硫酸钠活化,并且产生硫酸根自由基。光催化氧化法是一种绿色、无污染且高效的氧化技术,被广泛应用于有机污染物的降解研究。光催化氧化技术的原理是受激发的半导体催化剂产生光电子,空穴中产生具有强氧化性的自由基,这些自由基可以分解污染物,使污染物最终被矿化转化成无毒、无害物质。
近年来,二维石墨相氮化碳(g‐C3N4)纳米片因其适当的间隙结构、较大的表面积和优异的化学稳定性被广泛研究,而且g‐C3N4也是一种可见光光催化剂。g‐C3N4是以3‐s‐三嗪为基本结构单元的氮化碳,与其他四种晶体结构的氮化碳相比,g‐C3N4在常温下更加稳定[12],但g‐C3N4具有比表面积小、光生载流子易复合和寿命短的特点[13]。为了提高g‐C3N4量子效率,采用金属掺杂(Fe[14]、Pd[15])、非金属掺杂[16](B、O、S)以及与其他半导体耦合等方法。
本文以三聚氰胺和硝酸铁为原料,通过浸渍法制备Fe‐C3N4,将其用于催化过硫酸钠降解偶氮染料,研究了Fe掺杂对g‐C3N4结构性质的影响及Fe‐C3N4材料催化过硫酸钠降解偶氮染料的影响因素。
1 实验部分
1.1 试剂与仪器
试剂:三聚氰胺、硝酸铁、过硫酸钠、橙黄Ⅱ,分析纯,天津大茂化学试剂厂;氢氧化钠,分析纯,沈阳市沈一精细化学品有限公司;盐酸,质量分数36.0%,沈阳经济技术开发区试剂厂。
仪器:UV‐5100型紫外可见分光光度计,上海元析仪器有限公司;PS‐100型超声波清洗器,昆山禾创造声仪器有限公司;DF‐101S磁力搅拌器,常州市亿能实验仪器厂;GWL‐160马弗炉,北京恒泰丰科实验设备有限公司;PHS‐25pH计,上海仪电科学仪器股份有限公司;250 W高压钠灯,惠州同为电子有限公司;Nicolet20DXB红外光谱仪,赛默飞世尔科技有限公司。
1.2 g‐C3N4的制备
通过高温缩聚法制备g‐C3N4材料,具体步骤如下:称取5 g三聚氰胺置于坩埚中,加盖后放在温控式马弗炉中,以5℃/min的升温速率加热至550℃,焙烧2 h,待坩埚自然冷却至室温后取出,放在研钵中研磨,得到淡黄色的固体粉末即为g‐C3N4材料。
1.3 Fe掺杂g‐C3N4的制备
通过浸渍法制备Fe‐C3N4材料的方法参考文献[15],具体步骤如下:首先制备g‐C3N4纳米片,将1 g g‐C3N4粉末置于250 mL去离子水中,搅拌均匀后置于超声装置,超声12 h,将大块的g‐C3N4进行液相剥离。超声结束后,将悬浮液加热,去除水分。称取一定质量的硝酸铁溶解在50 mL丙酮溶液中(Fe与g‐C3N4的质量比为1∶10),加入g‐C3N4纳米片后,置于搅拌器上搅拌2 h,在6 000 r/min的条件下离心15 min,去除液体,剩余固体用丙醇洗涤数次,以去其骨料。将洗涤后的物质烘干,得到略带红棕色固体即为Fe掺杂g‐C3N4(Fe‐C3N4)材料。
1.4 结构表征
采用红外光谱仪对Fe‐C3N4材料进行表征,DTGS检测器,扫描波数为4 000~400 cm−1,分辨率为4 cm−1,扫描次数为32次。
1.5 实验方案
Fe‐C3N4材料对橙黄II有一定的吸附作用,对降解效果的研究有一定影响,因此在降解实验前先使Fe‐C3N4材料吸附饱和,再进行降解研究。
吸附实验:取质量浓度为25 mg/L的目标污染物橙黄II 200 mL置于锥形瓶中,加入Fe‐C3N4,在磁力搅拌器上进行吸附处理,搅拌过程避光。每隔5 min取样一次,用0.45 μm的微孔滤膜过滤后,于485 nm处测定吸光度,计算橙黄II的吸附率。Fe‐C3N4材料吸附饱和时间为30 min。
催化降解实验:取质量浓度为25 mg/L的目标污染物橙黄II 200 mL置于锥形瓶中,先加入Fe‐C3N4材料,在黑暗的环境中反应30 min,使其吸附饱和,再加入过硫酸钠,在磁力搅拌器上进行降解反应,采用250 W高压钠灯提供可见光光源,钠灯主波长为400~800 nm。每隔30 min取样一次,用0.45 μm的微孔滤膜过滤后,于485 nm处测定吸光度,并计算橙黄II的降解率:
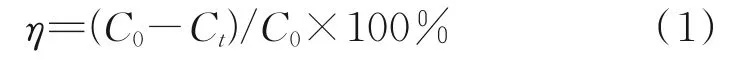
式中,η为降解率,%;C0为橙黄Ⅱ初始质量浓度,mg/L;Ct为橙黄Ⅱt时刻质量浓度,mg/L。
2 结果讨论
2.1 g‐C3N4和Fe‐C3N4红外表征
图1为g‐C3N4和Fe‐C3N4的FT‐IR图谱。从图1可 以 看 出,g‐C3N4的 吸 收 峰 主 要 集 中 在808、1 240~1 639、3 100~3 500 cm−1,这与文献[17]相同。808 cm−1附近的吸收峰对应三嗪环状化合物的弯曲振动[18];1 240~1 639 cm−1的吸收峰对应碳氮芳香杂环化合物的伸缩振动[19];3 100~3 500 cm−1的宽波段吸收峰对应N−H的伸缩振动,说明直接热解三聚氰胺得到的产物不完全缩聚,层状结构的边缘存在N−H[20]。从图1还可以看出,Fe‐C3N4的吸收峰也主要集中在808、1 240~1 639、3 100~3 500 cm−1,说明Fe掺杂不改变g‐C3N4的骨架结构,有利于发挥其光催化性能。
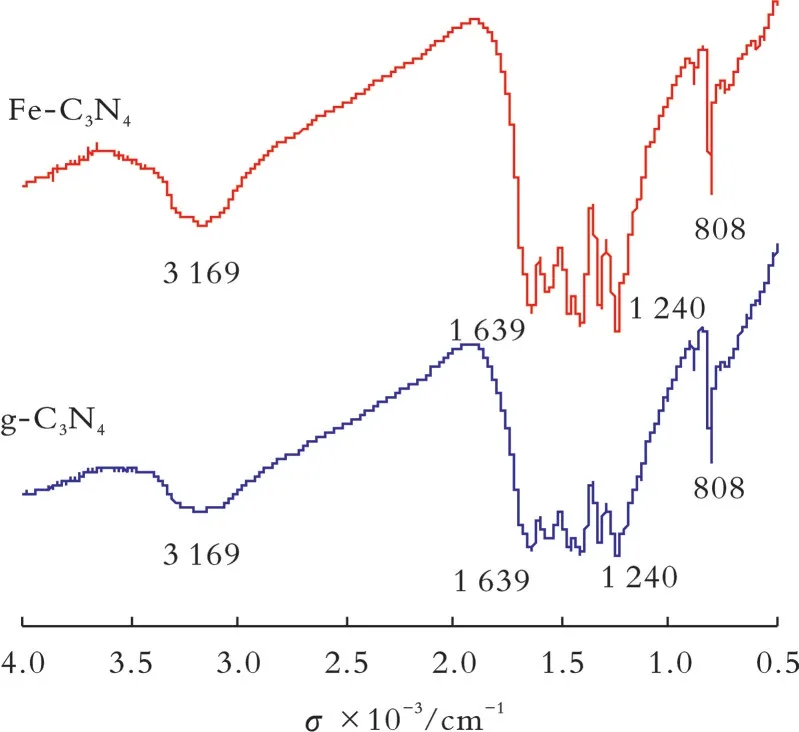
图1 g‐C3N4和Fe‐C3N4的FT‐IR图谱
2.2 过硫酸钠与污染物物质的量比对降解效果的影响
在橙黄II初始体积为200 mL、橙黄II初始质量浓度为25 mg/L和Fe‐C3N4质量浓度为2.0 g/L的条件下,考察了过硫酸钠与污染物物质的量比对降解效果的影响,结果见图2。

图2 过硫酸钠与污染物物质的量比对降解效果的影响
从图2可以看出,随着反应的进行,体系对橙黄II的降解率快速提升,当反应时间为30 min时,四组体系对橙黄II降解率均大于50.0%,过硫酸钠与污染物物质的量比为500∶1、700∶1、1 000∶1、1 200∶1时,橙黄II的降解率分别为59.4%、61.8%、60.1%、63.8%;继续增加反应时间,降解率缓慢提升,当反应时间为180 min时,橙黄II的降解率分别为75.6%、76.6%、75.3%、77.8%。其中,过硫酸钠与污染物物质的量比为1 200∶1时降解率最高,这是因为随着过硫酸钠的质量增加,体系中S2O的含量也逐渐增大,在体系中催化剂浓度相同的条件下能够更迅速有效地活化出SO·,SO·越多对污染物的氧化降解程度也就越完全。四组体系的降解效果差别不是很明显,这是因为当过硫酸钠物质的量较小时,催化剂提供的活化点位有限,不能活化过硫酸钠产生更多的SO−4·,所以污染物的降解效果不会进一步增加。
2.3 Fe‐C3N4质量浓度对降解效果的影响
在橙黄II初始体积为200 mL、橙黄II初始质量浓度为25 mg/L和过硫酸钠与污染物物质的量比为1 200∶1的条件下,考察了Fe‐C3N4质量浓度对降解效果的影响,结果见图3。

图3 Fe‐C3N4质量浓度对降解效果的影响
从图3可以看出,随着反应的进行,体系对橙黄II的降解率快速提升,当反应时间为30 min时,质量浓度为0.5 g/L的Fe‐C3N4的降解率最低(51.1%),质量浓度为2.0 g/L的Fe‐C3N4的降解率最高(71.1%);继续增加反应时间,降解率缓慢提升,当反应时间为180 min时,质量浓度为2.0 g/L的Fe‐C3N4的降解率最高(84.1%),这是因为随着Fe‐C3N4质量浓度的增加,增大了Fe‐C3N4与过硫酸钠的接触面积,单位时间内能够更有效地催化过硫酸钠,释放更多的SO−4·,氧化降解的效率也随之增加。因此,可以通过控制催化剂的用量来控制反应速度。
2.4 橙黄II初始质量浓度对降解效果的影响
在Fe‐C3N4质量浓度为2.0 g/L和过硫酸钠与污染物的物质的量比为1 200∶1的条件下,考察了橙黄II初始质量浓度对降解效果的影响,结果见图4。

图4 橙黄II初始质量浓度对降解效果的影响
从图4可以看出,橙黄II的降解率随橙黄II初始质量浓度升高而降低,不同体系对橙黄II的降解率差异比较大;当反应时间为30 min时,橙黄II初始质量浓度为10、20、50 mg/L对应的降解率分别为68.5%、56.7%、44.6%;当反应时间为180 min时,污染物低质量浓度体系对橙黄II的降解率最高(87.6%)。
2.5 pH对降解反应效果的影响
在橙黄II初始体积为200 mL、橙黄II初始质量浓度为25 mg/L、Fe‐C3N4质量浓度为2.0 g/L和过硫酸钠与污染物的物质的量比为1 200∶1的条件下,考察了pH对降解效果的影响,结果见图5。

图5 pH对降解效果的影响
从图5可以看出,在酸性或偏酸性的条件下,降解效果较好。这是因为在酸性条件下,过硫酸钠分解产生过硫酸根的反应活化能略低于中性条件下的活化能,更多的硫酸根自由基与污染物进行反应;当pH升高时,体系中存在的大量OH−容易与过硫酸根反应形成硫酸根自由基,导致自由基消失速度大于生成速度,表现为催化反应降解率下降。
2.6 降解反应动力学
为了进一步研究Fe‐C3N4光催化活化过硫酸钠在不同质量浓度污染物的降解效果与时间的关系,采用Lagergren准一级动力学模型与准二级动力学模型对数据进行拟合[21]。两个模型的方程如下:
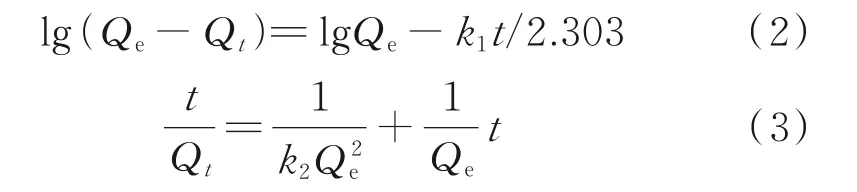
式中,k1为准一级动力学速率参数,min−1;k2为准二级动力学速率参数,g/(mg·min);Qe和Qt分别为污染物最大降解量和t时刻的污染物降解量,mg/g;t为反应时间,min。
降解反应动力学相关参数见表1。由表1可知,准二级动力学方程相关性比准一级动力学方程更高,Fe‐C3N4/过硫酸钠体系对偶氮染料的降解满足准二级动力学方程。

表1 降解反应动力学相关参数
2.7 回收次数对降解效果的影响
为了验证Fe‐C3N4材料的重复利用性,在最优条件下反应达到平衡后,将Fe‐C3N4材料进行回收,考察了Fe‐C3N4材料回收次数对降解效果的影响,结果见图6。同时,对第3次反应前后的Fe‐C3N4材料进行了XRD表征,结果见图7。
从图6可以看出,催化剂回收3次后,仍对橙黄II有较好的去除效果。从图7可以看出,反应后的Fe‐C3N4材料在2θ为13.1°和27.5°附近有两个特征峰,且反应前后的衍射峰基本没有变化。因此,Fe‐C3N4材料回收后的结构未发生改变,具有可重复利用性。

图6 Fe‐C3N4材料回收次数对降解效果的影响
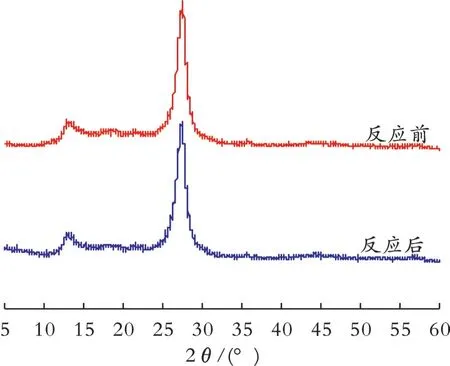
图7 Fe‐C3N4材料反应前后的XRD图
3 结 论
(1)采用浸渍法制备的Fe‐C3N4催化过硫酸钠可以有效降解偶氮染料。
(2)Fe‐C3N4质量浓度为2.0 g/L时,橙黄II的降解效果最好,去除率为71.1%;过硫酸钠与污染物物质的量为1 200∶1时,降解速率最快,为77.8%。
(3)实验中投加的Fe‐C3N4材料为粉末状,不易回收,在今后研究中,可以制成球状或其他形状,使其回收利用更加方便,增加其实际应用的可能性。
