促分裂原活化的蛋白激酶信号通路与能量代谢的关系
2022-11-16张可可伍梅芳谢杜红李韶菁
张可可 伍梅芳 谢杜红 李 菁 李韶菁
(1 中国中医科学院中药研究所,北京,100700;2 长沙卫生职业学院,长沙,410000;3 湖南中医药大学第一附属医院,长沙,410000)
生物体的生长、发育、衰老等一切生命活动均需要能量。以物质代谢为基础,与物质代谢的过程相伴随发生的能量转化过程,叫能量代谢[1]。能量代谢是一切生命过程的基本环节。能量代谢每时每刻在机体内有条不紊地进行着,各种物质转运小到细胞膜上的主动转运、继发性主动转运,大到三大物质的分解合成,都与能量代谢相关。正是能量代谢的正常完成,保证了机体维持着细胞内环境的稳态、系统之间的稳态、生物体的协调运作。
正常状态的能量代谢可以维持生命体、细胞的各个生理活动。异常状态的能量代谢则造成了各种疾病的病理过程,不同病理状态下物质代谢的途径也有不同。在众多的疾病中,能量代谢异常已成为其中的重要病理生理环节。如糖尿病因糖代谢的异常,造成一系列病理环节,最终导致血糖的升高[2];如炎症的患者,多呈高代谢状态,每日出入的补液量都要特殊计算;如各种肿瘤类疾病,大多代谢呈增高状态,也有其代谢特点:瓦尔堡效应,即有氧环境下的糖酵解[3]。这种特殊状态下的糖酵解途径,不仅为肿瘤细胞的生长提供了ATP,同时又为肿瘤细胞侵袭周边组织创造了有效的微环境。因此,通过改变机体的能量代谢状态,可达到治疗某些疾病的目的,且对于一些治疗药物,能量代谢促分裂原活化的蛋白激酶(Mitogenactivated Protein Kinase,MAPK)通路与肿瘤的耐药性也是相关的[4]。本文汇总了一些与能量代谢相关的MAPK家族通路及靶点,对于今后的实验研究,阻断相关靶点,从而阻断肿瘤细胞的能量代谢提供研究方向。
1 能量生成和三大代谢
生物体内供能的物质基础是糖类和脂质、氨基酸[1],而能量代谢则与三大物质代谢相伴而行。机体利用能量不能直接利用物质代谢,而是需要通过物质代谢氧化分解产生的能量货币——ATP进行能量的使用。
糖代谢主要是通过糖的无氧酵解和有氧氧化产生ATP为机体提供直接能量,同时产生递氢体和递电子体还原型烟酰胺腺嘌呤二核苷酸和还原型黄素腺嘌呤二核苷酸进入线粒体,在线粒体内膜上,进入氧化呼吸链,发生氧化磷酸化,产生更多的ATP,从而为生物体供能。糖代谢的另一条旁路称为磷酸戊糖旁路,反应部位位于细胞胞浆,则可以为细胞提供大量的还原型烟酰胺腺嘌呤二核苷酸,参与细胞的氧化呼吸。另外,糖原的合成可以为机体储存能量;而糖原的分解可以调节血糖;糖异生可以维持机体血糖稳定,补充糖原储备,维持体内酸碱平衡。当糖代谢发生异常,则出现糖尿病等内分泌系统疾病。正常细胞在有氧环境下进行有氧呼吸,在无氧条件下进行无氧酵解;而肿瘤细胞则在有氧环境下也会进行糖酵解,这种过程称为瓦尔堡效应[2]。
脂类代谢包括脂肪的代谢和类脂的代谢。三酰甘油是机体重要的能量来源,1 g三酰甘油完全氧化可以产生38 kJ的能量,是相同重量蛋白质或碳水化合物的两倍多。其中脂肪酸的β氧化可以放出大量ATP。研究表明,在肿瘤等一些疾病状态下,脂类代谢的关键酶呈高表达状态[3]。
氨基酸代谢主要包括2个过程,一个是由各种小分子合成各种蛋白质、肽类、含氮化合物,一个是通过转氨、脱氨等作用从大分子含氮化合物分解成为α-酮酸、胺类及二氧化碳,并释放出能量。正常情况下各种氨基酸的代谢能够维持机体的正负氮平衡状态,维持细胞组织的生长、更新和修补,承担了各种生命活动的物质基础。在一些肿瘤类疾病中,肿瘤细胞通过增加谷氨酰胺等一些非必需氨基酸的摄取和利用,以达到维持自身氧化还原状态的目的[5]。
MAPK是哺乳动物内广泛存在的一类丝/苏氨酸蛋白激酶,可以被一系列的细胞外信号或刺激所激活,如物理应激、炎症介质、生长因子、细菌复合物等。激活后的MAPK通路影响着细胞增殖、细胞分化、凋亡、应激反应等各种生物效应。生物体内细胞与细胞之间、细胞膜与细胞质细胞核之间的相互影响、相互作用主要依靠细胞之间的信号转导。MAPK是一系列级联反应的成分,是多种胞外刺激的关键因素,能够调节基本的细胞过程。MAPK通路作为一种常见的蛋白激酶偶联受体介导的信号转导通路,研究发现,能量代谢与MAPK通路有着非常密切的联系。MAPK信号通路主要途径包括Ras-Raf-胞外信号调节激酶(Extracellular Signal-regulated Kinase,ERK)1/2通路、ERK5通路、P38通路(P38蛋白)、Jun激酶(Jun Kinase,JNK)通路[2-3]。见图1。
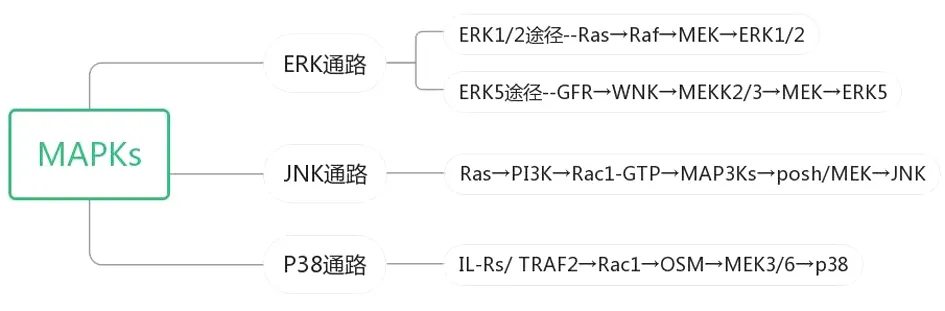
图1 能量代谢相关信号通路
2 能量代谢与细胞外信号调节蛋白激酶通路的关系
ERK是一种将信号从细胞表面传递到细胞核的一种关键蛋白,它包括ERK1、ERK2、ERK3。ERK通路的信号转导,同样遵循MAPK家族的三级激酶级联反应,其基本过程是:受体配体相结合形成二聚体,激活了受体本身所具有的蛋白激酶活性,受体自身酪氨酸基团发生磷酸化,暴露其结合位点,从而与含有共同结构域Src同源物-2(Src Homology-2,SH2)的接头蛋白生长因子蛋白,然后与生长因子结合蛋白(Growth Factor Receptor-bound Protein,GRB)相结合,紧接着,GRB将含有脯氨酸序列的鸟嘌呤核苷酸交换因子SOS蛋白活化,活化的SOS结合大鼠肉瘤病毒(Rat Sarcoma,Ras)蛋白,Ras从而结合GTP(鸟苷三磷酸),激活快速生长纤维肉瘤(Rapidly Accelerated Fibrosarcoma,RAF)蛋白,即促分裂原活化的蛋白激酶激酶激酶(Mitogen-activated Protein Kinase Kinase Kinase,MAPKKK),接着发生级联反应,激活促分裂原活化的蛋白激酶激酶(Mitogen-activated Protein Kinase Kinase,MAPKK),进而激活促分裂原活化的蛋白激酶(Mitogen-activated Protein Kinase,MAPK),即通过Ras→Raf→MEK→ERK1/2这一通路,通过激酶的连续激活从而改变蛋白质(包括转录因子、细胞骨架、酶等)的磷酸化状态,进而影响着基因的表达,如桩蛋白、核糖体S6激酶(ribosomal S6 kinase,RSK)、分裂素-应激活化激酶(Mitogen-and Stress-activated Kinase,MSK)、cAMP反应元件结合蛋白、核因子κB、c-Myc(米克基因)、Elk1、热激转录因子(Heat Shock Transcription Factor-1,HSF-1)等)、从而进一步调控细胞的生长和分化、形态、代谢等。另一条ERK通路是通过激活生长因子受体(Growth Factors Receptors,GFR),进而激活赖氨酸缺乏蛋白激酶(With No lysine,WNK)接着激活促分裂原活化的蛋白激酶激酶2/3(MEKK2/3),激活促分裂原活化的蛋白激酶激酶5(MEKK5)、激活ERK5(胞外信号调节激酶5),从而进入细胞核,影响着TCF(转移生长因子)、肌细胞增强因子2(myocyte Enhancer Factor 2,MEF2)等各种生物学效应的产生[5]。
2.1 ERK通路与糖代谢的联系 近年来有学者发现,ERK-Elk-DNMT1通路与有氧呼吸有关,小分子抗肿瘤化合物奇果菌素(Grifolin)通过抑制该通路中的基因DNMT1表达,导致了线粒体有氧呼吸增强,无氧酵解减弱,从而抑制了肿瘤的异常的糖代谢途径[6]。
2.2 ERK通路与脂肪酸代谢的联系 肝脏组织中的p-ERK蛋白,有助于改善高脂血症的大鼠的胰岛素抵抗,从而改善了血糖水平,减少脂肪组织的增多,从而改善了肥胖水平[7]。
2.3 ERK通路与氨基酸代谢的联系 谷氨酰胺(GLUN)作为一种无毒的细胞运送氨的形式,为机体提供了谷氨酸,进而参与三羧酸循环循环,参与机体蛋白的合成,亦是一种嘌呤和嘧啶合成的原料。每合成1 mol尿素,消耗3 molATP。这无疑是一个耗能的过程。实验发现,幼稚的T细胞激活成为成熟的T细胞,这一过程需要大量营养物质和能量,提供大量能量。谷氨酰胺,不仅可以作为一种脑、肌肉等组织向肝肾的运氨形式,在谷氨酰胺酶的作用下为机体提供谷氨酸,还影响着T细胞的增殖与细胞因子的产生。通过实验表明,谷氨酰胺的损耗会阻断T细胞增殖和细胞因子的产生,导致幼稚的T细胞不能顺利地体积增大,增殖和分化。并且,通过补充其他氨基酸包括谷氨酰胺的直接生物前体并不能缓解对T细胞的损害。细胞摄取谷氨酰胺、代谢谷氨酰胺这一过程是通过ERK通路实现的。ERK作用于T细胞受体/CD28信号的下游,调节c-Myc基因的表达,调节谷氨酰胺酶mRNA的转录和稳定性,从而调节谷氨酰胺吸收。因此ERK信号通路是一个对于细胞能量代谢重要的调节器,其增强了对于谷氨酰胺的摄取和关键酶的活性[8]。
3 能量代谢与JNK通路的关系
在MAPK信号通路中的另一个亚类是c-Jun氨基端蛋白激酶(c-Jun N-terminal Protein Kinase,JNK),又称应激激活的蛋白激酶(Stress-activated Protein Kinase,SAPK)。这条信号转导通路与细胞的凋亡、炎症以及应激反应相关。与其他MAPK家族的信号转导一样,JNK信号转导通路也是遵循级联反应进行的。JNK位于该通路下游,在外界条件的刺激下,信号可以由上游经典的Ras蛋白转导,经由Ras→PI3K→Rac1-GTP→MAP3Ks→posh/MEK→JNK,即:大鼠肉瘤(Rat Sarcoma,Ras)→磷脂酰肌醇3激酶(PI3K)→Rac1-GTP结合蛋白→丝裂原活化蛋白激酶激酶激酶激酶(MAP3Ks)→丝裂原活化蛋白激酶激酶(MEK)→c-Jun氨基端蛋白激酶(JNK),从而进入细胞核,作用于相应的基因转录调控因子(如HSF1(热休克转录因子1)、STATs转录因子、TCF转录因子、ATF因子、BCL2因子、P53因子、c-JUN因子、c-Fos因子、HSC热休克蛋白C等),影响细胞的转录与翻译,从而产生各种生物学效应,调控细胞的各种代谢,包括蛋白质合成、细胞的成活、肿瘤的迁移、肿瘤的扩散以及葡萄糖的代谢。在JNK信号系统中有几个关键蛋白如磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PI3K)、PI3K-蛋白激酶B(Protein Kinase B,AKT)信号系统。
3.1 JNK通路与糖代谢的联系 众所周知,肌体的器官和组织主要的能量来源是糖,当机体产生胰岛素抵抗或胰岛素分泌不足的时候,糖代谢发生障碍,机体无法利血糖而造成的血糖升高,这是2型糖尿病的病因。产生胰岛素抵抗的关键分子机制是由于胰岛素受体底物(Insulin Receptor Substrate,IRS)的丝氨酸发生了磷酸化。脑组织的衰老过程中,涉及到一个代谢的三联体,即线粒体,胰岛素/胰岛素样生长因子-1信号转导和JNK信号转导,即胰岛素抵抗往往伴随着线粒体的受损。Ras-MAPK通路与细胞的生长、分化、蛋白的合成密切相关。大脑中的胰岛素/胰岛素样生长因子-1(Insulin/insulin-like Growth Factor 1(IGF-1)Signaling,IIS)信号转导与JNK二者之间的平衡对于线粒体功能的影响至关重要。JNK信号通路参与多种细胞应答的调节,包括在不同刺激下细胞的转录、成活和凋亡。作为一种促凋亡的激酶,活化的JNK的磷酸化14-3-3蛋白,这种蛋白是一种胞质B淋巴瘤-2相关X蛋白(B-cell Lymphoma-2 Associated X,Bax)的锚定物,从而促进Bax到线粒体的迁移,进一步启动线粒体依赖性细胞的凋亡过程[9]。
研究表明,肝脏、脑、骨骼肌、胰腺、脂肪、肌肉中的JNK通路激活会影响胰岛素的灵敏度[10]。脂肪细胞的葡萄糖摄取可以通过人参皂苷Rb2来调节。这一现象是通过主要通过激活IRS(胰岛素受体底物)-1-PI3K-AKT/PKB(蛋白激酶B)通路实现的,并且在脂肪组织中,其中作为靶点的AKT的Rb2磷酸化与糖代谢相关[11]。通过运用JNK1和JNK2缺失的小鼠、细胞进行的实验,证明了JNK的活性增高,导致2型糖尿病的原因[12]。通过实验发现,菊苣菊糖通过激活IRS,在体内和体外均抑制MAPK通路,从而改善了糖脂代谢[13]。通过研究发现,水飞蓟宾可以通过激活PI3K-AKT从而调节CFLAR-JNK通路,最终改变葡萄糖摄取[14]。
一方面,胰岛素分泌不足可以抑制己糖激酶、葡萄糖激酶、肝糖原合成酶的活性,造成糖原合成减弱;可以抑制磷酸果糖激酶、丙酮酸激酶活性,造成糖酵解减弱,导致机体红细胞供能不足,携氧能力变差,供氧耗氧平衡打破,导致能量代谢障碍;6-磷酸葡萄糖脱氢酶、6-磷酸葡萄糖酸脱氢酶活性降低,造成磷酸戊糖旁路减弱,使得从该途径产生的还原型烟酰胺腺嘌呤二核苷酸减少,进入氧化呼吸链的递氢体减少,从而减少了机体ATP的生成。另一方面,胰岛素分泌不足,使得磷酸化酶、磷酸酶活性增强,导致糖原分解加强;果糖1,6-二磷酸酶、丙酮酸羧化酶、磷酸烯醇式丙酮酸羧基酶活性增强,导致糖异生加强[15]。
由于JNK通路的改变造成的发生糖代谢的紊乱,可引起脂代谢和蛋白质代谢相继发生紊乱,最终又可造成新的能量代谢障碍。具体表现在,三酰甘油的大量分解,游离脂肪酸大量生成,造成不彻底氧化,乙酰乙酸、β-羟丁酸、丙酮大量生成,造成酮体增高,发生酮症酸中毒、高渗性昏迷等严重并发症。在机体发生这样的代谢性酸中毒,反过来又可以刺激心血管系统,合并高血钾症,导致心律失常,心脏泵血供能障碍;又可导致血管扩张,大量血液滞留在微循环内,二者效果相互叠加,最终导致有效血容量不足,造成心、脑供血供氧不足,供氧与耗氧平衡被打破,造成休克,又造成了新的能量代谢障碍。
3.2 JNK通路与脂代谢的联系 实验发现,肝细胞中,胱天蛋白酶8和Fas相关死亡结构域样细胞凋亡调节蛋白(Caspase 8 and Fas-associated Protein with Death Domain-like apoptosis regulator,CFLAR)-JNK通路与脂类代谢相关,且用一种用于稳定肝细胞膜的抗氧化剂水飞蓟宾,可改变细胞的脂质代谢,从而治疗非酒精性脂肪性肝炎,这是通过调节参代谢的下游靶基因(PPARα基因,SREBP-1C基因和PNPLA3基因)的机制而实现的[16]。研究发现,有药物乌贡宁可以显著降低核因子κB,通过抑制核因子κB和MAPK,ERK,C-Jun(JNK)和P38活性磷酸化,最终显示出对对乙酰氨基酚诱导的肝损伤的保护作用,改善了脂质代谢,调节了血清中的总胆固醇和三酰甘油[17]。
3.3 JNK通路与氨基酸代谢的关系 谷氨酰胺作为一种非必需氨基酸,可以在三羧酸循环衰竭时作为对能量的补充[18-19]。它是合成代谢的重要燃料和关键细胞应答,如哺乳动物雷帕霉素靶蛋白复合物1(Mammalian Target of Rapamycin Complex 1,mTORC1)的活化和自噬[20-23],mTOR是一种关键蛋白,它可以介导细胞的自噬和蛋白质的合成、生长因子受体的表达[24]。实验发现,当谷氨酸被剥夺时,可以引起白细胞介素-8的释放,从而引起细胞自噬。这一现象的机制则是由于转录和细胞去化因子分泌的mTORC1-IRE1-JNK通路的激活所致[25]。
4 能量代谢与P38通路的关系
MAPK家族还有一类是P38MAPK通路,该蛋白有5个亚型,分别是P38α、P38β1、P38β2、P38γ和P38δ。该蛋白位于MAPK下游,在各种细胞因子如各种炎症介质和应急刺激(如紫外线、过氧化物、热温、高渗状态)等外界条件的刺激作用下,作用于白细胞介素受体(白细胞介素或者肿瘤坏死因子受体相关因子2(Tumor Necrosis Factor Receptor Associated Factor 2,TRAF2),从而激活胞浆里的Rac1蛋白,接着激活抑瘤素M蛋白,然后激活MEK3/6,最后激活P38,即白细胞介素-Rs/TRAF2→Rac1(Rac1蛋白)→OSM蛋白→MEK3/6→P38,最后进入细胞核,作用于下游各种基因(如ATF、MAPKAPK2、P53、MNK、核因子κB、CHOP蛋白等),从而产生细胞的氧化应激等各种生物学效应[26]。
4.1 P38通路与糖代谢的关系 P38通路与血糖的调节相关。有动物实验证明,某些药物,如丁酸钠治疗通过P38/ERK MAPK通路和凋亡通路的调节,改善了儿童糖尿病大鼠的B细胞增殖、功能和葡萄糖稳态,降低了其细胞凋亡[27]。另外,在相关研究中发现,在营养缺乏的饥饿状态下,MAPK14/P38α激活导致SLC2A3蛋白/GLUT3蛋白表达和葡萄糖摄取的增加[28]。
4.2 P38通路与脂代谢的关系 在代谢旺盛的组织器官如脂肪组织、骨骼肌、胰岛细胞、肝脏中,P38均参与了各种重要代谢[29]。在脂肪酸的代谢中,P38也起着很重要的作用。实验发现,ERK通路与P38通路均参与了脂肪细胞对成骨细胞的脂毒性[30]。还有实验发现,血浆游离脂肪酸的小幅度上升,会引起单核细胞中的Toll样受体4上调,从而激活炎症通路MAPK通路。这提示着部分肥胖患者或者2型糖尿病胰岛素抵抗患者的低度炎症症状,是由于体内游离脂肪酸过多刺激单核巨噬系统引起的[31]。
4.3 P38通路与氨基酸代谢的关系 有研究发现,氨基酸的增加会引起肝细胞内的关键酶2-6,二磷酸果糖浓度的增加,从而引起糖酵解的减弱,糖异生的增强。这一过程是PI3K和P38信号转导通路的激活所致[30]。从而进一步激活mTORC1或mTORC2、AMP活化蛋白激酶。
综上所述,MAPK家族信号通路与能量代谢关系非常密切,每个通路中均有与能量代谢相关的靶点,其中P38通路对代谢的影响尤为突出。掌握这些通路、靶点与能量代谢的关系,有助于我们就实现精准医疗。
5 讨论
由于各种疾病可能会有能量代谢的改变,如肿瘤可引起糖代谢通量的改变,如非酒精性脂肪性肝炎的脂代谢改变。某些药物通过抑制某条通路的某个靶点,阻断信号转导;或者抑制葡萄糖转运体;或者通过抑制某个代谢环节的关键酶,如抑制己糖激酶、抑制磷酸果糖激酶、抑制丙酮酸激酶、抑制乳酸排出或转运的单羧酸转运酶和乳酸脱氢酶,药物通过调节通路的代谢,以改变细胞糖代谢通量的方式,切断细胞的某个能量代谢的环节,诱导细胞自噬、凋亡,阻断了细胞的生长状态,从而达到抑制肿瘤细胞生长、增殖的作用。通过对这些通路、通路、靶点的进一步深入研究,对于临床上的疾病,特别是与能量代谢相关的肿瘤类疾病、与能量代谢相关的内分泌系统疾病的治疗具有理论指导意义。但由于各通路之间存在交互作用,这些多条通路的研究还处于起步阶段,需要今后对其更深入进行分析。
