小檗碱调控核因子κB信号转导通路对幽门螺杆菌感染人胃癌细胞的影响
2022-11-16徐艳霞刘圆圆
高 炜 徐艳霞 刘圆圆 徐 媺
(青岛市中心医院/青岛市肿瘤医院中西医结合科,青岛,266042)
胃癌属于临床上较为常见的一种消化系统恶性肿瘤,随着人们生活方式的不断改变其发病率正呈逐年上升趋势,已成为严重威胁人类生命安全的重大疾病之一[1]。且有研究报道表明,幽门螺杆菌(Helicobacter Pylori,Hp)感染可能参与了胃癌的发生、发展过程,促进了胃黏膜细胞的凋亡[2]。目前,临床上广泛用以治疗胃癌的化疗药物普遍存在细胞毒性,患者接受治疗后往往会出现严重不良反应,从而影响治疗效果以及患者的预后转归[3]。因此,近年来不少医学研究人员开始将研究重点转移至从天然药物内寻求存在抗肿瘤活性,且毒性较低的成分。小檗碱主要是由黄连等天然植物中提取而来,具有一定的抑制肿瘤细胞增殖作用[4]。鉴于此,现通过研究小檗碱调控核因子κB信号转导通路影响Hp感染人胃癌细胞增殖与炎症反应的影响并予以分析,深入探究小檗碱应用于胃癌中的可能机制,继而为临床胃癌的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 Hp标准菌株由课题组细胞培养室获得。胃癌HGC-27细胞系购于中国科学院典型培养物保藏细胞库传代获得。
1.1.2 药物 小檗碱(碧云天生物技术公司,批号:040801),质量分数≥98%。
1.1.3 试剂与仪器 胎牛血清及DMEM培养基(Gibco公司,美国,货号:16000-044、12800017)。超净工作台(北京东联哈尔仪器制造有限公司,型号:SCB-1360)。二氧化碳培养箱(Thermo公司,美国,型号:311)。酶标仪(Perkin Elmer公司,美国,型号:EnSpire)。DAB显色试剂盒(博士德生物公司,批号:AR1026)。
1.2 方法
1.2.1 分组与模型制备 建立Hp感染人胃癌细胞模型:胃癌HGC-27细胞系培养在普通的DMEM培养基中,配方添加了10%的胎牛血清,1%双抗储存液的DMEM的培养基,培养于37 ℃、5% CO2的细胞培养箱中。Hp的培养条件气体环境是:5%氧气、85%氮气及10%二氧化碳,湿度要求为95%。采用固体培养基培养3 d并且通过紫外分光光度计进行计数。按照比例关系将Hp加入到胃癌细胞中进行共同培养,检测Hp对胃癌细胞增殖的影响。
将上述1)细胞模型分成4组,包括对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组。其中对照组则予以等量生理盐水干预;黄连素组予以100 μg/mL浓度小檗碱干预;5-氟尿嘧啶组予以5 μg/mL的5-氟尿嘧啶干预;黄连素+5-氟尿嘧啶组则同时予以上述剂量的小檗碱和5-氟尿嘧啶干预;每组设3个复孔。
1.2.2 检测指标与方法 以流式细胞仪完成细胞周期的检测Hp和胃癌细胞共同培养3 d后,将对照组和其他组细胞进行消化,磷酸盐缓冲液洗过之后用细胞周期检测试剂盒的实验步骤进行处理,然后在BD FACSCalibur细胞仪上进行分析,最后的实验结果通过flow Jo软件进行分析。
胃癌细胞增殖情况评估:将Hp感染人胃癌细胞进行消化计数,在96孔板中每个孔加入1 000个细胞,12 h后检测第1次细胞活力检测试剂盒(CCK8)数值,剩余的样本待细胞贴壁后按比例关系将Hp加入到B~黄连素+5-氟尿嘧啶组中,各组都有3个孔的重复,24 h,48 h和72 h之后再次检测CCK8数值。
核因子κB信号通路相关蛋白表达检测:采集上述上清液以Bradford法测定IκB激酶α以及P65蛋白浓度。将20 μg蛋白和6×SDS加样缓冲液混合,以100 ℃煮沸5 min,实施10%的SDS聚丙烯酰胺凝胶电泳分离,并转移至聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜上。在室温条件下封闭4 h加入相应的一抗,4 ℃过夜后洗去一抗,并加入辣根过氧化物酶偶联的二抗,反应2 h。最后以二氨基联苯胺(DAB)显色,光密度扫描定量分析。相关抗体均购自美国Santa Cruz公司,货号:91-95-2。
炎症反应指标检测:调节细胞密度至1×105个/mL,接种在96孔细胞培养板内,每孔100 μL,于37 ℃的5%二氧化碳培养箱中进行24 h的培养。预处理1 h后,于37 ℃的5%二氧化碳培养箱中进行24 h的培养。手机细胞上清液,遵循酶联免疫吸附试验(ELISA)试剂盒说明书完成白细胞介素-4、白细胞介素-6水平的检测。相关试剂盒购自武汉博士德生物科技有限公司,货号:94218-72-1。
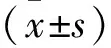
2 结果
2.1 各组Hp感染人胃癌细胞增殖情况比较 对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组干预后2 d、3 d时的胃癌细胞增殖率呈逐渐下降趋势,差异均有统计学意义(均P<0.05)。见表1、图1。
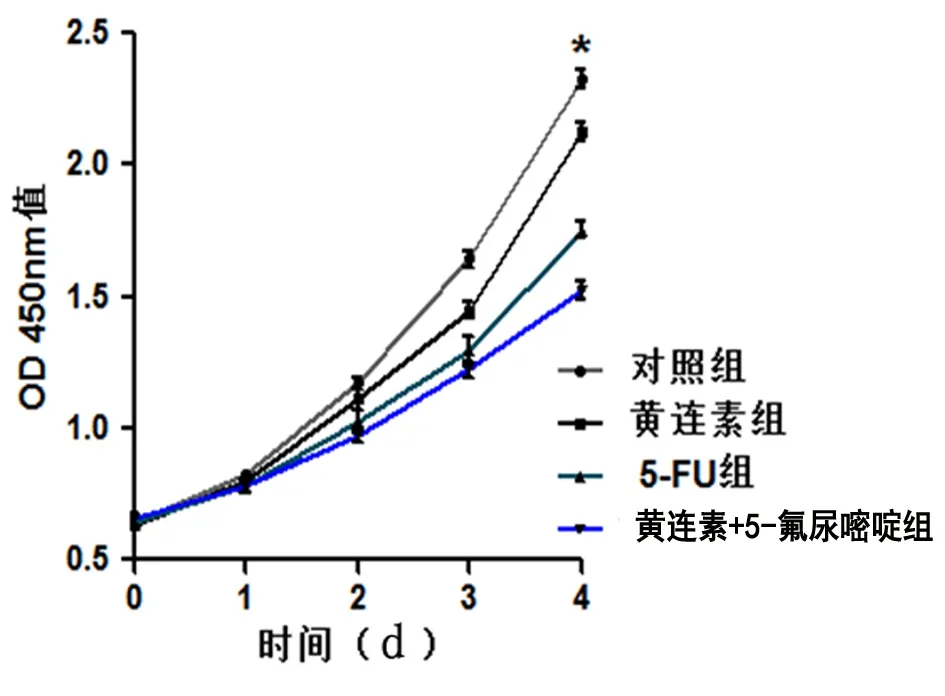
图1 不同处理方式对Hp感染人胃癌细胞增殖的影响
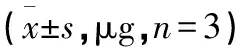
表1 各组Hp感染人胃癌细胞增殖
2.2 各组Hp感染人胃癌细胞周期变化比较 对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组感染人变化比较胃癌细胞G0/G1期、S期呈逐渐下降趋势,而G2/M期呈逐渐升高趋势,各组差异有统计学意义(均P<0.05)。见表2。
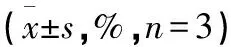
表2 各组Hp感染人胃癌细胞周期变化比较
2.3 各组核因子κB信号通路相关蛋白表达比较 对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组IκB激酶α表达水平呈逐渐升高趋势,而P65蛋白表达水平呈逐渐降低趋势,各组差异有统计学意义(均P<0.05)。见表3、图2。
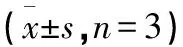
表3 各组核因子κB信号通路相关蛋白表达比较
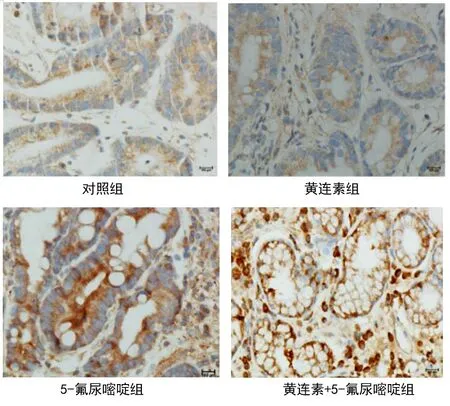
图2 各组IκB激酶α表达(HE染色,×400)
2.4 各组炎症反应指标水平评价 对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组白细胞介素-4水平呈逐渐升高趋势,而白细胞介素-6呈逐渐下降趋势,且经单因素方差分析可知各组差异均有统计学意义(均P<0.05)。见表4。
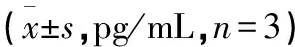
表4 各组炎症反应指标水平评价
3 讨论
目前,临床上已有不少研究报道证实,Hp感染在胃癌的发生、发展过程中起至关重要的作用,属于胃癌危险因素之一,且临床上超过50%的胃癌患者均可检测到Hp感染[5-7]。虽然近年来针对胃癌的治疗手段有明显的进步,但疗效以及预后均无法令人满意,鉴于胃癌的高发病率以及高死亡率,探讨胃癌的具体发病机制,并以此为依据寻找有效的治疗手段是研究学者的首要任务[8-10]。核因子κB属于哺乳动物细胞核转录因子之一,与多种恶性肿瘤的发生、发展密切相关,核因子κB信号转导通路于多种肿瘤中均处于活化状态,介导了肿瘤的侵袭以及转移过程[11-13]。由此可见,Hp感染可能是通过核因子κB信号转导通路,实现对胃癌发生、发展的调控,针对这一机制寻求一种有效的药物治疗方案具有极其重要的意义。小檗碱是近年来胃癌治疗研究的热点[14-16],然而关于其对胃癌细胞核因子κB信号转导通路是否产生影响尚无研究证实,具有一定的研究价值。
本研究结果发现,小檗碱的应用可明显抑制胃癌细胞的增殖,且在和5-氟尿嘧啶联合应用时的抑制效果更为明显。小檗碱可通过将细胞阻滞在G0/G1期,从而促使细胞无法进入S期合成DNA,进一步诱导胃癌细胞的凋亡,同时促使肿瘤细胞增殖受到明显抑制,最终发挥治疗胃癌的作用[17-18]。此外,对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组感染人胃癌细胞G0/G1期、S期呈逐渐下降趋势,而G2/M期呈逐渐升高趋势,各组差异有统计学意义。这提示小檗碱抑制胃癌细胞增殖的可能机制在于诱导肿瘤细胞周期阻滞在G1期、S期或G2/M期,从而抑制胃癌细胞的DNA以及蛋白质合成,最终发挥抑制胃癌细胞增殖的作用。另外,P65可通过和P50结合形成异二聚体,后者属于核因子κB的重要活化形式,且在正常生理状态下,核因子κB(P65/P50)与IκB激酶α结合,从而以无活性的复合物定位在细胞质内,当细胞遭受细胞因子或氧化应激刺激时,会引起核因子κB(P65/P50)与IκB激酶α的分离,且IκB激酶α会出现降解,进一步影响靶基因的转录以及表达,介导调控细胞增殖、凋亡以及转化,最终影响胃癌的发生、发展以及转移过程。而本研究结果发现,对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组IκB激酶α蛋白表达水平逐渐升高趋势,而P65蛋白表达水平呈逐渐降低趋势,各组差异有统计学意义。由此可见,小檗碱可能是通过调控核因子κB信号转导通路相关蛋白的表达,继而发挥抑制Hp感染人胃癌细胞增殖的作用。本研究结果还显示,对照组、黄连素组、5-氟尿嘧啶组以及黄连素+5-氟尿嘧啶组白细胞介素-4水平呈逐渐升高趋势,而白细胞介素-6呈逐渐下降趋势,各组差异有统计学意义。其中白细胞介素-6属于炎症起始阶段重要的炎症介质之一,与急性期炎症反应中可促进反应蛋白的产生以及关节软骨组织的损害。白细胞介素-4则是一种抗炎因子,可有效抑制多种炎症介质的表达。二者均被相关研究报道参与了胃癌的发生、发展过程[19-20]。由此可见,调控核因子κB信号转导通路影响炎症介质的表达,可能亦是小檗碱抗胃癌的重要机制之一。
综上所述,小檗碱具有明显的抑制Hp感染人胃癌细胞增殖与炎症反应作用,而发挥上述作用的主要机制可能和调控核因子κB信号转导通路相关蛋白的表达有关,值得临床重点关注。
