非酒精性脂肪性肝病与慢性肾病关系的研究进展
2022-11-16杨梦茹
杨梦茹,韩 睿
昆明医科大学第一附属医院 内分泌二科,昆明 650032
非酒精性脂肪性肝病(NAFLD)是一组与代谢功能紊乱及遗传易感因素相关的疾病。其疾病谱主要包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌[1]。目前慢性肾病(chronic kidney disease, CKD)作为NAFLD肝外相关疾病正得到越来越多的关注。经统计,非NAFLD患者CKD的患病率为5%~35%,而NAFLD患者CKD的患病率为20%~55%[2]。CKD已成为世界性公共卫生问题,全球等待替代治疗的终末期肾病患者已有490.2万~708.3万[3]。面对如此巨大的疾病负担,现阶段探明NAFLD与肾脏损害间的可能机制,实现疾病早期诊断、开展科学的临床管理,显得尤为重要。
1 NAFLD增加CKD发生风险的相关研究
在国外,越来越多证据表明NAFLD与CKD的发生密切相关。Targher等[4-5]的前瞻性队列研究发现NAFLD会增加2型糖尿病(diabetes mellitus type 2, T2DM)及1型糖尿病患者的CKD发病率。Seo等[6]则提出NAFLD患者存在进展期肝纤维化(FIB-4≥2.67)时才与T2DM患者CKD风险增加独立相关(aHR=1.75,95%CI:1.15~2.66)。2020年Kaps等[7]的回顾性队列研究显示,校正传统心肾危险因素后,NAFLD与CKD风险增加独立相关(HR=1.58,95%CI:1.51~1.66),这与Akahane等[8]同年发表文章中肥胖、高血压和高尿酸血症可作为NAFLD患者CKD独立预测因子的观点略有不同。此后,2022年Mantovani等[9]更新一项Meta分析证实,NAFLD患者中,第3期及以上CKD发生的长期风险增加了1.45倍,且与年龄、性别,及其他传统CKD危险因素无关,同时肝纤维化程度较高的患者更易发生CKD。
国内学者也对NAFLD与CKD的关系开展了积极探索。中国心脏代谢疾病和癌症队列研究[10]采用脂肪肝指数≥60诊断NAFLD,并利用AST/ALT比值评估肝纤维化程度,发现NAFLD及其肝纤维化严重程度与糖尿病前期、糖尿病患者CKD风险增加有关(aHR=1.33,95%CI:1.20~1.48),若患者糖化血红蛋白、血压、低密度脂蛋白胆固醇等代谢指标控制达标,上述疾病相关性可减弱。Liu等[11]开展的横断面队列研究也显示NAFLD患者CKD患病率高于非NAFLD患者(17.5% vs 13.9%,P<0.001),且NAFLD严重程度与CKD的发生发展呈正相关。Cai等[12]进行的研究分析表明,在校正糖尿病、肥胖、血脂异常和高血压等危险因素后,NAFLD与CKD仍相关。Zhang等[13]首次比较了不同种族NAFLD与早期肾功能下降的关系,指出NAFLD增加了中国和美国人群早期CKD的发病风险,但对于CKD晚期阶段,疾病复杂程度的增加可能减弱NALFD对CKD发生发展的影响。
总体而言,在糖尿病与非糖尿病患者中,通过生化指标、影像学或组织学诊断的NAFLD,与CKD显著关联的研究结论具有一致性。
2 NAFLD可能增加CKD发生风险的潜在机制
2.1 代谢综合征与炎症 2020年,国际专家小组建议将NAFLD更名为代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD),诊断标准为成人肝脂肪变基础上合并超重/肥胖、T2DM、代谢功能障碍三者之一,以强调代谢风险因素对肝病的影响[14]。Sun等[15]对我国第3次健康和营养调查(NHANES-Ⅲ 1988-1994)数据进行横断面分析发现,12 571例受试者中MAFLD和NAFLD的患病率分别为30.2%和36.2%。与NAFLD个体相比,MAFLD拥有更低的估算肾小球滤过率(eGFR)[(74.96±18.21)ml·min-1·1.73 m-2vs(76.46±18.24)ml·min-1·1.73 m-2,P<0.001]和更高的3~5期CKD患病率(29.60% vs 26.56%,P<0.05)。调整性别、年龄、种族、饮酒史和糖尿病因素后,MAFLD仍与CKD发病风险的增加有关,提示MAFLD可能比NAFLD更能识别CKD患者。但Deng等[16]对美国2017年—2018年NHANES数据的横断面调查未发现MAFLD与CKD存在独立关联,研究者通过亚组分析推测MAFLD与CKD之间的联系可能是由代谢异常因素介导。因此还需要更多研究明确MAFLD和CKD之间的关联。实际上,当常见疾病共存并具有共同的危险因素时,很难解释其间的因果关系及混杂因素的作用。肥胖(尤其是中心性肥胖)和胰岛素抵抗(insulin resistance, IR)既是代谢综合征的核心部分,也是NAFLD和T2DM的重要致病因素,临床中NAFLD和T2DM往往共存,协同增加肝内、外不良临床结局风险。研究[17]显示若存在NAFLD,T2DM发病风险大约增加2倍,且发病风险随NAFLD严重程度的增加而增加。T2DM同时也是NAFLD快速向NASH、肝纤维化、肝硬化进展,或导致肝病相关死亡的最强危险因素之一[17]。糖尿病肾病(diabetic nephropathy, DN)作为T2DM典型的微血管并发症,是CKD的一种重要类型,也是导致终末期肾病的主要原因。T2DM患者往往更易伴发代谢综合征的一些特征性疾病,如肥胖、高血压、血脂异常等,这些疾病状态可能造成肾素-血管紧张素-醛固酮系统激活、IR、多元醇代谢通路激活、高尿酸血症以及糖基化终末产物的形成并导致肾小管间质炎症和纤维化,造成继发性肾损伤[18]。
此外,NAFLD被认为是一种低级别炎症性疾病,炎症表现在NASH和晚期肝纤维化患者中更为显著[19]。研究[20]表明进行性胰岛素敏感组织功能障碍和IR在NASH发展中起着核心作用。炎性细胞,尤其是巨噬细胞浸润是胰岛素敏感组织功能障碍标志之一,巨噬细胞通过分泌TNF、IL-1β和IL-6等因子促发IR和炎症,并造成脂肪因子谱紊乱(低脂联素、高瘦素、高TNF水平)。肾脏血流灌注量极高,却并不具备类似肝脏组织的抗氧化、解毒和抗炎防御机制,因此在慢性疾病中更易受到伤害。持续性低度炎症状态是CKD发生发展的重要危险因素,与不良饮食模式、氧化应激、酸中毒、感染、脂肪组织及肠道微生物群代谢失调有关[21],营养管理是减缓CKD进展和预防终末期肾病的重要干预措施之一[22]。
2.2 过量果糖摄入与内源性果糖的产生 果糖是常用甜味剂蔗糖、高果糖玉米糖浆的主要成分,大量存在于高热量食品和含糖饮料中,肝脏、肾脏与肠道是果糖代谢的主要部位[23]。过量果糖摄入可增加脂肪酸产生,加重氧化应激和IR,这也提升了NASH、肝纤维化、肝癌的发生风险[24]。除膳食摄入外,人体还可以通过多元醇途径,利用醛糖还原酶和山梨糖醇脱氢酶将葡萄糖向山梨糖醇和果糖转化。果糖作为代谢过程中产生尿酸的唯一常见碳水化合物,在肝细胞中可被已酮糖激酶快速代谢,消耗ATP并导致尿酸积累,增加的尿酸又可利用正反馈调节机制刺激多元醇途径中的醛糖还原酶,致使内源性果糖增多。如此恶性循环,可能加重了尿酸介导的肾损害[25]。
2.3 尿酸代谢异常 血清尿酸水平升高被认为与NAFLD进展相关[26-27],黄嘌呤氧化还原酶是催化尿酸生成的关键酶,在NAFLD患者及小鼠模型中显示高活性[28-29]。尿酸因抑制一氧化氮合酶活性可加重IR,并以浓度依赖性的方式增加果糖激酶活性,促进果糖诱导的脂肪变性。尿酸还诱导肝细胞内质网应激,并从中调控甾醇调节元件结合蛋白,增加肝内甘油三酯(TG)的积累[30]。众所周知,因诱发高血压及肾小球灌注损伤、激活肾素-血管紧张素-醛固酮系统、增加氧化应激、导致线粒体功能障碍、促炎和促血管平滑肌细胞增殖,高尿酸血症也是CKD发生发展的独立危险因素[31-32],降尿酸治疗对延缓CKD进展有一定作用[33]。
2.4 饮食-肠道菌群轴失调 人体肠道内存在数千种与代谢相关的微生物群落,其结构可受宿主饮食习惯影响。高热量、低纤维饮食对肠道菌群生态有一定破坏作用。肠道菌群失调后,不但影响短链脂肪酸在肠道免疫调节、抗炎、抗癌、调节胰高血糖素样肽分泌等方面的作用,还增加内源性乙醇等肝毒性分子的生成,破坏肠道紧密连接进而影响肠道通透性,加之脂多糖(LPS)等肠源性病原体相关分子模式水平的升高,可促发“代谢性内毒素血症”。LPS还可与肝脏中特异性Toll样受体结合造成组织慢性低度炎症状态。此外,肠道菌群失调可能抑制血管生成素样蛋白4的分泌,引发β-氧化抑制和TG储存增加。大量胆碱因被细菌用于合成磷脂酰胆碱,或向二甲胺和三甲胺转化,其缺乏可加剧肝脏TG积累。三甲胺通过门静脉循环到达肝脏被氧化为三甲胺-N-氧化物(TMAO)后释放入血,TMAO水平升高往往与NAFLD严重程度呈正相关[34-35]。
实际上,循环TMAO浓度与肾功能损害呈正相关。作为重要的肾毒性分子,TMAO不仅加剧肾纤维化,还参与高血压、糖尿病、炎症、动脉粥样硬化等疾病或病理过程损害肾脏健康[36-37]。短链脂肪酸[38]和LPS[39]水平的变化,在CKD的发生发展中也起着重要的作用。其他肠道菌群失调所产生的肾毒性分子还包括马尿酸、苯乙酰谷氨酰胺、次级胆汁酸、吲哚、苯酚、硫酸苯酯等[40]。
2.5 氧化应激 在NAFLD患者中,脂代谢异常造成的慢性损伤与机体氧化剂/抗氧化剂失衡有关。脂质过氧化、β-氧化功能受损及内质网应激时,脂毒性的产生和活性氧(ROS)生成可诱发氧化应激,从而触发肝细胞应激途径导致炎症和纤维化,促进NASH发展。目前认为由Nrf2/ARE通路调节的抗氧化反应有助于恢复正常的脂质代谢,减轻氧化应激损伤[41]。而肾脏作为人体线粒体含量第二高的器官,氧化还原反应丰富,故极易受氧化应激的影响[42]。
2.6 血小板激活 氧化应激与血脂异常均为血小板活化的关键调节因素[43]。活化的血小板通过释放血小板衍生生长因子(PDGF)β、TGFβ、5-羟色胺等介质过度激活肝星状细胞(HSC),加之HSC本身收缩作用,为肝纤维化的发生和门静脉压力改变奠定了基础[44]。Kabra等[45]为此设计出多糖治疗剂SBR-294,具有抑制血小板活化和PDGF活性的双重作用,有望发挥血小板-PDGF拮抗剂在肝纤维化中的治疗作用。此外,研究[46]发现CKD小鼠血清中硫酸吲哚氧基增加,这种常规透析难以清除的尿毒症毒素,可通过ROS/p38MAPK通路诱导血小板激活,这与CKD相关血栓形成及动脉粥样硬化有关;硫酸吲哚氧基还可激活NF-κB信号通路,降低具有肾脏保护作用的Klotho蛋白水平,增加ROS。
2.7 遗传学与表观遗传学机制 NAFLD被认为是一种与生活习惯、营养和遗传有关的多因素疾病。研究[2]表明PNPLA3、HSD17B13、TM6SF2、MBOAT7、GCKR等基因多态性与NAFLD相关,其中一部分基因也与肾功能异常相关。PNPLA3基因在肝脏(主要是肝细胞和HSC)、脂肪组织和肾脏(主要是足细胞和肾小管上皮细胞)中高度表达,是NAFLD的主要遗传决定因素。PNPLA3 rs738409C>G变体型不具备野生型PNPLA3编码蛋白对TG和视黄酯的水解活性,因此与肝脏脂肪变性、HSC过度激活、肝纤维化相关,该变体型还增加肾系膜、肾小管脂质沉积,利用脂毒性损害足细胞功能,导致肾纤维化和肾小球硬化[2]。
另一方面,表观遗传变化与遗传风险因素相互作用,决定个体对疾病的易感性。NAFLD的发病可受组蛋白修饰、DNA甲基化和非编码RNA等表观遗传机制的调控[47]。研究[48]发现小鼠及人类NASH模型中,过氧化物酶体增殖物激活受体γ可通过miR-21-5p/SFRP5通路减轻炎症和氧化应激,因此有望成为治疗新靶点。此外,miR-21在肾病动物模型、人急性肾损伤、人CKD组织样本中均有上调,在促纤维化和器官衰竭中动态发挥作用[49]。
3 有CKD进展风险的NAFLD患者识别与管理
Paik等[50]指出,CKD的存在及严重程度与NAFLD患者死亡率增加独立相关,更加肯定了在NAFLD患者中早期识别CKD的价值。介于肝活检开展的局限性,目前已提出多种无创评分系统,如NAFLD纤维化评分(NFS)、基于4因子的纤维化指数(FIB-4)、AST/血小板比值(APRI)、BARD评分等用于预测NASH和肝纤维化的进展。其中,FIB-4还被认为是预测NAFLD患者发生CKD的最佳指标[51],在T2DM患者中,FIB-4对DN和蛋白尿也有一定预测作用[52]。此外,生化指标也是研究热点。研究[53]表明我国非肥胖人群血清GGT水平变化可能有助于监测NAFLD的发生发展,但GGT作为CKD的预测因子尚存在争议[54-55]。此外,有学者[56]认为无论GGT升高与否,ALT升高、AST/ALT比值降低均与CKD相关。邵翠萍等[57]则提出NAFLD患病风险与血清尿酸/肌酐比值升高有关,肌酐水平监测可能指导NAFLD干预时机,改善患者预后。而血清尿酸/肌酐水平升高也被认为是早期DN发生的独立危险因素,对早期DN有很好的预测价值[58]。但目前还无足够研究评估生化指标在NAFLD中诊断CKD的准确性。鉴于CKD在NAFLD患者中的高患病率,准确评估患者肾功能仍有意义。表1总结了目前在临床实践中可用于NAFLD患者肾功能评估的监测指标及优缺点。
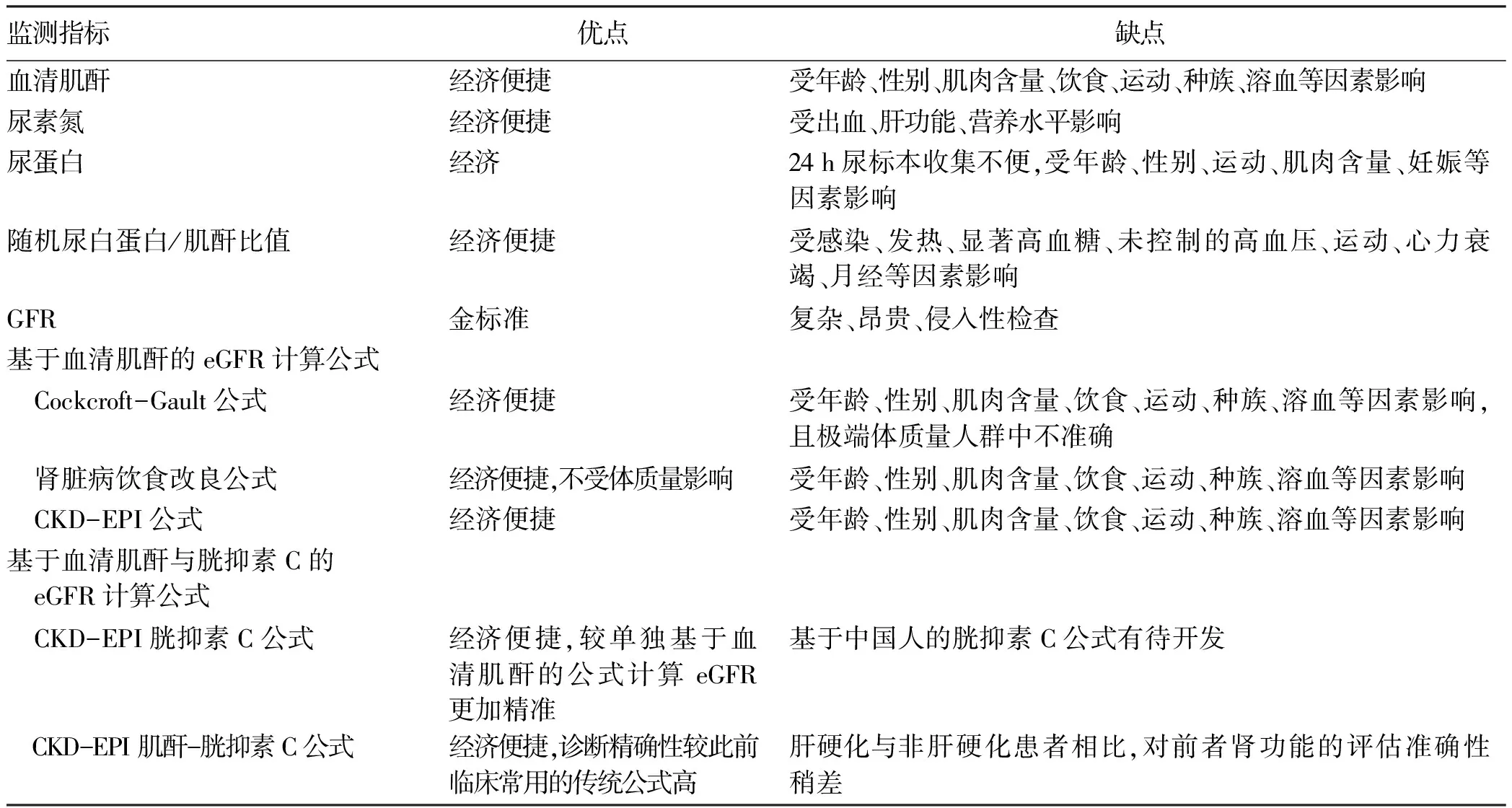
表1 建议用于NAFLD患者肾功能评估的监测指标及优缺点
与其他代谢相关疾病类似,健康的生活方式和体质量管理对于NAFLD的防治至关重要。Wong等[59]对77例社区NAFLD患者进行为期12个月以饮食和运动处方制定为主的干预后发现,非肥胖患者(BMI<25 kg/m2)在适度减重的情况下达到NAFLD缓解的比例甚至高于肥胖患者,生活方式干预对非肥胖和肥胖患者的NAFLD治疗均有效。美国肝病学会对地中海饮食有所推荐,主张控制热卡摄入在500~1000 kcal/d,以实现0.5~1.0 kg/周的减重目标,总体减重至少在3%~5%来改善肝脂肪变性,减重7%~10%改善NASH和纤维化[60]。此外,适当体育活动可降低NAFLD患者肝内TG水平和肝细胞损伤标志物而与减重本身无关,一般建议患者每周进行3~5次,总时间150~200 min的中等强度有氧运动[61]。但运动疗法需考虑个体化因素,因此暂无最佳运动类型、强度和频率的定论。在药物治疗领域,前文建议对NAFLD患者肾功能进行早期监测,可能实现医师对药物剂量的动态调整,保证治疗安全性。更重要的是,由疾病机制提示二者共享潜在治疗靶点。利拉鲁肽是我国唯一上市的药品说明书中注明能治疗糖尿病合并脂肪肝的胰高血糖素样肽-1受体激动剂,其对NAFLD的改善可能与减重作用有关[62]。胰高血糖素样肽-1受体激动剂还被证实具有肾脏抗炎、抗纤维化和抗氧化作用;或抑制血管紧张素Ⅱ、近端小管Na-H交换体3的激活而对肾脏有直接及间接保护作用[63]。相比之下,二肽基肽酶-4抑制剂在肾脏获益方面还有待研究。钠-葡萄糖协同转运蛋白-2抑制剂通过减轻肾小球高滤过、降低尿蛋白、防止高血糖诱导的氧化应激和炎症抑制等机制对肾脏发挥保护作用,还可独立于抗高血糖作用,预防饮食引起的肝脂肪变性、炎症和纤维化。这些肝脏相关获益的潜在机制包括胰岛素增敏、减脂、改善脂肪组织功能障碍、抗氧化等。更多处在探索阶段的治疗方案还包括过氧化物酶体增殖物激活受体γ激动剂、缺氧诱导因子激活剂、mTOR复合物1抑制剂、半乳糖凝集素-3抑制剂等[63]。
4 展望
当前NAFLD与CKD患病率的增加和影响范围的扩大已引起临床医师及科研人员的重视。目前NAFLD与CKD的因果关联未能阐明,NAFLD与肾脏病理改变之间的关系也尚不明确。考虑到临床对于NAFLD患者的肾功能监测,或在CKD患者中进行NAFLD筛查还缺乏具体实施意见,未来仍需要进行更多的前瞻性和干预性研究。期待日后能够从确切的疾病机制,对疾病开展有效防控和精准化治疗。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:杨梦茹负责课题设计,查阅文献,撰写论文;韩睿指导文章撰写及修改、校阅论文。
