2株蓝莓溶磷内生真菌的筛选、鉴定及溶磷效果评价
2022-11-16尚晓静徐芳玲潘秋梅张富美
尚晓静,侯 瑞,徐芳玲,潘秋梅,张富美
(1.贵州大学林学院,贵州贵阳 550025;2.黔东南州林业科学研究所,贵州凯里 556000)
蓝莓(Vacciniumspp.)是多年生灌丛类果树,为杜鹃花科越橘属,根毛少、根浅。适宜生存在土质疏松,土壤微酸的环境中[1]。我国于20世纪末在贵州省黔东南苗族侗族自治州麻江县开始大规模引种、种植蓝莓,因环境适宜,贵州蓝莓产业发展迅速[2]。磷在植物的生长发育过程中扮演着非常重要的角色,为植物生长必需的矿质营养元素[3-4]。土壤中磷的主要形态可以分为有机态和无机态2种。目前已发现的有机态磷主要包括代谢磷酸盐、磷酸化蛋白、磷脂、核酸和肌醇磷酸盐等[5]。
在土壤里,溶磷菌能把不利于植物吸收利用的磷转化为易于其吸收利用的形态[6]。溶磷真菌类菌株种类较少,主要有小菌核属(Sclerotium)、青霉属(Penicillium)、镰刀菌属(Fusarium)、根霉属(Rhizopus)、曲霉属(Aspergillus)。这5类菌株中,曲霉属菌株的溶解活性效果最好[7]。目前,国外已对曲霉属一类的溶磷菌做了广泛深度的探索[8]。李露莉等在研究黑曲霉的试验中发现其具有改良一些品位不好的磷矿石的作用[9]。梁艳琼等从热带作物根际以及盐碱地柠条根围土壤中分离出具有溶磷作用的曲霉[10-11]。张建峰等通过筛选得到了1株绳状青霉(Penicilliumfuniculosum),其溶磷能力较好,能将直径为9 cm的无机磷固体培养基在96 h后完全溶解[12]。范延辉等筛选出1株耐盐溶磷的真菌PSF2,该菌株在NaCl浓度为0.45%的土壤中培养20 d后,土壤中有效磷含量提高了20.9%[13]。
目前,已经筛选出大量的溶磷微生物,但其中具有耐盐性的不多,不一定适合在盐渍化土壤中生存。因此,寻找并发现既能溶磷又耐盐的真菌,将其应用于盐碱地农业产业和土壤环境改良是很有必要的。本试验通过常规固体筛选和钼锑抗比色法等方法,初步筛选出具有溶磷特性的蓝莓溶磷内生真菌,鉴定溶磷内生真菌,分析菌株耐盐性并研究其溶磷特性。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 本试验于2019年在贵州大学林学院森林保护学实验室研究,供试菌株为贵州大学林学院森林保护学实验室从蓝莓根、叶、果实分离得到的内生真菌菌株(G14、FG54)。
1.1.2 供试培养基 马铃薯葡萄糖琼脂(PDA)培养基:200 g马铃薯,20 g葡萄糖,20 g琼脂,1 000 mL 水,自然pH值。马铃薯葡萄糖(PDB)培养基:PDA培养基中去掉琼脂。无机磷(PKO)培养基:3.0 g Ca3(PO4)2,10.0 g蔗糖,0.5 g NaCl,0.2 g KCl,0.1 g (NH4)2SO4,0.1 g MgSO4·7H2O,0.004 g MnSO4,0.5 g酵母膏,0.004 g FeSO4,1 000 mL蒸馏水,15.0 g琼脂,pH值为7.0。蒙金娜有机磷培养基:10g葡萄糖,0.5 g (NH4)2SO4,0.3 g NaCl,0.3 g KCl,0.2 g卵磷脂,0.3 g MgSO4·7H2O,0.03 g FeSO4·7H2O,0.03 g MnSO4·4H2O,5 g CaCO3,0.4 g酵母膏,20 g琼脂,1 000 mL蒸馏水,pH值为7.0。耐盐性培养基:PDA培养基基础上加上不同含量NaCl。水-琼脂(WA)培养基:20 g琼脂,1 000 mL 水,pH自然。以上培养基均经过121 ℃、30 min高温灭菌处理。
1.1.3 主要试剂 2,4-二硝基酚指示剂:0.25 g二硝基酚定容至100 mL蒸馏水中。标准磷溶液:放置KH2PO4在45 ℃环境干燥 6 h 后称取0.439 4 g,移至400 mL蒸馏水中充分溶解,加入5 mL浓硫酸,用蒸馏水稀释至1 L,摇匀。钼锑抗贮存液:配制质量浓度为0.5%的酒石酸锑钾(C8H4K2O12Sb2)的溶液。另取10 g钼酸铵(H8MoN2O4)于 450 mL 蒸馏水中混匀,慢慢添加153 mL浓硫酸并搅动。最后,在钼酸铵溶液中添加100 mL浓度为0.5%的酒石酸锑钾溶液,蒸馏水定容至1 L并混匀,储藏于深棕色瓶子里。钼锑抗显色剂:临用前于100 mL钼锑抗贮存液中加入1.5 g左旋维生素C。5 mg/L磷溶液:临用前取10 mL上述100 mg/L标准磷溶液置于量筒中,用蒸馏水定容至200 mL。
1.2 试验方法
1.2.1 蓝莓内生真菌的分离与纯化 无菌条件下,将取到的新鲜的蓝莓植株的根、叶、果等3个部位分别用无菌水缓慢冲洗3次,去除表面杂质,用体积分数为75%的乙醇消毒2~3 s,用无菌水润洗3遍后用体积分数为3% NaClO浸泡3 min,再用无菌水润洗5~8次。已消毒后的根、叶、果等3个部位分别在PDA培养基上滚动并取出作为对照。截取边长为0.5 cm的根、叶、果小块接种在PDA 培养基上于 28 ℃ 下培养。根、叶、果周围有菌丝长出时,分别挑取菌丝转移至未接菌的PDA培养基上进一步纯化,以每个平板上只含有同一个特征的单一菌落作为试验结束的标志。
1.2.2 蓝莓溶磷内生真菌筛选 将已活化的内生真菌(菌柄直径d=0.6 cm) 分别接种在蒙金娜有机磷培养基和PKO培养基上,于28 ℃培养 72 h 后,根据是否存在透明溶磷圈来判定菌株是否具备溶磷能力;同时测定菌株的溶磷圈直径D值与d值并计算比值,把具有可溶磷的菌株初步筛选出来。
1.2.3 蓝莓溶磷内生真菌形态学鉴定 无菌条件下,用6.0 mm打孔器依次取菌株G14、FG54置于PDA培养基中,观察菌落2、4、6 d后的生长变化及菌落特征,对菌株进行简单的形态学鉴定。挑取培养皿新鲜菌丝置于放有载玻片的培养皿上,培养 3~4 d时,在边缘菌丝上盖上盖玻片,通过荧光显微镜观察菌丝的形态结构特征并拍照。
1.2.4 蓝莓溶磷内生真菌DNA分子生物学鉴定 无菌环境下分别取菌株G14、FG54 菌饼放入PDB中,于28 ℃、160 r/min摇床培养36 h,利用真菌提取试剂盒进行提取菌株总DNA,用ITS1和ITS4扩增18S rDNA 的ITS区域,提取获得的聚合酶链式反应(PCR)扩增产物委托重庆擎科兴业生物技术有限公司进行测序。获得的DNA序列在GenBank数据库用基于局部比对算法的搜索工具(BLAST)进行序列比较分析,利用MEGA 7.0软件的Clustalw程序进行多序列比对并构建菌株系统发育树。
1.2.5 蓝莓溶磷内生真菌的溶磷效果测定 以PKO培养基不加琼脂作为液体培养基,每个锥形瓶各添加150 mL,无菌条件下,取5块直径8.0 mm的菌饼分别放入呈有发酵液的锥形瓶中,移至摇床,于28 ℃、150 r/min转速下培养7 d,培养后每天取样测定发酵液中有效磷含量,同时测定pH值。
发酵液有效磷含量的测定:取5 mL上清液,12 000 r/min 离心5 min后,取3 mL上清液作为待测液置于50 mL锥形瓶中。
磷标准液的配制:将100 mg/L的磷标准溶液稀释至5 mg/L,分别取0、2、4、6、8、10 mL的5 mg/L 的磷标液至50 mL 锥形瓶中,添加蒸馏水至30 mL。
上述溶液均加2滴2,4-二硝基酚指示剂,再逐滴加入4 mol/L NaOH溶液至锥形瓶内液体变为微黄色;然后添加1 mol/L H2SO4溶液至黄色褪去,分别添加5 mL钼锑抗显色剂,快速摇匀后,加蒸馏水至50 mL标线位置,2 h后用分光光度计测定 700 nm 处吸光度值。以未接菌的PKO液体发酵液为参比液,设定其吸收值为0,分别测定不同标准液和发酵液的显色值,绘制磷标准曲线,并在磷标准曲线上计算发酵液的磷浓度。计算公式为
有效磷含量(μg/mL)=(ρ×V×Ts)/Vo。
式中:ρ表示有效磷的质量浓度,μg/mL;V表示定容体积,mL,此处为50 mL;Ts为分取倍数,此处为17倍;Vo表示加入发酵液的体积,mL,此处为3 mL。
1.2.6 蓝莓溶磷菌分泌有机酸的种类及含量测定 分别取3片已活化的G14和FG54菌柄(d=5 cm)至PKO液体培养基中,置于120 r/min、25 ℃摇床培养7 d后,于离心机离心后取上清液,用1290 Infinity型超高效液相色谱仪(上海硅仪生化科技有限公司)测定有机酸的种类及含量。液相色谱条件:色谱柱为C18(粒径1.8 μm,内径×长度2.1 mm×100 mm);流动相A为超纯水(含0.1% 的甲酸);流动相B为乙腈(含0.1%的甲酸);仪器柱温为 40 ℃;流速为 0.40 mL/min;进样体积为2 μL。
1.2.6 蓝莓溶磷内生真菌的耐盐性分析 采用PDA 作为基本培养基,在培养基中分别加入含量为0%、2.5%、5.0%、7.5%、10%、12.5%的NaCl。无菌条件下,取直径为6.0 mm的菌株菌饼接种在不同NaCl含量的培养基上,于28 ℃培养5 d,每天观察并记录菌丝在不同NaCl 含量的PDA平板上的蔓延情况分析菌株耐盐性。
2 结果与分析
2.1 蓝莓溶磷内生真菌的筛选与鉴定
2.1.1 蓝莓溶磷内生真菌的筛选 以PKO固体培养基作为基础培养基,接菌2 d后观察透明圈情况,再结合溶磷圈筛选法进一步筛选出具有溶磷特性的菌株。G14和FG54溶磷效果见图1,初步显示G14、FG54菌株均能溶解有机磷和无机磷。
2.1.2 G14、FG54菌株在不同溶磷培养基中的溶磷圈比较 经反复筛选得到的溶磷圈直径(D)与菌落直径(d)的值(表1),其中2个培养基中G14的D/d最大。蒙金娜培养基中G14的D/d为1.7,FG54为1.1。PKO培养基中,G14的D/d最大,为1.7,FG54的D/d为1.6。2株菌株于蒙金娜和PKO培养基中生长速度与溶磷圈大小各不相同,推测2株菌株对同一培养基的溶磷性与溶磷机制不同。
2.2 蓝莓溶磷内生真菌的鉴定
2.2.1 蓝莓溶磷内生真菌的PDA形态学观察 由图2可知,菌株G14于28 ℃下暗培养,其生长速度较快,6 d后可铺满培养皿平面(直径90 mm)。菌落边缘整齐,纹理松散;菌丝生长均匀,表面呈白色棉絮状。菌落边缘在显微镜下呈分枝状生长,具有锁状联合。菌株FG54于28 ℃恒温培养箱暗培养 6 d 后形成半径为4.0~4.5 cm 的菌落,FG54生长较缓慢,每天均匀生长,菌落正面整体为圆形,中央为浅青色环绕,边缘为白色细菌丝,菌落背面为浅黄色,呈褶皱状生长。菌株FG54菌落边缘显微形态特征,显微镜下该菌株菌丝顶端产孢结构呈扫帚状。

表1 溶磷菌株溶磷圈直径(D)与菌落直径(d)
2.2.2 蓝莓溶磷内生真菌的DNA分子生物学鉴定 将菌株G14、FG54进一步测序。菌株G14总DNA经过ITS1和ITS4引物扩增,PCR产物送至重庆擎科兴业生物技术有限公司测序得到相关序列。获取测序结果后登录 GenBank,得到登录号 MT601950。将菌株G14序列进行BLAST 比对结果表明菌株G14与BjerkanderaadustaKJ668570.1的亲缘关系达到100%,菌株构建系统发育树见图3。同时,获取菌株FG54测序结果后登录 GenBank,得到登录号 MT601884。FG54与PenicilliumadametziiKF313079.1的亲缘关系为100%,将其构建系统发育树见图4。
2.3 蓝莓溶磷内生真菌的溶磷效果测定
2.3.1 蓝莓溶磷内生真菌有效磷含量变化 以PKO为参比液,在Excel 中输入磷标线数据,计算得磷标线公式为y=0.374 3x+0.017 9,r2=0.992。通过公式算得的有效磷含量(μg/mL)。由图5可知,FG54有效磷含量总体表现为先降后升再降的趋势,2~5 d的有效磷含量逐渐上升,5 d达到最大值587.315 μg/mL,7 d 降到404.465 μg/mL。G14的有效磷含量表现为先降再升再降的趋势,G14从1 d的331.628 μg/mL下降到2 d的187.131 μg/mL,然后一直上升,在5 d达到最大,最大值为 523.730 μg/mL,过后逐渐呈现下降的趋势,到7 d降至117.742 μg/mL。菌株G14、FG54有效磷含量均在1~2 d呈现下降趋势,3~5 d有效磷含量值都在逐步上升,总体都在5 d达到最大有效磷含量,并在5 d后逐步下降,G14的1 d的值比7 d的值高,而FG54的7 d值比1 d高。
2.3.2 蓝莓溶磷内生真菌发酵液中pH值的变化 由图6可知,PKO液体的7 d时pH值大于G14、FG54。PKO的pH值在前3 d呈现逐步上升趋势,3 d 达到最大值6.40,4 d逐步下降,7 d降至5.25。G14在2 d pH值下降,3 d又回升到最大值,4 d逐渐下降,5 d下降速度最快,7 d下降至4.52。FG54 pH值在2 d达到最大,为5.97,之后逐步下降。2个菌株的pH值均低于PKO值,且所有的发酵液在5 d下降的速度最快。乔欢等研究得出pH值与磷的溶解量呈负相关关系,随着磷溶解量的增加,pH值随之降低[14]。本研究结果与之相符,通过监测2株溶磷内生真菌在5 d时有效磷含量值达到峰值。
2.4 蓝莓溶磷菌分泌有机酸的种类及含量测定
对2株菌株的有机酸种类及含量进行测定,得出2株蓝莓溶磷菌分泌的有机酸种类及其相对含量,根据数据库物质中2株菌共同分泌有机酸种类进行筛选,匹配到的有机酸共3种(表2)。有机酸种类依据相对含量大小排列分别为丙二酸、甲基丙二酸和柠檬酸。
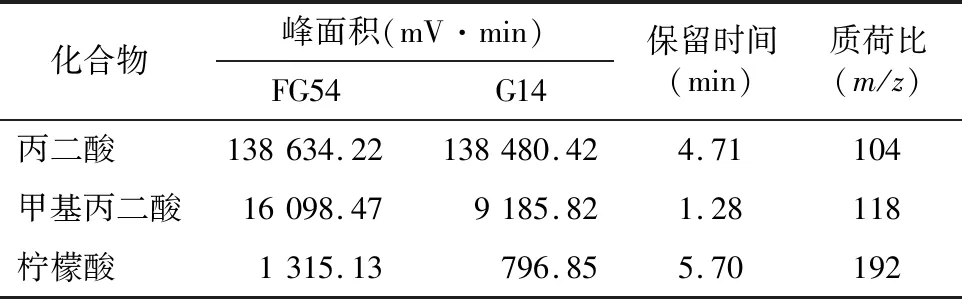
表2 蓝莓溶磷菌代谢产物的种类及其相对含量
2.5 蓝莓溶磷内生真菌的耐盐性分析
通过5 d观察记录到的G14、FG54在不同NaCl含量下的菌丝平均直径(mm)情况见表3。由于菌丝前2天生长速度缓慢,故不记录菌丝直径,未生长用“—”表示。由表3可知,总体上FG54能适应不同含量的NaCl浓度,G14的最高耐盐浓度是2.50%,FG54相较G14来说耐盐适应范围更广一些。FG54在NaCl含量为2.50%的时候生长效果最好,在0%和5%时效果次之,12.5%最差。在 3 d 时12.5% NaCl含量下,FG54生长速度较缓慢,其直径仅增加1 mm左右。同样取菌株G14直径 6 mm 的菌块置于相同培养基,在NaCl含量为0%和2.5%下,3 d时菌丝直径能生长到FG54的 1~3倍数,但当NaCl含量大于2.5%时,G14皆不生长。综上所述,2类菌丝的耐盐程度较低,经观察低NaCl含量下,G14的5 d后的生长速度远超于FG54。

表3 不同NaCl含量下的菌丝直径情况
3 讨论与结论
微生物肥料能够有效改良土壤的肥力与结构,使作物更高效地利用土壤里的化肥,增强作物的抗逆性,提高作物的产量,且对环境污染较小,故溶磷微生物在农林业生产上十分重要[15]。溶磷菌的溶磷机制较为复杂,溶磷菌在培养的过程中可分泌多种有机酸,有机酸可以溶解磷化物[16]。而不同溶磷菌所分泌的有机酸类型可能存在区别,且培养条件不同所产生的有机酸种类也可能不同[17-18]。通过对2株菌株的有机酸种类及含量的分析,丙二酸、甲基丙二酸和柠檬酸为本试验研究的2株溶磷菌的主要有机酸代谢产物。本试验把菌株FG54和G14接种到蒙金娜有机磷培养基和PKO无机磷培养基上,发现2株菌株均能产生溶磷圈,说明2株菌株均具有溶磷功能[19]。菌株FG54是阿达青霉,培养5 d其有效磷含量为587.315 μg/mL,溶磷效果较同为青霉属的嗜松青霉JP-NJ4溶磷效果低,嗜松青霉JP-NJ4在磷酸钙溶液中溶磷量为 1 390 mg/L[14]。溶磷菌的溶磷机制是溶磷菌产生的质子降低了培养基的 pH值,从而使磷酸盐溶解[20]。据现有报道,诸多植物根际分布的微生物类群能产生植物激素,促进植物根部细胞的生长,增加植物对营养元素的吸收能力[21]。Illmer等从不同植株中筛选到高校溶磷菌株后,又对菌株的溶磷能力、培养特性等做了深入的研究,发现不同菌株其溶磷能力不同[22-25]。在pH值与溶磷能力的关联性研究中,本试验结果与冯宏等研究结果不同的是,其研究的菌株培养液的 pH 值与溶磷能力并无显著关联性[26],而本试验研究2个菌株在培养时随酵液中的pH值的降低,有效磷含量随之升高,因此推测本试验的2株菌株能起到溶磷作用的主要原因是其质子产生时的酸解作用[22]。本试验中有效磷含量总体表现为先下降后上升的趋势,FG54菌株5 d有效磷含量最高,而G14稍微低一些,可能是各个菌株在同一种溶液中的溶解能力、溶解机理存在差异。菌株的耐盐性也是菌株在生产应用上的关键因素。杨榕等发现其研究的长枝木霉随着盐胁迫浓度的提高,菌株的生长速度和溶磷性均有所降低,因此在实际农业应用过程中需判断土壤的盐浓度含量,盐浓度含量过高时会抑制部分菌的生长[27]。
本试验结果表明,菌株FG54和G14的生长都受NaCl含量的影响,菌株FG54在NaCl含量为2.50%的时候生长效果最好,而当NaCl浓度达到12.50%时生长效果变差。菌株G14只能在NaCl含量为0%和2.50%的条件下生长,在大于2.50%的条件下皆不生长。向文良等分离出的嗜盐溶磷菌QW1011,在NaCl浓度为10%下生长状态最好,且对NaCl最高耐受浓度可达15%[28],与之相比,本试验筛选的2株菌株的耐盐性较低。综合耐盐性分析,本试验分离出的菌株FG54对土壤的耐盐性较高,对当今的土壤出现的各种状况可以起到一定的改良作用。而菌株G14耐盐性相对较差,适合在NaCl浓度较低的土壤上应用。本试验为进一步研究溶磷内生真菌在土壤中的应用提供理论基础,为盐碱地农业产业和土壤环境改良上提供应用依据。
