生物炭与氮肥配施对玉米叶片氮素利用及代谢的影响
2022-11-16常青
常 青
(濮阳职业技术学院,河南濮阳 457000)
作为陆地植物初级生产力的主要限制因子,氮在植物生长发育及生理代谢中具有不可替代的作用[1]。在农业生产中,施用氮肥是保障作物品质及产量的常规措施,然而施氮量与产量间存在一定阈值,当氮肥施用过高时作物的氮肥利用率反而降低[2]。此外,氮肥的广泛运用和过量施用带来的负面影响日趋严重,如何有效降低氮肥使用量,提高作物氮利用率已成为发展可持续性农业的关键问题[3]。为了提高作物氮肥利用率,已经开展了作物育种、缓释控释技术以及均衡施肥等多种策略[4],尽管上述策略在作物生产中表现出良好的生产效果,但确定最佳氮素管理实践,仍是一个亟待探索的过程。

关于施氮水平对植物的影响,许多研究已经探索了烟草、大豆及水稻等减肥实践,发现适宜减施氮肥,产量无明显变化,当减施比例提高时,氮肥利用率显著下降[8],但不同作物适宜的氮肥减施比例不同。玉米(ZeamaysL.)是世界范围内广泛种植的农作物之一,具有较高的代谢能力,为了获得最大产量,玉米植株需要大量的化学氮肥,使用的主要氮肥类型是尿素[9]。因此,在不影响作物产量的情况下提高尿素中氮的利用效率,仍是亟待解决的问题。
1 材料与方法
1.1 试验地点与材料
试验于2020年5—6月在濮阳市农业科学院温室大棚中进行。供试玉米品种为郑单958,是河南省目前主栽的优良品种之一,使用1%次氯酸钠对种子表面进行消毒并暗处理催芽24 h。供试氮肥为15N-尿素(15N含量为10.11%),购自上海化工研究院有限公司。供试生物炭由河南省生物炭工程技术研究中心提供,采用玉米和小麦秸秆(质量比为1 ∶2)在低氧、440 ℃条件下连续炭化65 min制得,其基本性质:全碳含量为49.82%,总氮含量为2.13%,比表面积为15.66 m2/g,容重为 0.26 g/cm3,pH值为8.36,主要官能团为羟基、烷烃和酰胺基[13]。
供试土壤取自濮阳市农业科学院清丰试验田(114°46′49″N,35°44′17″E),为0~20 cm土层土壤。土壤类型为黄褐土。土壤理化性质:有机质含量为20.59 g/kg,全氮含量为1.16 g/kg,碱解氮含量为78.44 mg/kg,有效磷含量为19.01 mg/kg,速效钾含量为137.36 mg/kg。
1.2 试验设计
试验设置2因素3水平完全随机组合设计,因素1:施用生物炭(BC),设置施用0、3%、9%等3个生物炭水平,分别记作:BC0、BC3、BC9;因素2:施用氮素(N),设置施用100%、80%、60%等3个氮素水平,分别记作:N100、N80、N60;共设置9个处理组合。其中,施用生物炭处理的0、3%、9%为施用生物炭的质量与培养土壤质量之比,施用氮素处理的100%、80%、60%为施氮量与常规施氮量(150 kg/hm2,种植密度7.5×104株/hm2)的质量之比,即N100、N80、N60的施氮量分别为2.0、1.6、1.2 g/盆。每个处理重复3次。
采用黑色聚乙烯塑胶桶,每盆装土4 kg。称取相应质量的上述生物炭及15N-尿素与土壤充分搅拌均匀后装盆,其中每盆纯磷施入量为1 g(P2O5∶K2O=1 ∶1)。每盆播种已催芽的玉米种子6粒,7 d后间苗至每盆3株,土壤持水量保持为80%,共培育35 d。
1.3 样品采集及测定分析
1.3.1 玉米植株、土壤氮测定 培养结束后,将玉米植物地上部、根系分离,65 ℃烘干并称质量以确定植株干物质。在测定15N丰度和全氮(TN)含量之前,将植物样品和风干土壤样品细磨并通过 0.15 mm 网筛。植物和土壤15N同位素比采用稳定同位素比质谱仪(DELTA plus XP,Thermo Finnigan,USA)测定;叶片全碳(TC)含量采用重铬酸钾-硫酸氧化法测定[14]。
1.3.2 核磁共振和代谢物分析测定 称取0.50 g植物样品在液氮中快速研磨,移入离心管中 7 000 r/min、4 ℃快速离心5 min,加入2 mL甲醇和2 mL三氯甲烷,涡旋30 s,并在冰浴中超声提取 60 s。然后10 000 r/min、4 ℃高速离心20 min;重复该步骤3次,分别收集底部有机相(非极性相)和上层水相(极性相)。对于水相,在真空下旋转蒸发除去甲醇(<5%),然后将上清液在-80 ℃冷冻24 h。对于有机相,在旋转真空蒸发器中进行减压干燥,接着加入800 μL 纯重水(D2O)、160 μL磷酸盐缓冲盐水(pH值为7)、10%重水以及0.02 mmol/L 3-三甲基硅基-[2,2,3,3-D4]-丙酸钠(TSP),旋蒸蒸发3 min;加入1 mL含有0.03% 四甲基硅烷(TMS)的氚代三氯甲烷-d(CDCl3)至干燥有机组分中,并采用TSP和TMS作为内标。将水样、有机相提取物分别转移到埃彭多夫管中,12 000g离心 5 min。移取0.65 mL样品转移到核磁共振(NMR)样品管中。对每个样本进行核磁共振分析。
使用Bruker AVANCE Ⅲ 600 超导高分辨核磁共振谱仪(Bruker AVANCE Ⅲ 600,Germany)扫描生成极性和非极性代谢谱。使用TopSpin 2.1软件(Bruker Biospin)对样品处理、自动化和采集进行控制,对于水相、有机相样品,皆使用标准的1H 90°脉冲序列,每个光谱为32 k数据点,谱宽为16×10-6Hz。水相频域谱采用手动调整,有机相采用CDCl3对光谱自动调整,1H NMR谱的基线校正、相位校正以及等宽累积处理参考Sun等的研究[16]。以上分析均委托上海美吉生物医药科技有限公司完成。
1.3.3 氮素相关代谢基因表达分析 使用TRIpure Reagent Plant RNA Mini Kit(BioTeke,中国北京)按照试剂盒说明提取叶部、根系总RNA,使用高容量cDNA逆转录试剂盒(HiScript® Ⅱ QRT SuperMix,Vazyme Biotech,中国南京)按照试剂盒说明合成第1条cDNA。以ZmUBC为看家基因,采用StepOnePlusTMReal-Time PCR系统(ThermoFisher Scientific,USA)对cDNA进行实时荧光定量聚合酶链式反应(qRT-PCR)分析。氮素相关代谢基因(ZmAS1、ZmGS1)的特异性引物序列见表1。反应体系:10 μL 2×SYBR Premix ExTaqⅡ、1.0 μL正向引物、1.0 μL反向引物、2.0 μL cDNA和10 μL ddH2O。扩增程序:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 30 s,72.0 ℃ 30 s,40个PCR循环。借助RQ Manager(ThermoFisher Scientific,USA)采用2-ΔΔCT断层扫描方法分析数据。

表1 ZmGS1、ZmAS2和ZmUBC的实时PCR引物序列
1.4 数据处理与统计分析
来自15N标记尿素的氮素(Ndff)、土壤氮素残留以及植物氮素利用率(NUE)等的计算公式[17]如下:
玉米器官Ndff=玉米器官15N原子百分超/15N- 尿素原子百分超×100%;
土壤Ndff=土壤的15N原子百分超/15N-尿素原子百分超×100%;
NUE=玉米干质量×植株全氮含量×玉米整株Ndff/施氮量×100%;
土壤残留率=土壤总干质量×土壤全 N含量×土壤Ndff/施氮量×100%;
氮肥损失率=100%-NUE-土壤氮肥残留率。
根据Sun等的方法[16]分配和量化代谢物,基于代谢物的半定量数据计算处理之间代谢物的响应比生成代谢物相关网络,并采用Cytoscape 2.8.3(http://www.cytoscape.org/)对玉米氮组分与代谢物之间的关系进行典型对应分析(CCA)。采用进行双因素方差分析(Two-Way ANOVA)和最小显著法(LSD)进行试验数据统计分析(P<0.05),图片采用Origin 2018进行绘制。
2 结果与分析
2.1 生物炭与氮肥配施对玉米氮相关指标的影响
2.2 生物炭与氮肥配施对15N标记氮肥去向的影响
由图1-A可知,在不添加生物炭(BC0)处理中,随着施氮量降低,玉米地上部的N利用率升高,而玉米根部的N利用率降低。在添加BC处理中,玉米地上部的氮利用率随着施氮量的降低而增加,这与各处理在根系中的趋势一致。就BC处理来看,与不添加生物炭处理(BC0)相比,以添加3%比例的生物炭处理(BC3)具有最高的土壤残留率和最低的氮肥损失率,而在9%比例的生物炭处理(BC9)中,玉米地上部利用率、根系利用率及土壤残留率皆明显降低、氮肥损失率增加。由图1-B可知,在玉米氮素利用率中,当添加3%生物炭且氮肥施用比例为60%时(BC3N60),玉米植株的氮素利用率最高,为29.4%;其他处理较BC3N60处理降低2.0~14.7百分点,其中与BC3N80、BC0N80、BC0N100处理无显著差异外,皆显著高于其他处理。
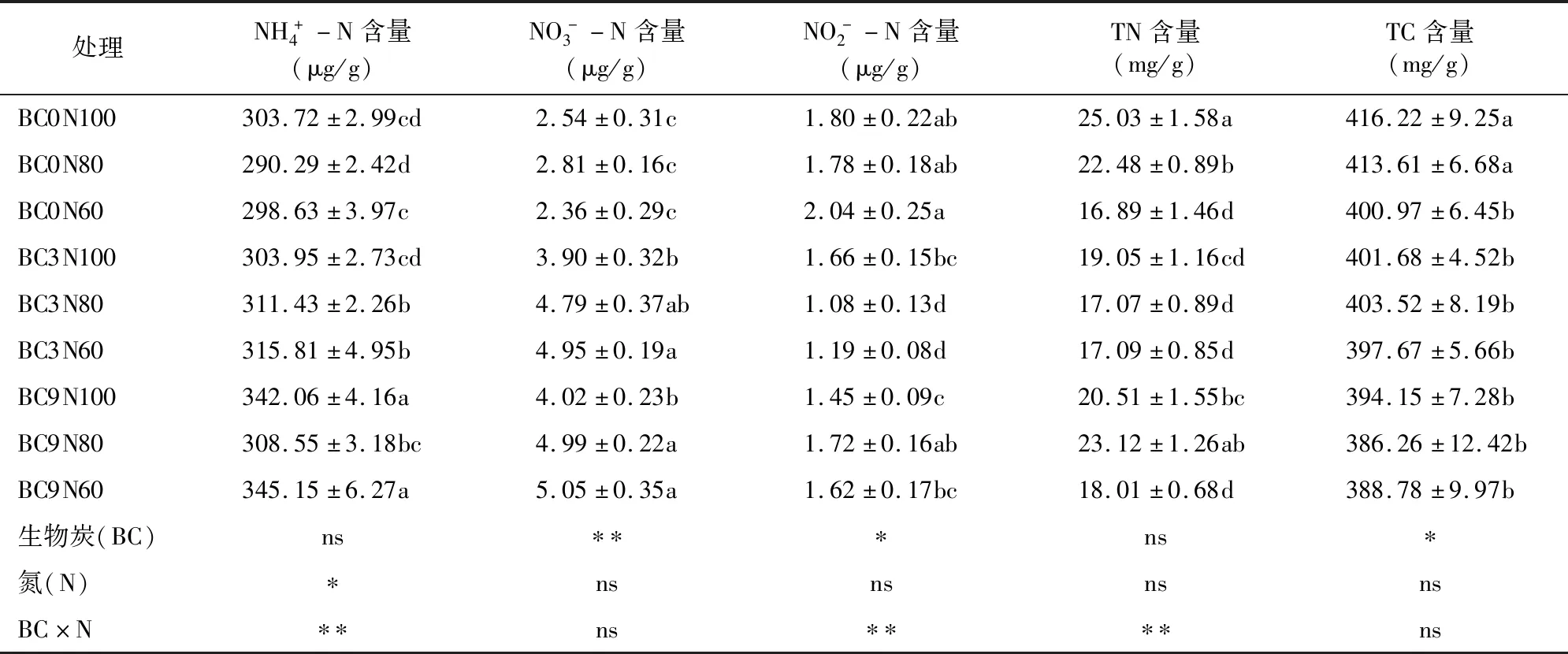
表2 不同生物炭和氮肥处理对玉米叶部矿质氮组分、全氮和全碳含量的影响
2.3 生物炭与氮肥配施对玉米叶片氮代谢谱的影响
由图2可知,在玉米幼苗的叶片中,降低施N水平导致氨基酸含量普遍增加。当添加BC时,减少N输入则减少了叶片中的糖库,同时发现玉米叶片中的糖分对N减少和BC添加在单个糖指标中具有强烈响应。结果表明,某些糖组分的反应不仅在合成量上同时也在组分上都与糖库总体趋势不同,例如果糖、蔗糖、α-葡萄糖和β-葡萄糖含量随着N添加量的减少而减少;而加入BC后,果糖和蔗糖含量均不同程度的表现为增加趋势,表明生物炭降低了糖水解的通量。此外,添加BC的情况下,减少N施入量改变了叶片中的有机酸含量,特别是当BC添加量为9%时。与BC0N100处理相比,由于减少N添加、BC施用比例提高使得乳酸和莽草酸含量增加,同时其在不同处理间的有机酸谱中显示出非常高的稳定性。在叶片中,与BC0N100对照相比,在有机酸库中,如苹果酸和琥珀酸含量,随着BC添加和N减少,皆表现为下降趋势。
2.4 生物炭与氮肥配施下玉米叶片氮代谢物网络相关分析
基于添加生物炭比例的影响,构建了基于相关性的共线网络,网络相关性图可以表明添加生物炭后各氨基酸组分网络特性的变化。由图3-D可知,在叶片中,随着生物炭施用比例的增加,互相关联较少(1~10条)的代谢物数量呈先增加后减少趋势,而相互关联较多(11~20条)的代谢物数量减少。将BC添加比例从0增加到3%,然后到9%后,其网络密度从0.19降低到0.14,然后增加到0.15;网络异质性从0.60增加到0.63,然后上升到0.69。整体来看,在叶片中,施用BC减少了氨基酸组分关系间的数量,随后对网络密度产生了负面影响,表明添加生物炭稀释了新陈代谢间的关系从而达到了调节氮素代谢的目的。
2.5 生物炭与氮肥配施对玉米叶片氮素代谢基因表达影响
植物中的氮代谢过程已被证明是多种相互依赖的途径,其中涉及许多基因,包含一系列蛋白质、酶和代谢物。其中,谷氨酰胺合成酶(GS)和天冬酰胺合成酶(AS)被认为在植物氮代谢过程中具有重要作用。由图4-A可知,在ZmGS1相对表达水平方面,相对丰度峰值出现在BC3N80处理,其次为BC9N100处理,二者无显著差异,同时BC3N80处理显著高于其他处理,而BC9N100处理与任一处理均无显著差异。在ZmAS1相对表达水平方面(图4-B),以BC0N80处理的相对表达水平最高,其他处理较其降低11.81%~47.22%,其中与BC0N60、BC3N100、BC9N60处理的差异达显著水平。此外,在添加BC条件下,ZmGS1基因的相对表达丰度整体比ZmAS1基因更高,这意味着在添加BC的代谢调整过程中,ZmGS1基因可能比ZmAS1基因更敏感。
2.6 生物炭与氮肥配施下氮素组分与代谢组特征的典范对应分析
3 讨论与结论
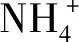
相同的代谢物可能涉及多个代谢途径,因此代谢物之间的关系可以采用网络相关性分析来揭示。本研究结果表明,叶片的网络密度、网络异质性随着BC施用比例的增加分别呈降低、增加趋势。前人研究表明,为了让细胞适应新的环境条件,植物体的新陈代谢会发生协同变化,然后导致与环境条件更为适配的代谢特征[25]。添加BC与施氮水平可改变代谢物之间的串联,从而影响叶片C、N代谢,进而刺激植物生长。在N供应减少条件下,BC添加影响了叶部组织之间广泛的网络差异,这一结果部分归因于C、N之间的平衡,也取决于植物本身对二者生理状态差异的调整能力[26]。
在高等植物中,天冬酰胺合成酶负责氨同化的第一步,谷氨酰胺合成酶则参与后续氨的固定、储存与运输[27]。在植物的N再利用阶段,AS与GS共同作用于运输含氮分子,催化谷氨酰胺和天冬氨酸形成天冬酰胺,该过程对于环境压力下的氮循环至关重要[28]。在本研究中,观察到玉米根系中ZmGS1的表达受BC添加比例的影响较大,尤其在BC3处理中,这意味着添加3%BC条件下ZmGS1基因在改善氨同化和增加N再利用方面发挥着更为重要的作用。与ZmGS1的表达不同,ZmAS1在叶片中的表达受BC添加和N减少的影响较小,这与Sun等对玉米叶片的研究[16]一致,即AS活性在低氮胁迫下与铵同化循环相关的谷氨酰胺合酶和谷氨酰胺酮戊二酸氨基转移酶的转录水平较低[11]。

