基于HPLC指纹图谱结合化学计量学评价山西藜麦的质量
2022-11-16胡秋霞何建昇赵智勇郭俊俊
胡秋霞,康 乐,何建昇,赵智勇,郭俊俊
(山西省科技资源与大型仪器开放共享中心,山西太原 030012)
藜麦属于藜科藜属植物,是典型的假谷物代表,因其营养丰富、全面,被认为是唯一一种能满足人体全部营养需求的谷物,亦被称为最具有发展前景的“黄金健康食品”之一[1-3]。研究表明,藜麦中含有氨基酸、蛋白质、脂肪类、淀粉、维生素、矿物元素及多酚类、黄酮类和皂苷类等活性成分,具有很高的食用、保健、医疗、观赏等价值,越来越受到人们的关注[4-8]。
藜麦的种植历史悠久,源于南美,因其丰富的营养价值和种植的抗旱性、耐盐碱性、耐寒性、耐贫瘠性且适应性强等特点,在许多国家得以推广种植[9-10]。目前我国亦有十余省份正在推广种植,尤其是山西省,作为杂粮王国,藜麦是杂粮之“特”,山西省静乐县更是被誉为“藜麦之乡”[11]。山西的藜麦缺乏科学客观的质量评价指标,品牌优势尚未形成,一些精深产品加工企业和高端产品生产企业都有采购外省原料的意向,这对山西省藜麦产业的可持续发展产生了消极影响。建立山西藜麦的科学客观评价体系和产品评价标准,对山西藜麦的标准化和工业化生产具有重要的推动作用,因此,评价山西藜麦质量情况成为了一项重要工作。
为了辨别山西藜麦与其他地区藜麦是否存在差异,发现更多山西藜麦质量评价指标,从而更全面地评价山西藜麦质量,本研究收集了山西省不同地区不同品种藜麦试样30余种,采用高效液相色谱(HPLC)建立了山西藜麦指纹图谱;利用中药色谱指纹图谱相似度评价系统(2012版)对其进行相似度评价;基于指纹图谱结合化学计量学,运用SPSS 22.0软件对其进行主成分分析(PCA)和系统聚类分析研究(HCA),利用SIMCA 14.1软件对其进行偏最小二乘判别分析(OPLS-DA),从而为山西藜麦质量评价提供全面的指导和理论参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料 藜麦:从各种流通渠道购买,并与厂家核实后采购,均产自2020年,样品编号为 S1~S31,详见表1。
对照品(纯度≥98%):芸香苷(批号:20210507)、根皮苷(批号:20201106)、表没食子儿茶素(批号:20200903)、绿原酸(批号:20210531)、柚皮苷(批号:20201106)、没食子酸(批号:20200317)、原儿茶酸(批号:20201120)、咖啡酸(批号:20201106),均购自北京北方伟业计量技术研究院;对羟基苯甲酸(批号:PCS-210611)、异荭草素(批号:PCS-201109)、阿魏酸(批号:PCS-210803)、异阿魏酸(批号:PCS-210309)、藜芦酸(批号:PCS210309)、肉桂酸(批号:PCS-210412)、山柰酚(批号:PCS-200710)、香兰素(批号:PCS-210419)、香草酸(批号:PCS-201205),均购自北京世纪奥科生物技术有限公司。
试剂:甲醇和甲酸均为色谱纯,水为超纯水。
1.1.2 仪器 Waters高效液相色谱仪(e2695),购自沃特世上海科技有限公司;十万分之一分析天平(CP225D),购自赛多利斯科学仪器(北京)有限公司;超声波清洗器(KQ-500E),购自昆山市超声仪器有限公司;刀式混合研磨仪(GM 200),购自弗尔德莱驰(上海)贸易有限公司。
1.2 试验方法
1.2.1 供试品溶液的制备 将干燥过后的藜麦样品研磨过0.25 mm筛,精确称量1.000 g,置于5 mL容量瓶中,加入甲醇至刻度线,摇匀并精确称量后,超声处理1 h(功率500 W,频率40 kHZ),取出冷却后再补足甲醇质量,摇匀,静置30 min,取上层清液过0.22 μm滤膜,所得滤液即为供试品液。
1.2.2 混合对照品溶液的制备 精确称取芸香苷、根皮苷、表没食子儿茶素、绿原酸、柚皮苷、没食子酸、原儿茶酸、咖啡酸、对羟基苯甲酸、异荭草素、阿魏酸、异阿魏酸,藜芦酸、肉桂酸、山柰酚、香兰素和香草酸适量,置于100 mL容量瓶中,用甲醇溶解并稀释至刻度,制成对照品母液,按比例稀释得2、4、8、12、16、20 mg/L的混合对照品贮备液,经 0.22 μm 滤膜过滤后,进行HPLC分析。
1.2.3 色谱条件 安装PE色谱柱(Quasar AQ C18柱250 mm×4.6 mm,5 μm),流速:0.8 mL/min;柱温:30 ℃;检测波长247 nm,进样量:10 μL。流动相:甲醇(A)、0.2%甲酸溶液(B),梯度洗脱程序见表2。
1.2.4 方法学考察
1.2.4.1 精密度试验 取样品S1适量,按“1.2.1”节中的方法制备供试品溶液,连续进样6次,按“1.2.3”节中的色谱条件进行测定,记录指纹图谱,以分离度较好、峰面积较大、峰位相对居中的异阿魏酸峰为参照峰,计算各共有峰相对峰面积和相对保留时间的相对标准偏差(RSD)。
1.2.4.2 重复性试验 称取样品S1适量,平行取6份,按“1.2.1”节中的方法制备供试品溶液,按“1.2.3”节中的色谱条件进行测定,记录指纹图谱,以异阿魏酸峰为参照峰,计算各共有峰相对峰面积和相对保留时间的RSD。
1.2.4.3 稳定性试验 称取样品S1适量,分别于制备后0、2、4、8、12、16、24 h,按“1.2.1”节中的方法制备供试品溶液,按“1.2.3”节中的色谱条件进行测定,记录指纹图谱,以32.065 min共有色谱峰为参照峰,计算各共有峰相对峰面积和相对保留时间的RSD。
1.2.4.4 加标回收率试验 取藜麦样品S1 6份,每份 1.00 g,置于100 mL容量瓶中,加入混合标准对照品溶液1 mL,用70%甲醇溶液定容至100 mL,同时按“1.2.1”节中的方法制备供试品溶液,按“1.2.3”节中的色谱条件进行测定,记录表没食子儿茶素、对羟基苯甲酸、绿原酸、异荭草素、阿魏酸、异阿魏酸、芸香苷、根皮苷的加标回收率和RSD。
1.3 数据分析
采用中药色谱指纹图谱相似度评价系统(2012版)绘制山西藜麦指纹图谱,并进行相似度分析;利用统计分析软件IBM SPSS 22.0对31份藜麦样品进行聚类分析和主成分分析;利用SIMCA 14.1软件对其进行偏最小二乘判别分析。
2 结果与分析
2.1 方法学考察
精密度试验结果相似度在0.999以上,各共有峰的相对保留时间RSD小于0.048%,相对峰面积RSD小于1.896%;重复性试验中,以异阿魏酸峰为参比峰,相似度在0.999以上,各共有峰的相对保留时间RSD小于0.053%,相对峰面积RSD小于1.304%;稳定性试验中,相似度在0.999以上,各共有峰的相对保留时间RSD小于0.048%,相对峰面积RSD小于1.083%;加样回收率结果相似度在0.999以上,表没食子儿茶素、对羟基苯甲酸、绿原酸、异荭草素、阿魏酸、异阿魏酸、芸香苷、根皮苷的回收率分别为103.95%、101.85%、102.50%、101.83%、102.10%、100.13%、101.02%、102.22%,RSD分别为4.67%、3.98%、2.84%、3.01%、2.68%、1.76%、3.83%、2.08%。结果表明,HPLC仪器精密度良好,试验方法的重复性和稳定性准确度良好,供试品溶液在室温下 24 h 内稳定性良好,符合指纹图谱的要求。
2.2 指纹图谱的构建
分别取31批山西藜麦样品,按“1.2.1”节中的方法制备供试品溶液,另取12 mg/L的混合对照品溶液,按“1.2.3”节中的色谱条件进行测定,记录供试品和混合对照品的色谱图。将得到的色谱图导入中药色谱指纹图谱相似度评价系统(2012版),选择色谱峰分离度较好、峰面积占比较高且比较稳定的S16为参照图谱,中位数对照图谱生成方式,时间窗宽度选0.15 min,然后采用多点校正进行全峰自动匹配,生成山西藜麦HPLC对照指纹图谱,确定了22个共有峰,可以构成指纹图谱的共有模式,结果见图1、图2。通过与已知标准品对照得知,图2中6号峰是表没食子儿茶素,7号峰是对羟基苯甲酸,9号峰是绿原酸,14号峰是异荭草素,15号峰是阿魏酸,16号峰是异阿魏酸,18号峰是芸香苷,19号峰是根皮苷。
2.3 相似度评价
将31批藜麦样品指纹图谱导入中药色谱指纹图谱相似度评价系统(2012版),进行相似度分析,确定了22个共有峰。图3为31批样品匹配后的叠加色谱图,相似度计算结果见表3。由表3可以看出,31批样品的相似度除S8和S9以外其余均大于0.84,说明山西各产地藜麦有较好的一致性,可以用于综合评价山西藜麦的整体质量。

表3 31批藜麦样品相似度分析结果
2.4 藜麦中8种有效成分含量的测定
取31批藜麦样品,按“1.2.1”节中的方法制备供试品溶液,在“1.2.3”节中的色谱条件下,测定8种有效成分的含量,测定结果见表4。
2.5 化学计量学分析结果
2.5.1 聚类分析 将31批藜麦样品的22个共有峰的峰面积导入SPSS 22.0,利用系统聚类分析法,选取组间连接、平方欧氏(Euclidean)距离进行聚类分析,结果见图4。结果显示,当阈值T=10时,31批样品可大致分为4类,其中S1~S6、S12、S14~S16、S18~S22、S24、S26和S27聚为一类,S7、S10、S11、S13、S23、S25、S28~S31聚为一类,S8和S9各单独成一类。说明山西省各地之间的藜麦也存在一定的差异,尤其是品种不同差异较大。
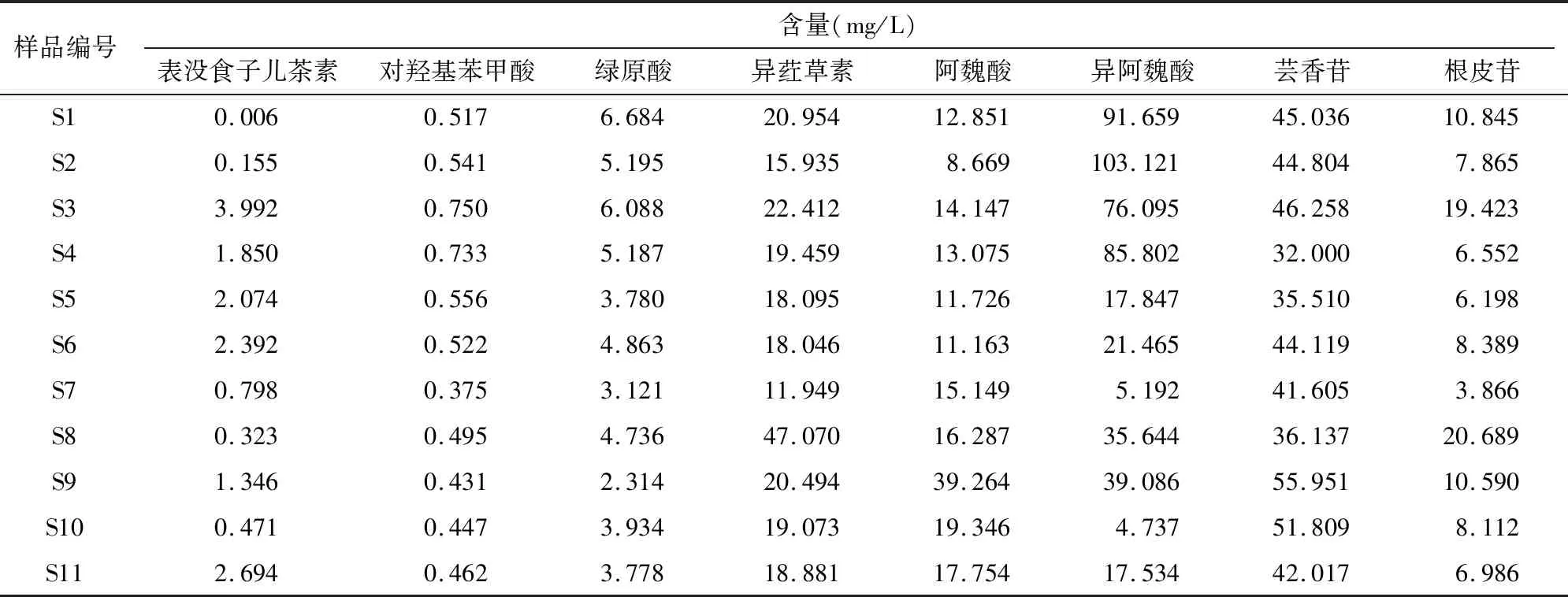
表4 8种成分含量测定结果

表4(续)
2.5.2 主成分分析 将31批藜麦样品中22个共有峰的峰面积导入SPSS 22.0,进行PCA标准化处理,计算得到相关系数矩阵、主成分特征值、方差贡献率和主成分综合得分等。
2.5.2.1 相关性分析 相关系数矩阵见表5。结果显示9号色谱峰(绿原酸)和10号色谱峰相互之间有较大的正相关性;11号色谱峰和13号色谱峰相互之间有较大的正相关性。
2.5.2.2 主成分特征值和方差贡献率 计算得到的主成分特征值和方差贡献率见表6,碎石图见图5。以基于特征值>1为提取标准,得到主成分分析结果。由表6可知,前7个主成分的累计贡献率为85.301%,说明所提取的前7个主成分即可代表山西藜麦指纹图谱中的22个成分量的信息,从而评价山西藜麦的质量情况。由图5可以看出,在主成分8处开始出现明显拐点,前7个主成分可以对藜麦质量进行评价,该结果与表6中的结果一致。
初始因子载荷矩阵见表7,载荷图见图6,它们反映了各变量对主成分的贡献程度。由表7和图6可知,第1主成分主要反映9、10、16和17号峰的主要信息;第2主成分主要反映3、5、11、13、15和18号峰的主要信息;第3主成分主要反映6、8和14号峰的主要信息;第4主成分主要反映19号峰的主要信息;第5主成分主要反映1和2号峰的主要信息;第6主成分主要反映7、20和21号峰的主要信息;第7主成分主要反映4、12和22号峰的主要信息。其中已标定的峰9(绿原酸)和峰16(异阿魏酸)落在第1主成分,峰15(阿魏酸)和峰18(芸香苷)落在第2主成分,峰6(表没食子儿茶素)和峰14(异荭草素)落在第3主成分,峰19(根皮苷)落在第4主成分,说明已标定的几个色谱峰在山西藜麦中比较稳定,对山西藜麦主成分的贡献率比较大,在决定不同批次间山西藜麦质量差异上有着重要作用。

表5 相关系数矩阵
2.5.2.3 主成分综合评价得分 以7个主成分得分与其方差贡献率乘积之和,得出不同产地藜麦31个样品的主成分综合评价得分(综合评价得分方程为F=25.002%F1+17.399%F2+12.982%F3+9.865%F4+7.996%F5+5.466%F6+6.591%F7)及排序,得分越高说明该样品在代表性主成分中综合质量越好。由表8可知,31个样品中S24、S21、S16、S23、S6、S2、S1和S20的质量相对较优。

表6 主成分特征值和方差贡献率
2.5.2.4 正交偏最小二乘判别分析 以藜麦样品22个共有峰峰面积为变量系数,将其导入SIMCA 14.1软件进行OPLS-DA,比较31个藜麦样品之间的差异,得到VIP预测值,筛选出差异性化合物[12]。由图7可以看出,以 VIP>1.0为阈值,筛选出6个峰,分别是色谱峰16(异阿魏酸)、14(异荭草素)、1、17、19(根皮苷)、15(阿魏酸),可作为山西藜麦质量控制的标志物,同时这几个成分对区分山西藜麦样品的产地贡献也较大。
3 讨论与结论
本研究用甲醇超声提取藜麦样品,对色谱条件进行了优化选择,确定了最佳的色谱条件,选取在247 nm波长处对山西藜麦样品指纹图谱进行了精密度、重复性、稳定性和回收率的方法学考察。基于HPLC技术建立了山西藜麦指纹图谱并进行分析,31批山西藜麦样品中确定了22个共有峰,通过与已知标准对照品比对,指认了8个色谱峰。通过对31批山西藜麦样品进行了相似度评价,结果表明除S8和S9以外其余样品的相似度均在0.84以上,说明山西各产地藜麦成分有较高的相似度,各成分差异不太明显,各共有峰相对保留时间比较接近,相对峰面积差异较大,说明山西不同产地藜麦各成分含量存在差异。因黑藜麦和红藜麦采集样较少,代表性不足,下一步将重点进行研究。
以22个共有峰面积为变量进行化学计量学分析,HCA 和PCA结果显示31批山西藜麦样品聚为4类,且同一地区藜麦样品也不一定归为一类,这可能与藜麦品种、产地、气候环境等多种因素有关,尤其是品种不同,差异较大。主成分分析提取到7个主成分,累计贡献率为85.301%,可代表山西藜麦指纹图谱中主要成分含量信息。主成分综合评价结果显示,样品S24、S21、S16、S23、S6、S2、S1和S20的得分比较靠前,说明其质量相对较优。OPLS-DA结果显示,通过VIP预测值排序,筛选出差异性化合物6种成分,分别是色谱峰16(异阿魏酸)、14(异荭草素)、1、17、19(根皮苷)、15(阿魏酸),可作为山西藜麦质量控制的标志物,同时这几个成分对区分山西藜麦样品的产地贡献也较大。
综上,本研究基于HPLC建立了山西省不同地区藜麦HPLC指纹图谱,结合化学计量学对31批样品进行相似度分析、HCA、PCA和OPLS-DA,研究结果可为山西藜麦产地溯源和质量控制提供有力的参考依据。

表7 初始因子载荷矩阵

表8 主成分得分、综合得分及排序
