1株牛蛙虹彩病毒的分离鉴定及其致病性
2022-11-15张丽娟杨金先李英英葛均青
张丽娟,杨金先,陈 强,李英英,葛均青
(福建省农业科学院 生物技术研究所,福建 福州 350003)
牛蛙(RanacatesbianaShaw)是一种可食用的大型蛙类,原产于北美,1958年引进我国,20世纪80年代中期开始规模化养殖[1]。牛蛙的适应性强、繁殖迅速、生长快,并且其肉白味美,营养价值高,受到了广大消费者的喜爱,因此养殖牛蛙的产量也年年攀高,成为我国淡水养殖的重要经济动物之一[2]。随着规模化、集约化养殖形式的不断增大,牛蛙的病害问题也日益严重。
牛蛙的病害主要有细菌性疾病、寄生虫病、病毒性疾病等。细菌性疾病主要有嗜水气单胞菌(Aeromonashydrophilia)、洛菲不动杆菌(Acinetobacterlwoffii)等革兰阴性菌引起的腹水病、红腿病,链球菌(Streptococcus)引起的腐皮病[3-4],迟钝爱德华菌(Edwardsiellatarda)引起的牛蛙爱德华菌病[5]等。细菌性疾病暴发后,及时找到病因并对症给药能够在很大程度上减少损失。寄生虫主要有体表的蚧螨、蛭、吸血虫等[6],体内消化道、呼吸道的岭南隐弯吸虫[7]、中华拟后盘吸虫[8]等,牛蛙的寄生虫病可以通过改善蛙的生活环境及饵料卫生来预防,可定期添加抗生素来驱除寄生虫。牛蛙的病毒性疾病主要为蛙虹彩病毒病,蛙虹彩病毒(Rana grylio virus,RGV)会跨物种感染不同的水生动物,造成更大的经济损失,引起了越来越多的关注[9]。
RGV属于虹彩病毒科(Iridoviridae),蛙病毒属(Ranavirus),在我国是1996年从沼泽绿牛蛙中首次分离[10]。PCV是一类胞浆型双链DNA病毒,平面呈六边形,表面为二十面体对称结构[11],具有很强的适应性,可数月存活于土壤和水体中并保持感染性[12]。RGV是一种危害牛蛙的重要病原,具有很强的传染性,可造成高达90%的死亡率,宿主感染后发病快,表现为食欲减退、行动迟缓,四肢发红出血,少数腹部鼓起等特征[13]。
本研究从发病牛蛙中分离培养出一株病毒,经鉴定,确定该病毒为一株RGV,称之为RGV-FJ;攻毒试验表明,RGV-FJ感染后牛蛙四肢及腹部发红出血,内脏出血明显,症状与养殖场中患病牛蛙相一致;通过组织病理学观察发现发病牛蛙的皮肤、肝脏、肾脏及肺部均有病变产生,且在牛蛙的各组织器官中均检测到了RGV-FJ。该病毒能引发牛蛙全身性感染,且对牛蛙的致死率高,在感染第4天的累积死亡率达到94.12%。这为进一步开展分离病毒的致病机理研究奠定基础。
1 材料与方法
1.1 细胞鲤鱼表皮瘤细胞系(epithelioma papulosum cyprini cell line,EPC)由本实验室保存,在含10%胎牛血清(fetal bovine serum,FBS)的Leibovitz L-15培养液中27℃培养。
1.2 病毒的细胞分离2010年10月,福建省某牛蛙养殖场暴发传染性疾病,取发病牛蛙的肝脏、脾脏、肾脏等内脏器官,匀浆后,取上清液过滤除菌,接种EPC细胞,每天观察和记录细胞病变情况,收集上清继续接种EPC细胞进行传代,连续传代3代后,细胞出现一致的典型病变效应(cytopathic effect,CPE),表明可能已分离培养出病毒,收集上清-80℃保存备用。
1.3 病毒粒子的电镜观察将收集的病毒培养上清接种到EPC细胞,待细胞病变超过50%,刮取细胞,12 000 r/min离心10 min,收集EPC细胞,2.5%戊二醛固定后,1% 锇酸固定3 h,50%,70%,90%,100%酒精中梯度脱水,树脂包埋,超薄切片,切片用醋酸铀和柠檬酸铅染色,在日立透射电镜HT7700下观察、拍照。
1.4 病毒的PCR鉴定根据蛙病毒属代表种FV3(frog virus 3)主衣壳蛋白基因(major capsid protein,MCP)(GenBank序列号:AY548484.1)序列设计引物MCPF:5′-GAATTCATGTCTTCTGTAACTGG-3′与MCPR:5′-AAGCTTGATTGGGAATCCCATC-3′。用Pure-LinkTMDNA/RNA virus Mini Kit(生工生物工程(上海)股份有限公司)试剂盒提取分离病毒的基因组DNA,进行PCR扩增,PCR产物克隆至pMD19-T载体(宝日医生物技术(北京)有限公司),抽提质粒,用EcoRⅠ和HindⅢ双酶切鉴定后,送生工生物工程(上海)股份有限公司测序。
1.5 病毒的滴度测定将病毒培养上清接种EPC细胞,第4天细胞病变超过80%时收集病毒培养物,冻融后收集上清,进行10倍比稀释,再接种到96孔培养的EPC细胞,每个稀释度4孔,设3次重复,27℃培养至第5天,观察并记录细胞产生CPE的孔数,根据Reed-Muench法计算病毒滴度TCID50。
1.6 病毒的攻毒试验实验牛蛙购自福建福州某牛蛙养殖场,体质量为75~100 g/只。将牛蛙随机分为2组,每组20只,一组腹腔注射0.2 mL的RGV-FJ病毒(3.2×107TCID50/mL),作为攻毒组;另一组注射0.2 mL正常EPC细胞的培养上清,作为对照组。攻毒后在室温24~26℃条件下常规饲养,每天观察牛蛙的健康状况,记录牛蛙的死亡数量及发病牛蛙的外观症状。
1.7 牛蛙组织的病理学观察分别取攻毒组和对照组牛蛙的皮肤、肝脏、脾脏、肾脏、肺组织,经Bouin氏固定液固定后制成石蜡切片,经苏木精-伊红(hematoxylin-eosin,H.E)染色后,显微镜下观察并拍照。
1.8 牛蛙组织中病毒的电镜观察及PCR检测取攻毒牛蛙的肺部组织,固定后按上述电镜观察方法观察组织中的病毒粒子。取攻毒组牛蛙的皮肤、肠道、肺、腿部肌肉、肝脏、脾脏、肾脏组织,试剂盒提取病毒DNA,根据上述获得的MCP序列,设计特异性引物RGV-F(5′-CAGTCGTCTCCCTCCCTACA-3′)和RGV-R(5′-AGGTGTAATTGGAGCCGA-CG-3′),进行PCR扩增鉴定,扩增产物用琼脂糖凝胶电泳鉴定。
1.9 病毒的重新分离与鉴定取攻毒组牛蛙的肝脏、脾脏、肾脏及肺等组织,经匀浆、过滤后接种EPC细胞,进行RGV-FJ的分离培养,观察和记录细胞病变情况。取病毒感染细胞,提取病毒DNA,以RGV的特异性引物RGV-F和RGV-R进行PCR扩增鉴定,扩增产物用琼脂糖凝胶电泳鉴定。
2 结果
2.1 牛蛙病毒的细胞分离铺满单层的EPC细胞接种病蛙组织匀浆液后继续培养,细胞从第2天开始出现圆缩、脱落,随着时间延长,脱落细胞增多,到第4天有80%的细胞发生病变;随着病变细胞增多,铺满培养瓶的单层细胞形成了网状(图1A);而对照细胞排列紧密,贴壁严实,细胞形态饱满(图1B)。

A.感染病毒的EPC细胞;B.对照EPC细胞
2.2 病毒的电镜观察收集感染病毒的EPC细胞,在透射电镜下观察,在细胞内观察到呈晶格状排列的病毒粒子,病毒粒子具囊膜,直径约150 nm(图2)。这与虹彩病毒粒子的特征是一致的,推测其可能是一株虹彩病毒。

图2 病毒粒子的电镜观察
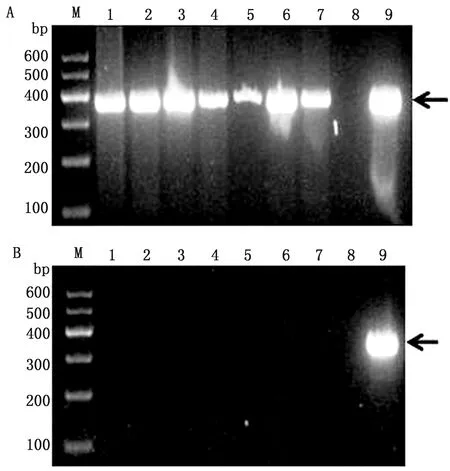
2.3 病毒的PCR鉴定根据蛙病毒属代表种FV3 MCP基因设计特异性引物,提取分离病毒的基因组DNA,进行PCR扩增,扩增出1条与预期大小一致的条带(图3A)。将该片段连接至pMD19-T载体后,经EcoRⅠ和HindⅢ双酶切验证(图3B),阳性克隆测序后获得1条1 392 bp的核苷酸序列,序列比对分析结果显示,该序列与多株蛙虹彩病毒的同源性超过98%。将该序列与GenBank中虹彩病毒科各属代表种的同源序列比对并构建系统进化树(图4),结果表明,该病毒株隶属于蛙病毒属,将其称之为RGV-FJ。

A.MCP基因的PCR扩增;B.pMD19-T-MCP双酶切验证

图4 基于MCP核苷酸序列构建的系统进化树
2.4 病毒感染牛蛙的患病症状通过腹腔注射方式攻毒研究分离病毒的致病性,结果显示,攻毒组牛蛙在第2天开始出现四肢及腹部发红出血,尤其是后肢出血症状更为明显,随着时间延长,出血症状越来越明显,到第4天发病牛蛙通体泛红,颜色变深(图5A),而对照组未见明显发病症状(图5B)。解剖后,攻毒组牛蛙的肝脏失血变白,肿胀(图6A),对照组牛蛙肝脏颜色鲜红,边缘锐利(图6B);攻毒组牛蛙肺部出血明显(图6C),对照组未见明显出血症状(图6D);攻毒组牛蛙的肾脏出血,颜色较深(图6E),对照组肾脏颜色较浅,未见明显出血症状(图6F)。

A.攻毒组牛蛙;B.对照组牛蛙
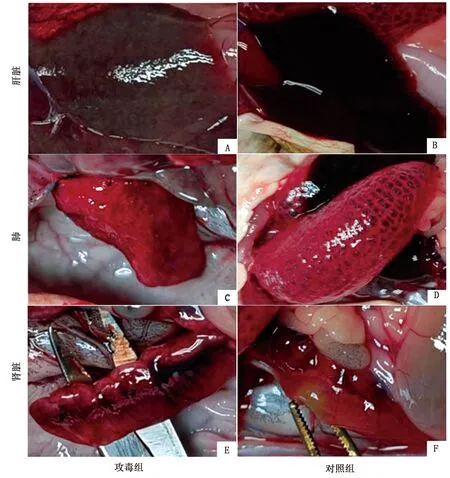
A.攻毒组肝脏;B.对照组肝脏;C.攻毒组肺;D.对照组肺;E.攻毒组肾脏;F.对照组肾脏
2.5 病毒感染牛蛙的组织病理学观察组织病理学观察发现,攻毒组牛蛙皮肤的黏液层细胞肿胀、排列紊乱,细胞间红细胞浸润,颗粒腺内蓄积大量不规则黏液颗粒,上皮细胞肿胀、空泡变性和坏死(图7A),而对照组皮肤黏液层细胞较平整,细胞间未见明显红细胞浸润,颗粒腺内未见不规则黏液颗粒(图7B)。攻毒组牛蛙肝脏细胞肿胀或萎缩,空泡变性、坏死,排列紊乱;门静脉与肝组织剥离,红细胞渗出且肿胀成不规则形态(图7C);对照组肝脏细胞排列紧密,结构完整(图7D)。攻毒组牛蛙的肾小管管腔变窄,上皮细胞肿胀、空泡变性,细胞界限模糊,大量红细胞和单核细胞浸润(图7E);对照组肾脏的肾小管管腔圆满,界限清晰(图7F)。攻毒组牛蛙的肺部囊泡细胞排列紊乱,有大量红细胞浸润、淤积(图7G);对照组肺部的囊泡细胞排列较整齐(图7H);攻毒组脾脏局部细胞空泡变性(图7I);对照组脾脏排列紧密,结构完整(图7J)。
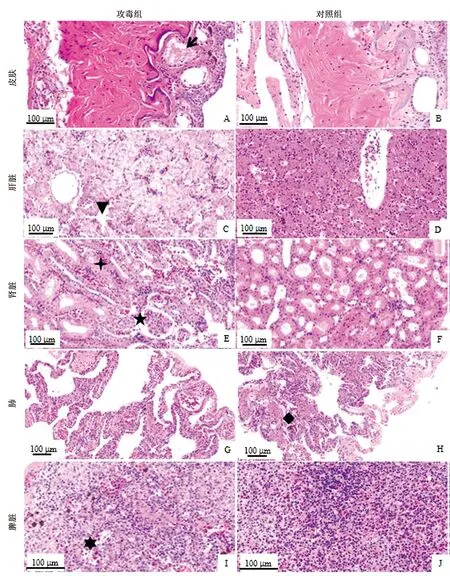
A.攻毒组皮肤;B.对照组皮肤;C.攻毒组肝脏;D.对照组肝脏;E.攻毒组肾脏;F.对照组肾脏;G.攻毒组肺;H.对照组肺;I.攻毒组脾脏;J.对照组脾脏
2.6 病毒感染牛蛙组织中病毒的电镜观察及PCR鉴定取攻毒组牛蛙的病变组织,切片后透射电镜观察,从肺部切片中发现了与细胞内形态特征一致的单个病毒粒子,直径大小约150 nm(图8)。

图8 RGV-FJ感染牛蛙肺中病毒粒子的电镜观察
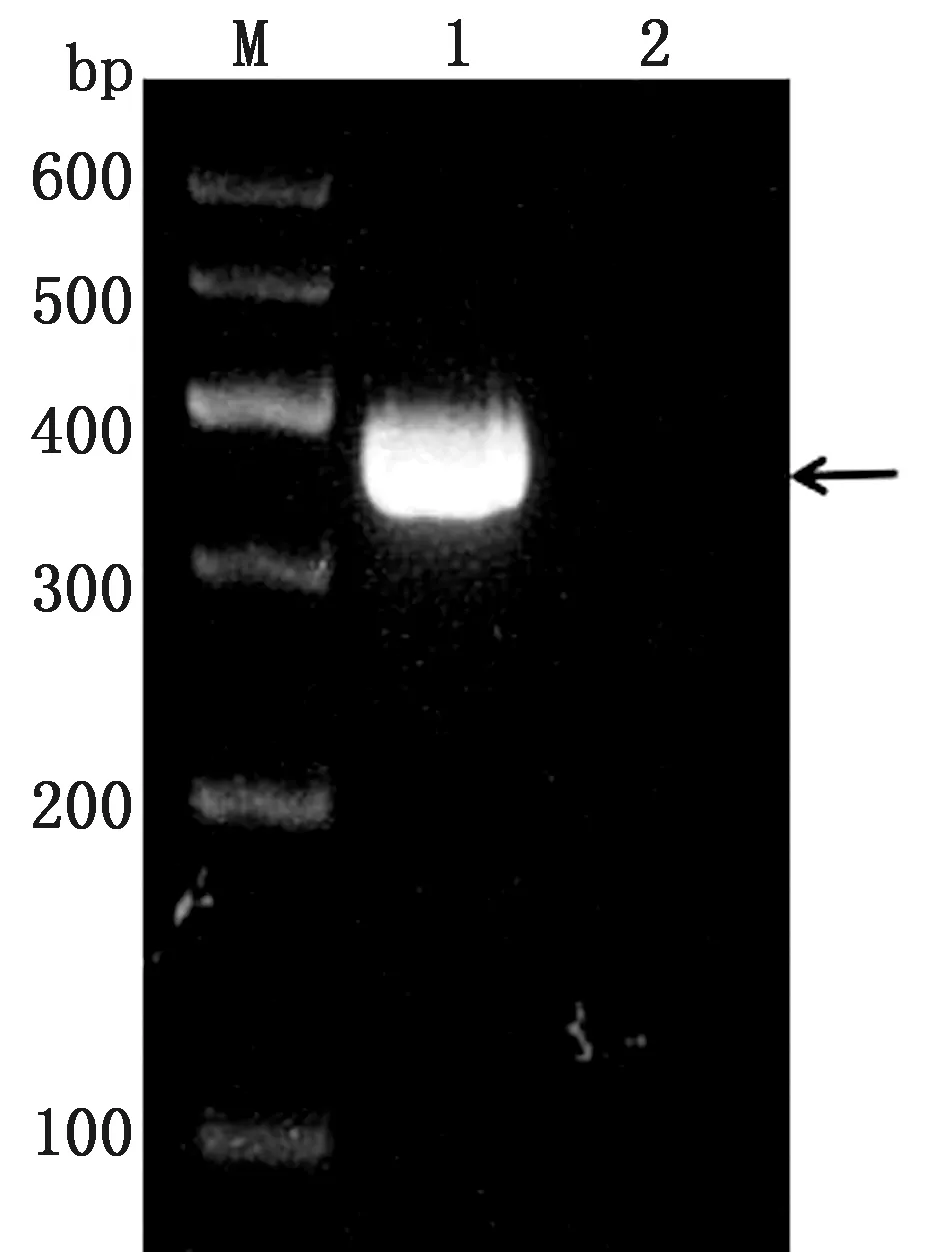
利用PCR检测攻毒组牛蛙各组织中的病毒感染情况,结果显示,肝脏、脾脏、肾脏、肠道、肌肉、皮肤和肺中均检测到RGV-FJ(图9A),而对照组牛蛙的相对应组织中均未检测到RGV-FJ(图9B)。这表明,腹腔注射RGV-FJ引起了牛蛙全身性系统感染。
A.攻毒组组织;B.对照组组织。1~7.分别为肝脏、脾脏、肾脏、肠道、肌肉、皮肤和肺;8.阴性对照;9.阳性对照
2.7 RGV-FJ对牛蛙的致死作用牛蛙腹腔注射RGV-FJ后第2天出现发病症状并开始发生死亡,攻毒第4天后死亡率为94.12%,对照组牛蛙在实验期内未出现发病症状,存活率为100%(图10)。
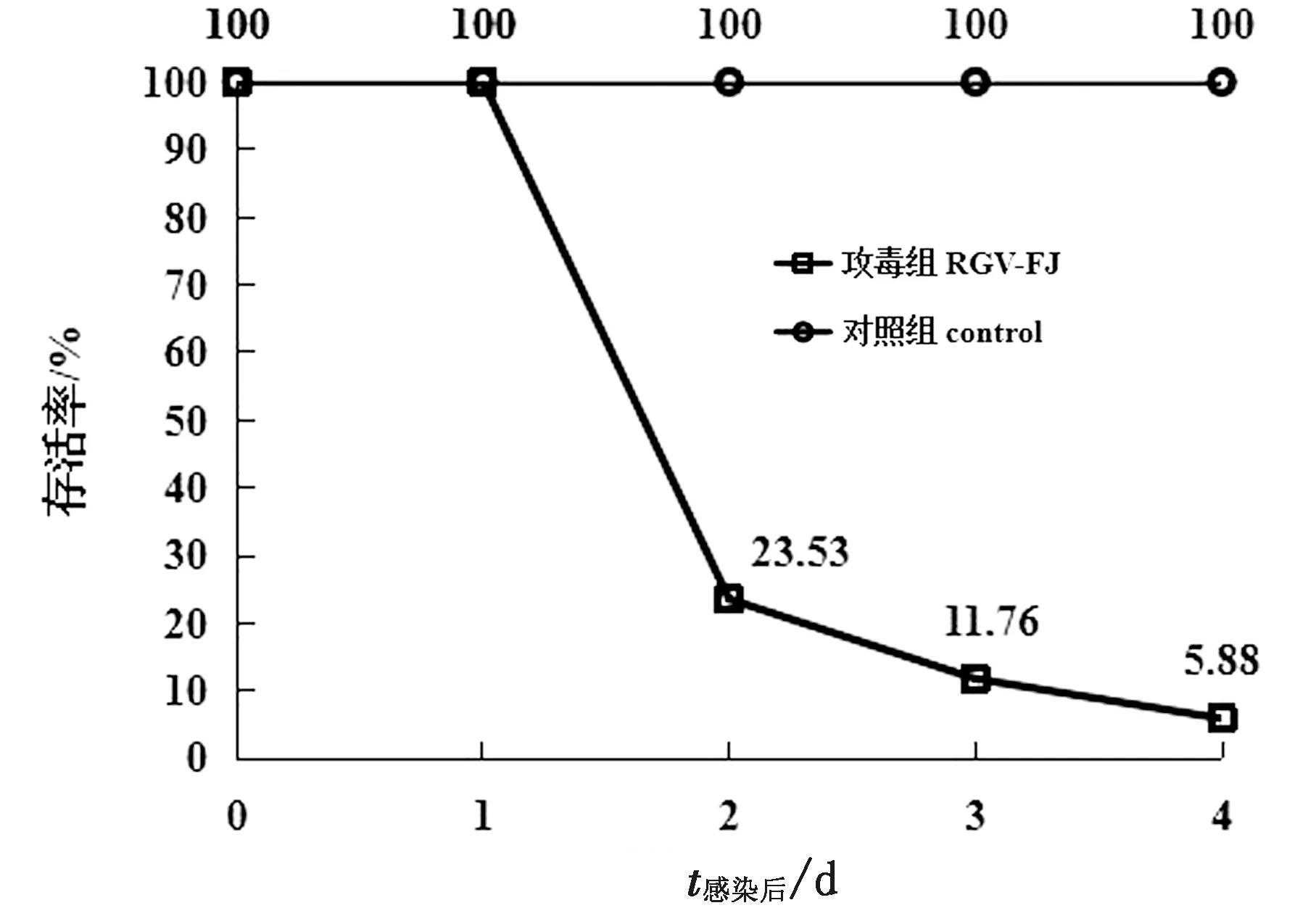
图10 RGV-FJ感染后牛蛙的存活情况
2.8 RGV-FJ的重新分离与鉴定取攻毒组牛蛙的肝脏、脾脏、肾脏及肺等内脏组织,匀浆后接种EPC细胞,进行病毒分离培养。结果显示,EPC细胞出现了病毒感染的CPE,细胞圆缩脱落,形成渔网状(图11A),对照组细胞排列紧密,细胞贴壁严实(图11B)。利用RGV-FJ的特异性引物对细胞培养物进行PCR检测,扩增出与预期大小一致的单一条带(图12)。这表明,从腹腔注射RGV-FJ的牛蛙主要内脏器官中重新分离出RGV-FJ。

A.感染病毒的EPC细胞;B.对照EPC细胞。
M.DL600 Marker;1.攻毒组;2.对照组
3 讨论
虹彩病毒是一类可以对鱼类、两栖类、爬行类等宿主造成多器官感染,且致死率极高的病毒。该病毒呈六边形,直径大小为120~300 nm[14]。根据致病症状及宿主等差异,虹彩病毒科可分为6个属,分别是虹彩病毒属(Iridovirus)、绿虹彩病毒属(Chloriridovirus)、淋巴囊肿病毒属(Lymphocystivirus)、肿大虹彩病毒属(Megalocytivirus)、蛙病毒属(Ranavirus)[11]和十足目虹彩病毒属(Decapodiridovirus)[15]。蛙病毒属可感染鱼类、两栖类和爬行类,其代表株蛙病毒3型(frog virus 3,FV3)于1962年从蛙肿瘤匀浆中分离得到[16]。张奇亚等[17]分析了3株从牛蛙分离到的病毒RGV-9506、RGV-9807、RGV-9808,其MCP基因序列相同,且与FV3非常相似。刘晓东等[13]从牛蛙分离到一株虹彩病毒FJ049,其MCP与RGV-9808的MCP同源率达到99.8%。本研究中,我们分离的RGV-FJ与FV3的同源性超过97%,确定该病毒隶属于蛙病毒属。
幼蛙感染RGV后,出现腿部红肿,腹部出血,肝肿大等症状[18],这与本研究中患病牛蛙的体表特征及病理症状一致。BRAND等[19]研究发现,FV3病毒在25℃时对两栖动物的致病性相较于在10℃时显著,在25℃条件下林蛙感染病毒后第4天开始死亡,而在10℃条件下感染死亡率极低。MIAUD等[20]从患病林蛙中分离到一株病毒(Common midwife toad virus,CMTV)对成年林蛙造成了100%的致死作用,林蛙的死亡是在感染后第10天开始,到第15天累积死亡率为100%。本研究中分离的RGV-FJ毒株在室温(24~26℃)对牛蛙的致病性强,感染牛蛙第2天开始出现死亡,到第4天累计死亡率达到94.12%,这与养殖场中牛蛙快速暴发病症并造成大规模死亡相一致,这可能与病毒的毒力较强有关,其致病机制有待于进一步深入研究。
目前,开展的蛙虹彩病毒病研究包括虹彩病毒检测新方法的建立[21-23]及灭活疫苗的研制[24-25]等。明确养殖动物疾病的致病病原是实现疾病有效防控的基础,本研究从患病牛蛙中分离病毒,经电镜观察、细胞分离培养及对MCP基因序列的测序并比对,确定其属于蛙病毒属,对该病毒进行致病性研究,这为进一步研究蛙虹彩病毒病的防治措施奠定基础。
