调控海马神经元中CDC42 蛋白活性对小鼠记忆和焦虑行为影响的研究
2022-11-15邹超杰唐义凯杜书文程宇琪
邹超杰,唐义凯,杜书文,程宇琪
(1)昆明医科大学第一附属医院精神科,云南 昆明 650032;2)清华大学生命科学学院,清华大学麦戈文脑研究院,北京 100084)
认知障碍(包括记忆损伤)是精神疾病患者临床表型中的核心症状,但是其病理机理至今尚未完全阐明。约85%的精神分裂症患者伴随着认知缺陷,包括学习能力[1]、工作记忆[2]、短时程记忆[3]缺陷,社交能力降低[4],恐惧、焦虑,选择性注意力等方面[5]。现阶段的研究认为海马、前额叶皮层等脑区和认知功能的实现紧密相关,精神疾病患者的海马存在一定程度的异常,如精神分裂症[6]和阿尔滋海默症(Alzheimer;AD)[7]患者海马的体积萎缩在全脑形态变化中尤其显著。大脑海马体积偏小的双胞胎在经历创伤后,其患有创伤后应激障碍(post-traumatic stress disorder,PTSD)的概率会大大增加[8]。精神分裂症患者呈现工作记忆时,其海马和背侧前额叶皮层(dorsolateral prefrontal cortex;DLPFC)之间的连接活性和同步性显著性降低[9]。这些结果说明海马结构异常及海马和DLPFC 之间的神经活动失调可能是导致认知功能障碍的重要原因。
在细胞水平上,Rho 家族小G 蛋白在神经发育和认知方面有着重要的作用[10-12],并首次被发现不同亚家族的小G 蛋白介导模式动物中不同学习记忆成分的遗忘调控机制,如Rac1 蛋白的激活能够促进果蝇嗅觉学习记忆和小鼠学习记忆的主动遗忘[13],CDC42 蛋白则在果蝇学习范式中被证明参与调控果蝇特定记忆成分-抗麻醉敏感记忆(anesthesia-resistant memory;ARM)的遗忘[14]。同时多种精神疾病中都发现伴有一定程度的小G蛋白表达水平异常。自闭症易感基因突变的果蝇模型中逆转学习能力的严重缺陷是由于由Rac1介导的主动遗忘通路不能被正常激活所导致的[15];自闭症易感候选基因2(autism susceptibility candidate 2 gene,AUTS2)作为Rac1 和CDC42 蛋白的上游调控因子参与调控神经元突触可塑性从而进一步影响学习记忆[16]。精神分裂症患者大脑DLPFC 椎体神经元中的树突棘密度同正常人相比显著降低,CDC42 蛋白在皮层和灰质中的mRNA表达水平也显著低于正常人[17]。Datta 等人[18]的研究认为CDC42 作为一个关键性的调控蛋白,在大脑中的异常表达是造成神经元树突棘密度降低的主要原因,对CDC42 相关通路的进一步研究有助于笔者进一步揭示精神疾病认知缺陷的病理机制。
笔者推测海马中CDC42 蛋白的异常可能是导致精神疾病中出现认知障碍的重要原因。本研究采用小鼠作为研究对象,通过分子生物学手段操纵小鼠海马区中CDC42 蛋白的活性,结合多种动物行为学范式来探索小G 蛋白CDC42 与小鼠认知缺陷之间的关系。
1 材料与方法
1.1 实验动物
实验所用动物为7~8 周龄雄性C57/B6J 小鼠,购买自北京维通利华实验动物技术有限公司。饲养于SPF 级动物房,5 只每笼,温度23 ℃,湿度50%,小鼠自由进水进食,垫料1 周更换2次,饲养房间由电脑控制光照时间12 h/12 h,保证小鼠正常的昼夜节律。本研究所有小鼠的使用和操作已得到清华大学动物伦理委员会的许可。
1.2 实验方法
1.2.1 质粒构建初始质粒pCyPet-CDC42(T17N)和 pCyPet-CDC42(Q61L)(Addgene plasmid # 22784和# 22783,来自Klaus Hahn 实验室)以及AAV核心骨架载体pAAV-CaMKIIα-EGFP(Addgene plasmid # 50469,来自Bryan Roth 实验室)购买自Addgene。浓度为1 µg/µL 的质粒用于分子克隆。经过酶切、回收、连接、转化、测序后得到pAAV-CaMKIIα-EGFP-CDC42(T17N)和pAAVCaMKIIα-EGFP-CDC42(Q61L)用于腺相关病毒AAV 的包装。
1.2.2 病毒制备293FT细胞培养24h后用vigofect 转染质粒,转染60 h 后收集细胞,用盐溶液(150 mM NaCl,20 mM Tris PH8.0)平衡柱子,加入样品后,用盐溶液(1×1 mL 200 mM NaCl,20 mM Tris pH8.0-discard;1×1 mL 300 mM NaCl,20 mM Tris pH8.0-discard;1×1.5 mL 400 mM NaCl,20 mM Tris pH8.0;1×3 mL 450 mM NaCl,20 mM Tris pH8.0;1×1.5 mL 500 mM NaCl,20 mM Tris pH8.0)依次洗脱,收集后3 次洗脱溶液,用AMICON µL TRA-4(100 000 MWCO;Milipore;CatNO:UFC810024)将6 mL 洗脱液浓缩至最小体积。进行AAV 病毒滴度判定(1×1012gc/mL)。
1.2.3 立体定位病毒注射具体实验流程参照[19],分别将病毒AAV-CaMKII-GFP、AAV-CaMKII-CDC42-DN-GFP 和AAV-CaMKIICDC42-CA-GFP 立体定位注射到小鼠的双侧海马区(每组20只)。注射过病毒的小鼠放回原笼饲养2 周。
1.2.4 免疫印迹CDC42 蛋白活性检测注射病毒2 周后,每组随机取4 只小鼠断颈处死,迅速分离出海马组织,加入10 倍于海马重量的1×裂解液(Millipore 5×Mg2+lysis/ wash buffer.Cat.92590)和1%的蛋白酶抑制剂(Cytoskeleton Proteinase inhibitor.Cat.# PIC02),冰上研磨15 s 并静置10 min;4 ℃高速离心机(Eppendorf 5417R)12 000 r/min 离心10 min,取上清(重复2次);BCA 法测定样品蛋白浓度,使用免疫共沉淀法检测Active CDC42 浓度。同时检测Actin 和Total CDC42 的蛋白浓度。
使用一抗Anti-CDC42antibody(1∶2000对于Active-CDC42的蛋白,1∶4000对于总CDC42蛋白),Anti-Actin antibody(1∶8 000)4 ℃过夜。二抗Anti-Mouse HRP-linked IgG,2.5∶4 000对 于Active-CDC42的蛋白,1∶4000对于总CDC42蛋白,1∶8 000 对Actin 蛋白。
1.2.5 免疫荧光注射病毒2 周后,每组随机取4 只小鼠处死灌流,取出脑组织,4%多聚甲醛中过夜固定(4 ℃);固定好的组织震荡切片后染色(DAPI 1∶4 000),在共聚焦显微镜下观察。
1.3 行为学实验
每组剩余的12 只小鼠用来进行相关的行为学实验。
1.3.1 旷场实验用于检测小鼠注射病毒以后的基本活动情况,如运动情况(locomotor activity)和焦虑程度(anxiety)[20]。行为箱(亚克力有机玻璃板50 cm×50 cm×40 cm)正上方有摄像头记录动物的运动轨迹和行为,箱子中央有Anymaze 软件(购自Stoelting Co.公司)自动划分的中央区域(30 cm×30 cm,小鼠不可见)。如果小鼠表现为焦虑,则围绕箱子四周边缘移动,而不倾向于去中央区域探索。小鼠在箱体内自由探索1 h,记录其在箱体内的轨迹速度和距离(每10 min 为一个时间节点)。
1.3.2 社交行为实验第1天,将小鼠放入行为箱中自由探索10 min,取出置于原笼饲养;第2天在箱体内放入1 只新的老鼠(置于透明圆筒中),放入实验小鼠自由探索10 min 形成社交记忆。用Anymaze 软件划分新小鼠所在的区域,实验小鼠距离新小鼠2 cm 以内且探索时间大于10 s,被认为是有效探索,记录10 min 内的探索时间;24 h后,测试实验小鼠10 min 内对熟悉小鼠和陌生小鼠的探索时间(新放入的小鼠为陌生小鼠,两只新小鼠交换位置排出空间记忆的影响)。
1.3.3 条件恐惧反射实验采用HABITEST 公司的条件恐惧反射行为系统。(1)痕迹恐惧记忆范式:训练阶段:将小鼠放入条件恐惧反射行为箱,适应90 s 后给予10 s 的声音刺激,间隔15 s 后给予2 s 0.6 mA 的电刺激。重复3 次(每次间隔4 min)。软件自动检测并记录小鼠恐惧程度,用小鼠不动(freezing)的时间占总时间的百分比来表示。测试阶段:24 h后,将小鼠放入训练的原环境中,记录4 min 内小鼠freezing 的时间。96 h 后进行同样的测试。(2)环境恐惧记忆范式:训练阶段同痕迹恐惧记忆范式;测试阶段:将训练后的小鼠放入新行为箱中,3 min 后给予声音刺激,记录4 min内小鼠freezing 的时间96 h 后进行同样的测试。测试结束放回原笼饲养。
1.4 统计学处理
所有数据统计和差异分析均在GraphPad Prism 8 软件中进行。进行差异分析的数据先经过Shapiro-Wilk Test 判断其是否符合正态分布规律,若符合则使用方差分析(ANOVAs)来比较多组间的统计学差异;若数据不符合正态分布,则在组间使用Mann-Whitney 检验或Kruskal-Wallis方差分析。所有统计数据均用平均值(Mean)±方差(SEM)的形式体现,本文中数据差异均为实验组和对照组间的差异,P<0.05 为差异有统计学意义。
2 结果
2.1 腺病毒AAV 表达操纵海马区CDC42 蛋白的活性
为了在海马区特异性的操纵CDC42 蛋白的表达活性,采用腺相关病毒AAV 来操纵海马区特定细胞基因的表达。CDC42蛋白基因上的氨基酸突变,可以显著增强(CA-AAV-CaMKII-cdc42 consist active;CDC42-CA)或抑制(DN-AAVCaMKII-cdc42 dominant negative;CDC42-DN)内源性CDC42 蛋白的活性。笔者采用亚克隆的方法,将原始质粒所包含的CDC42 突变体克隆到AAV载体当中。将病毒注射到小鼠背部海马CA1 区和DG 区(图1A),2 周后发现AAV 病毒可以正确表达在小鼠海马区(图1B)。通过蛋白免疫印迹实验发现尽管AAV 只在海马中表达,但是能够特异性的增加或降低CDC42 蛋白在海马区的表达活性(图1C)。
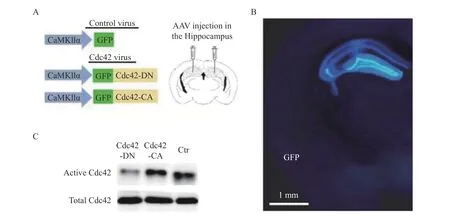
图1 AAV-CaMKII-CDC42-GFP 特异性地操纵海马区CDC42 蛋白的活性Fig.1 AAV-CaMKII-CDC42-GFP specifically regulated CDC42 activity in hippocampal neurons.
2.2 激活海马区CDC42 活性能使小鼠产生焦虑的行为表型
用旷场实验(见实验方法)来检测小鼠注射完病毒后的运动情况及焦虑程度。小鼠在陌生的环境中趋向于在边缘区域运动,当熟悉环境后会更多的停留在中央区域,同时其运动速度也会下降。如果小鼠表现为焦虑,则其更喜欢在边缘区域活动。记录60 min 内各组小鼠在边缘区域的运动距离和速度,结果发现40 min后,激活海马区CDC42 蛋白活性的小鼠在边缘区的运动距离和速度都远高于健康组小鼠(图2A、2B),同时50 min后,激活海马区CDC42 蛋白活性的小鼠在中央区域的时间明显减少。这意味着CDC42-CA小鼠到新环境后的焦虑程度更高,在1 h 内尚未得到缓解(图2C)。抑制海马区CDC42 蛋白活性的小鼠没有表现出明显的焦虑症状。
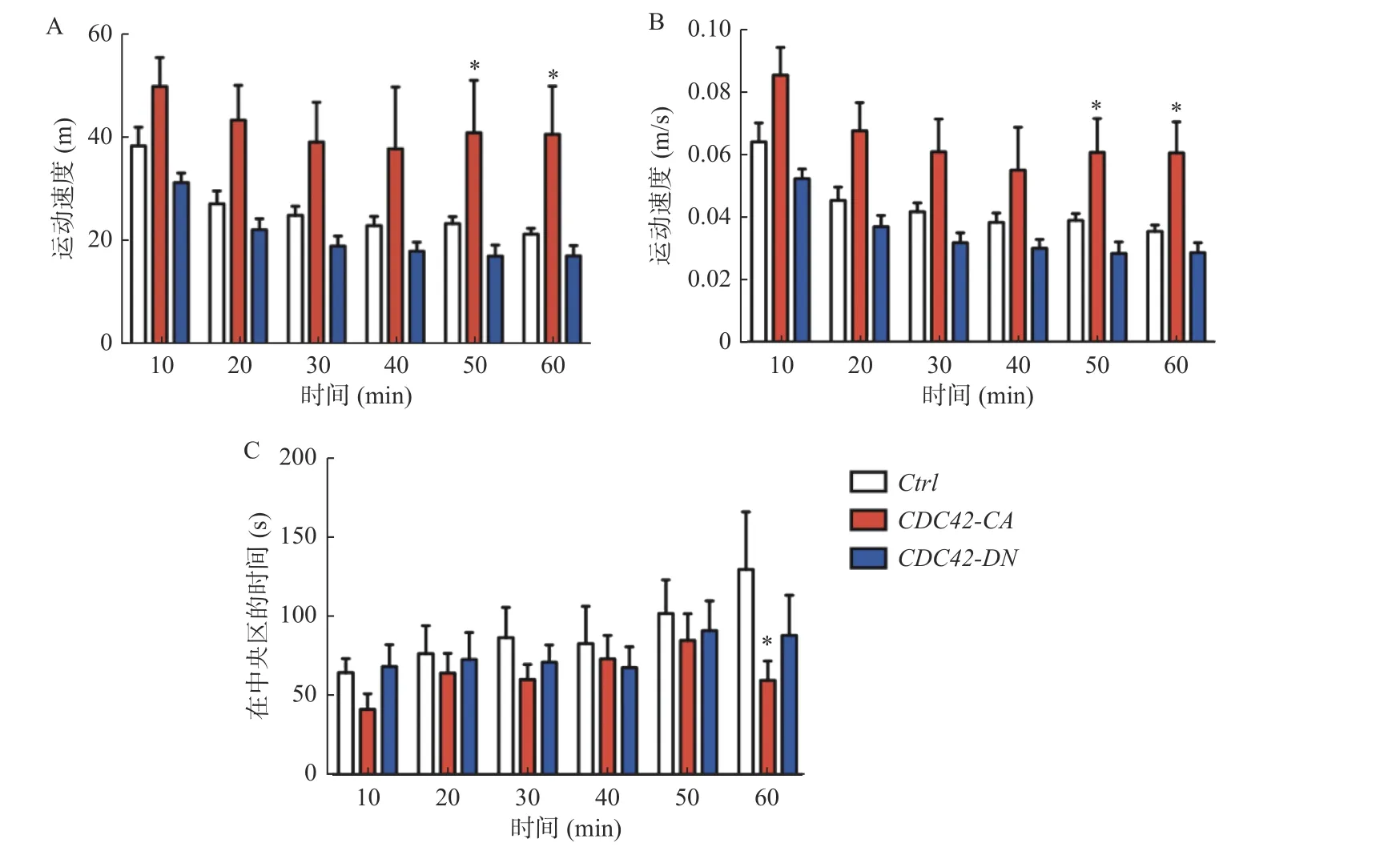
图2 只有激活海马区CDC42 蛋白活性使小鼠产生焦虑的行为表型Fig.2 Only activation of CDC42 activity in hippocampal neurons produced an anxiety-like behavior in mice
2.3 调控海马区CDC42 蛋白活性影响小鼠的条件恐惧记忆
为了检测海马神经元中CDC42 蛋白活性的改变是否对小鼠的学习记忆产生影响,笔者首先通过条件恐惧记忆的训练范式对小鼠进行训练和测试(图3A)。训练结束后立即测试各组小鼠的学习情况(即学习值),发现注射完病毒的各组小鼠学习能力无差异,P>0.05(图3B)。几分钟后,将训练后的小鼠放入新环境中(红色),发现训练结束后,新环境不会对各组小鼠的恐惧记忆产生影响(图3C)。
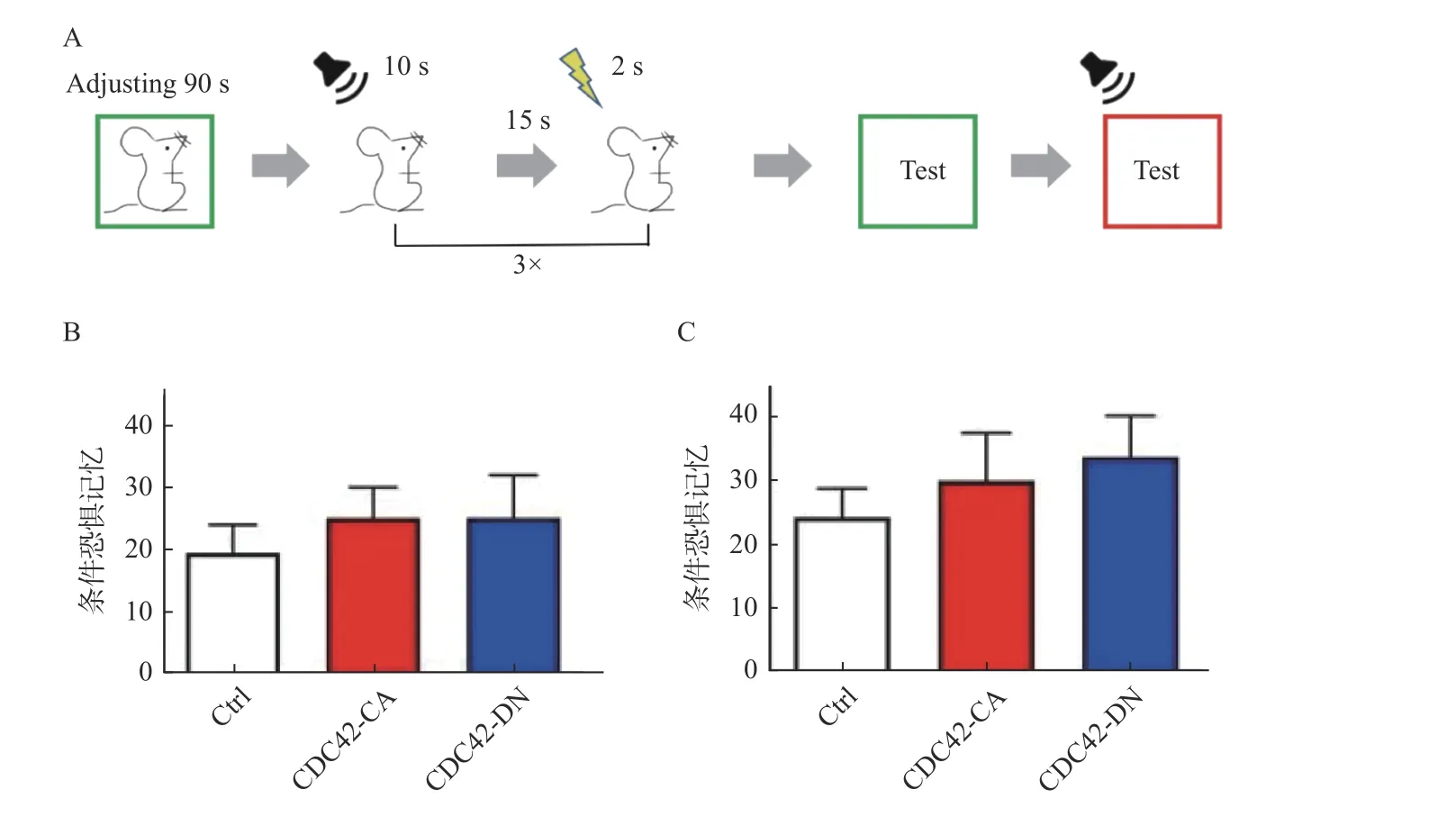
图3 CDC42 活性变化不影响小鼠的学习能力且新环境对恐惧记忆的表现无影响Fig.3 CDC42 activity regulation did not affect the learning and the new environment did not affect the performance of fear memory in mice
笔者检测了小鼠的24 h 痕迹恐惧记忆(图4A),结果发现抑制海马区CDC42 蛋白活性的小鼠对于声音的恐惧记忆高于对照组小鼠,而激活海马区CDC42 蛋白活性的小鼠对于声音的恐惧记忆低于对照组小鼠(图4B)。在96 h 之后测试了小鼠的环境恐惧记忆,将小鼠放回到训练时的环境中(绿色),不给予声音,记录小鼠的freezing 情况(图4A)。与之前结果一致,笔者发现抑制海马区CDC42 蛋白活性的小鼠的小鼠表现出恐惧记忆增加,而激活海马区CDC42 蛋白活性的小鼠则表现出记忆遗忘加快的现象(图4C)。因此,笔者推断通过改变海马中CDC42 蛋白的活性能改变条件恐惧记忆的可塑性,进而进一步影响了小鼠的记忆认知表型。为了进一步研究该相关性,笔者又对注射了AAVCDC42-DN 和AAV-CDC42-CA 的小鼠进行了其他行为范式的训练测试。
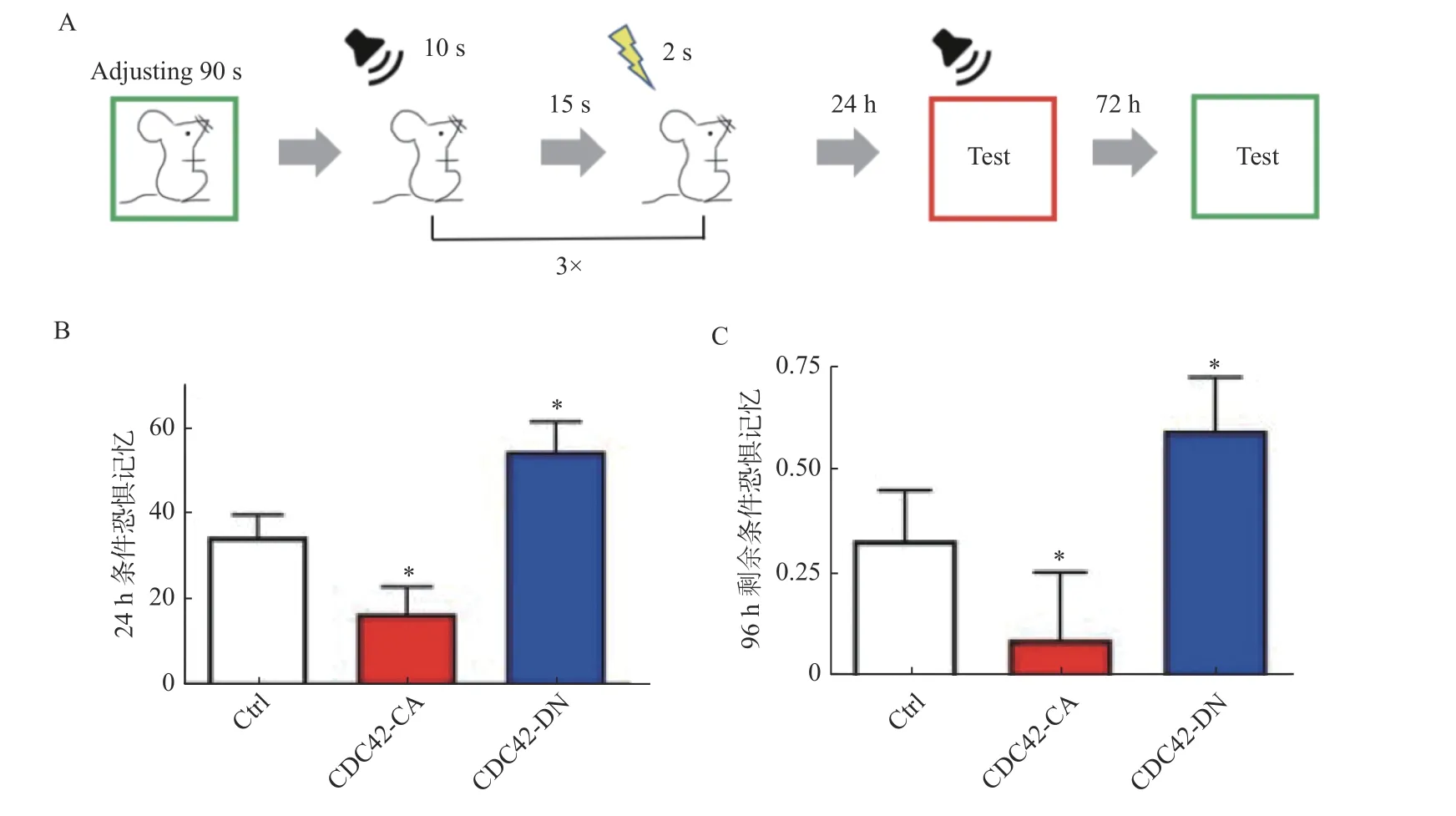
图4 调控海马区神经元CDC42 蛋白活性双向影响小鼠的条件恐惧记忆Fig.4 Regulation of CDC42 activity in hippocampal neurons bidirectionally affected fear conditioning memory
2.4 调控海马神经元CDC42 蛋白活性不影响小鼠社交记忆
社交能力的降低是临床上用来评价精神疾病患病程度的重要指标之一。如图5A 所示,实验组小鼠首先与1 只新小鼠接触并形成社交记忆,间隔24 h后,将实验小鼠放置在包括熟悉小鼠和另一只陌生小鼠的环境中(2 只新放入的小鼠交换位置,避免小鼠的空间记忆产生干扰),通过记录实验小鼠对于熟悉小鼠和陌生小鼠的社交活动时间来分析小鼠的社交记忆(图5A)。
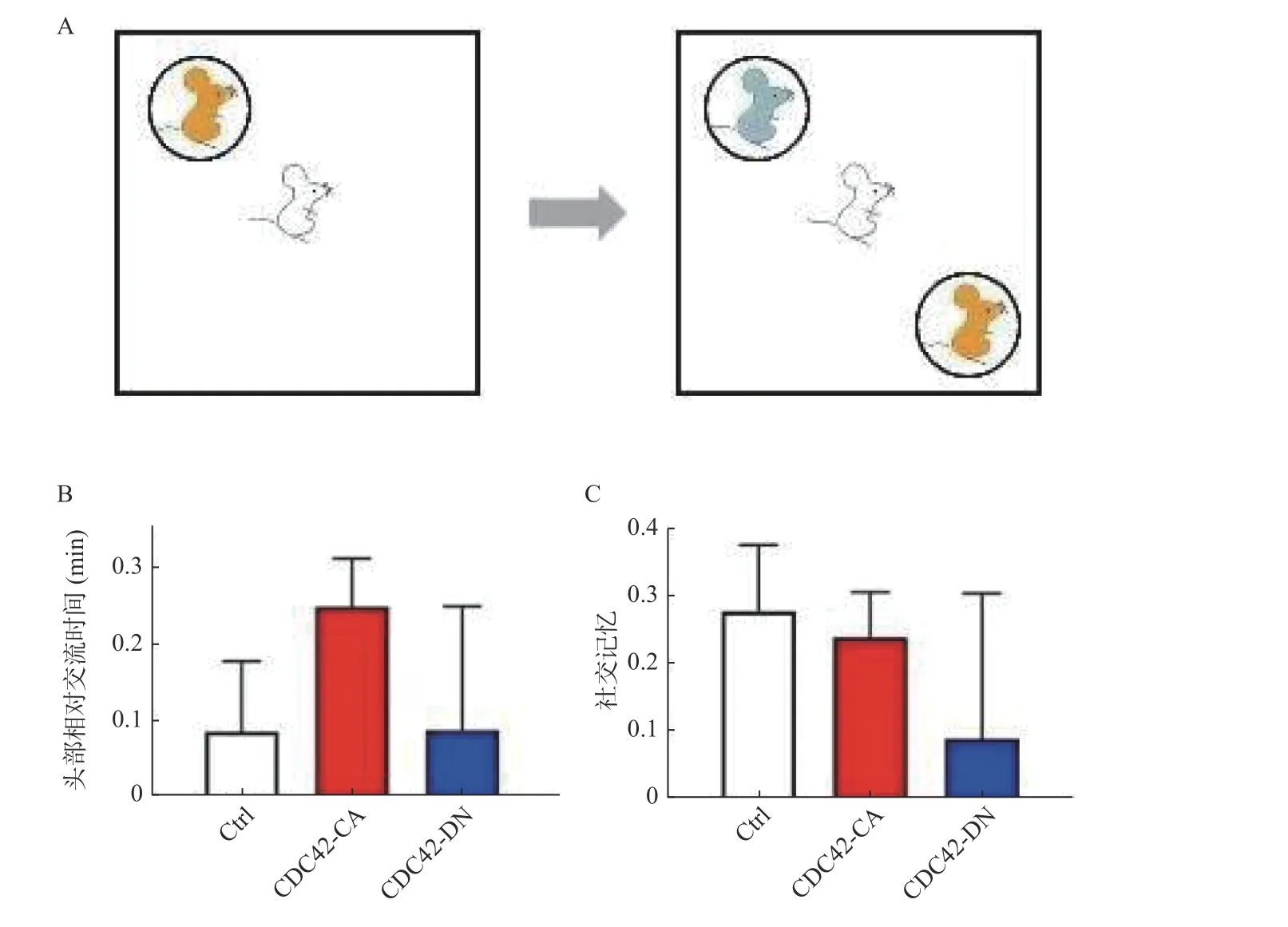
图5 调控海马神经元中CDC42 蛋白的活性不影响小鼠社交记忆Fig.5 Regulation of CDC42 activity in hippocampal neurons had no effect on social memory of mice
通过分析不同实验组小鼠的社交时间以及小鼠头部指向小鼠的时间参数,笔者并未发现激活海马神经元中CDC42 蛋白活性和抑制海马神经元中CDC42 蛋白活性的小鼠对照组相比其社交记忆有显著性的差异,P>0.05(图5B、图5C)。因此,笔者认为无论激活或抑制小鼠海马神经元CDC42蛋白的活性均不会影响小鼠的社交记忆。
3 讨论
笔者通过腺病毒注射在小鼠海马组织表达CDC42 蛋白的氨基酸突变从而调控CDC42 蛋白活性,通过条件恐惧记忆范式,社交记忆范式和旷场实验以及结合生化和免疫荧光的方法证明了CDC42 蛋白能够参与到认知障碍以及焦虑的行为表型中。这进一步证明了笔者的研究假设即精神患者大脑海马区CDC42 蛋白活性的异常可能和病人表现出的认知障碍(记忆损伤)有关。研究中发现只有增加CDC42 蛋白活性能够影响小鼠的焦虑行为,笔者猜测只有激活CDC42 蛋白能够导致调控焦虑相关的下游分子环路的改变从而改变了小鼠的行为,而抑制CDC42 蛋白活性并不能负向调控相关的信号通路,因此不影响小鼠的焦虑行为。
同时,结果显示调控海马CDC42 蛋白活性能够双向调控小鼠的条件恐惧记忆,但是不影响小鼠的社交记忆,这意味着CDC42 蛋白活性的改变只参与特定类型的记忆调控(类似于Rac1 和CDC42 蛋白对果蝇学习记忆遗忘的调控模型),而非所有记忆类型的调控。在果蝇嗅觉惩罚记忆范式中[13],Rac1 蛋白参与调控果蝇麻醉敏感记忆的主动遗忘,而CDC42 蛋白在果蝇学习范式中被证明参与调控果蝇特定记忆成分抗麻醉敏感记忆的遗忘,但并不参与记忆的形成[14]。除此之外,在其它模式动物中也有发现Rac1 蛋白和CDC42蛋白在神经突触可塑性上的不同作用,如在海兔(Aplysia)上的研究表明CDC42 蛋白,参与了长时程易化的过程,而Rac1 蛋白并不参与该过程[21];在小鼠中发现Rac1 蛋白的缺失能够特异性的影响海马的突触可塑性,进而导致工作记忆的缺陷[22],而CDC42 蛋白的缺失能够特异性的损害神经突触可塑性,并影响久远的记忆[23]。这意味着小G 蛋白Rac1 和CDC42 在大脑中可能参与调控不同的学习记忆类型,但是其具体分工及机制还需要在更高等的动物模型上进行进一步的研究和验证。从本文的数据可以进一步猜测,精神分裂症等精神疾病患者社交需求的降低并不是由海马中的CDC42 来参与调控的,这一过程可能存在其它的分子机制或其它的脑区来调控。
目前针对认知障碍的病理机制尚未有完整的解释,之前的研究主要集中在神经递质的发放紊乱、神经损伤以及基因遗传等方面。本工作中发现的CDC42 蛋白活性异常和部分记忆类型的损伤以及焦虑行为相关,但还需要在更多的行为学范式上检测其对不同记忆类型的影响,如新物体识别、水迷宫实验等。同时,除海马外,其它在认知功能中起重要作用的脑区(如皮层、杏仁核等)中也有着小G 蛋白的表达异常,CDC42 蛋白在这些脑区中的活性改变也可能参与到该认知障碍理论中。其次还可以利用一些阻断CDC42 蛋白活性的化合物,探索这些化合物的使用是否对造成的记忆损伤有改善作用。另外,有研究表明精神分裂症高危因子DISC1 能通过Rac1 蛋白调节谷氨酸能突触的树突棘形成[24],精神分裂症病人树突棘中触发CDC42 蛋白介导的肌动蛋白纤丝重组的级联信号通路发生了改变[25],这意味着小G 蛋白的上游调控因子在精神分裂症中可能也有着直接的作用,如果能够找到CDC42 蛋白上游的调控因子或蛋白,验证这些蛋白在认知损伤中的功能,这将进一步完善精神分裂症中影响认知缺陷的CDC42 信号通路。
本研究运用分子生物学结合动物行为学的方式在动物模型中来探索小G 蛋白CDC42 和精神疾病认知缺陷之间的关系。现阶段CDC42 蛋白和精神疾病之间的研究主要集中在临床患者,特别是患者去世后的尸检、影像学研究等方面,变量多且复杂,个体差异明显且具有局限性,目前并没有很好的动物模型可以用来探究其病理机制。通过AAV 病毒表达载体构建的这一CDC42 突变模型能够化繁为简、特异性的作为部分认知障碍机制的研究模型。
