基于术中快速分子病理检测的脑胶质瘤手术策略研究进展
2022-11-15熊章罗宸吴帅吴劲松
熊章 罗宸 吴帅 吴劲松
根据2021版《WHO中枢神经系统肿瘤分类》(WHO CNS5)[1],成人弥漫性脑胶质瘤主要分为:星形细胞瘤,IDH突变型;少突胶质瘤,异柠檬酸脱氢酶(IDH)突变和1p/19q共缺失;胶质母细胞瘤,IDH野生型。研究表明,最大程度的安全切除可以改善胶质瘤病人术后症状、生活质量、无进展生存期(PFS)和总生存期(OS)[2-3]。目前,术中的主要干预技术一方面是针对肿瘤组织边界的研究,力求探明肿瘤组织浸润边界,以期做到肿瘤的全切,如术中导航、术中磁共振、术中荧光显影、术中超声等;另一方面是对脑功能区识别的研究,以避免术中对脑功能区的损伤,做到安全切除肿瘤,如神经电生理刺激、术中唤醒等。这些技术的单独应用或组合使用可提高胶质瘤病人的PFS和OS[4]。分子病理在脑胶质瘤诊疗中的地位愈发重要。研究发现,手术切除程度对不同分子亚型的脑胶质瘤病人的预后影响并不相同。脑胶质瘤分子病理术中快速检测技术逐渐成熟,既往有多项研究对此进行了相关探索。本文重点探讨手术切除程度对不同分子亚型成人弥漫性脑胶质瘤预后的影响,总结脑胶质瘤术中快速分子病理检测的研究进展。
脑胶质瘤分子病理对手术的指导意义
脑胶质瘤的弥漫性生长意味着外科医生很难完全切除肿瘤,胶质瘤的切除范围(extent of resection,EOR)也一直是神经外科领域的研究热点。Smith等[5]研究低级别胶质瘤的EOR时发现,EOR大于90%的病人会有相对较好的5年OS(97%)、5年PFS(75%)、8年OS(91%)和8年PFS(43%)。他们还发现,当EOR阈值在80%以上时,低级别胶质瘤病人的OS会随着EOR的提升而提高。在精准医疗时代,针对不同分子亚型的脑胶质瘤病人进行个体化治疗是未来的趋势。WHO CNS5对不同分子亚型(如IDH突变、1p/19q共缺失、TERT启动子突变等)给出了比较明确的诊断分类,不同诊断分类的胶质瘤对应不同的术后辅助治疗策略及预后预期,而其对胶质瘤手术的指导尚不明确。神经外科医生在术中实时了解肿瘤的分子病理,及时调整手术策略,并在最大化肿瘤切除与最小化功能损伤之间取得平衡。研究发现,胶质瘤病人IDH突变率为46%,TERT启动子的突变率为45%,包含IDH和(或)TERT的突变率达到了91%[6]。我们以IDH和TERT突变状态为线索,结合WHO CNS5,对不同分子亚型病人预后与手术切除程度的相关性进行总结。
一、IDH突变型(IDHmut)+TERT突变型(TERTmut)
有研究发现,成人胶质瘤中IDH和TERT的双突变几乎与1p/19q共缺失是一致的[7],我们认为,IDHmut+TERTmut的分子分型是少突细胞胶质瘤。
Hou等[8]利用中国胶质瘤基因组图谱数据库(Chinese Glioma Genome Atlas database,CCGA)对449例胶质瘤病人的临床及病理信息分析发现,对于KPS>80,年龄>45岁的少突细胞胶质瘤病人,与次全切(subtotal resection,STR)相比,肿瘤的完全切除(gross total resection,GTR)不能使病人更加受益。也就是说,对于该分子分型的胶质瘤在手术切除时不必太过激进,少许残留不会影响病人预后。这可能是由于少突胶质细胞瘤呈惰性生长,且对常规术后辅助治疗(放疗及替莫唑胺化疗)较为敏感,即使不能完全切除肿瘤,病人仍可存活较长时间。该团队还提出对于这些肿瘤应该进行“有效的安全切除”,即在保留功能的前提下最大化切除肿瘤。Delevl等[9]研究发现,少突胶质细胞瘤的肿瘤是否完全切除(GRT)对病人的总体生存影响不大。因此,结合Berger教授对低级别胶质瘤的研究,对于分子分型为IDHmut+TERTmut的胶质瘤,可在保留功能前提下有效切除(EOR>80%)。
二、IDH突变型(IDHmut)+TERT野生型(TERTwt)
依据最新的胶质瘤分类指南WHO CNS5,IDHmut胶质瘤应诊断为:星形细胞瘤,IDH突变型,组织学等级分为2~4级,其中以低级别胶质瘤为主。低级别星形细胞瘤是一种生长相对缓慢的浸润性脑肿瘤,指南推荐低级别胶质瘤的影像学切除边界则为T2WI/FLAIR的高信号区域[10]。Wijnenga等[11]研究发现,对于低级别IDHmut星形细胞瘤(WHO 2级),任何术后残留都会影响生存预后,甚至需要在确保安全的情况下进行二次手术,切除残余肿瘤,以达到GTR的目的。Hou等[8]研究指出,对于低级别星形细胞瘤(IDHmut),提升EOR可改善病人的预后。另外,对于2021版指南中高级别IDHmut星形细胞瘤(WHO 3~4级),即2016版《WHO中枢神经系统肿瘤分类标准》(2016 CNS WHO)分类中IDH突变的间变星形细胞瘤和胶质母细胞瘤,并不是所有肿瘤在术前影像上都有T1WI增强序列的强化灶,关于切除范围的研究较少。Beiko等[12]发现,对有强化灶的病人进行影像学边界(强化灶)切除,可改善生存预后,而强化灶以外的切除尚有争议。对于无强化灶的病人,切除范围对预后的影响需要进一步研究。总体而言,这部分病人应尽可能做到影像学边界全切。
三、IDH野生型(IDHwt)+TERT突变型(TERTmut)
依据最新的胶质瘤分类指南WHO CNS5,该类型突变应诊断为胶质母细胞瘤,IDH野生型,WHO 4级,预后较差。目前,高级别胶质瘤手术切除的共识是:按照其影像学边界,即磁共振T1WI的增强区进行切除[13]。胶质母细胞瘤具有很强的浸润性,肿瘤细胞常出现在增强区域之外的瘤周区,即T2WI/FLAIR的高信号区(非增强区)。2020年发表在JAMA Oncology上一项多中心回顾性研究提出,对于胶质母细胞瘤,同时切除高级别胶质瘤的增强区和非增强区可明显改善年龄<65岁病人的预后,对于65岁以上的病人,扩大切除非增强区可能获益不明显[14]。相比于影像学边界的GTR,扩大切除非增强区可明显提高胶质母细胞瘤病人生存时间。目前的观点基本支持对非增强进行扩大切除,但对于应达到怎样的切除阈值对病人预后获益最显著仍有争议。对于少部分IDHwt+TERTmut分子分型的胶质瘤,组织病理表现为较低级别胶质瘤,影像学上并无T1WI增强区,有关手术切除范围的研究较少。我们团队的一项回顾性研究发现,对于此类型的胶质瘤,基于T2WI/FLAIR高信号区的最大化安全切除可使病人明显受益[15]。
四、IDH野生型(IDHwt)+TERT野生型(TERTwt)
对于分子分型为IDHwt+TERTwt的胶质瘤,如果其组织病理为高级别胶质瘤(合并微血管增生/坏死等恶性特征),则可诊断为胶质母细胞瘤(符合2016 CNS WHO分类标准和WHO CNS5分类标准)或儿童弥漫性高级别胶质瘤(主要分子特征为组蛋白H3改变,包括H3 K27改变及H3 G34突变,以及其他分子改变)。胶质母细胞瘤手术切除范围的研究如前文所述,建议进行增强区+T2/FLAIR高信号区(非增强区)切除的手术策略。而儿童弥漫性高级别胶质瘤多数侵犯功能区或中线部位,手术完全切除难度大,研究发现,只有对肿瘤的GTR才会有明显的生存获益[16],而STR与活检相比则无明显的生存差异。这就要求在术前对肿瘤类型及切除程度有所判断,或者通过活检取样,对相关分子指标进行术中检测,术中明确其病理诊断,再决定是否进行GTR或手术以外其他辅助治疗。因此,对于儿童高级别胶质瘤的相关手术策略研究,可能还需要更为可靠的术中分子检测技术的支持。
IDHwt+TERTwt分子分型中组织病理为低级别的胶质瘤,准确的分子病理诊断需要结合相关分子的测序结果,其中少数具有特定分子特征:TERT启动子突变(TERTmut,该分子分型前文已阐述)、EGFR 基因扩增或7号染色体扩增/10号染色体缺失三者之一,纳入胶质母细胞瘤的诊断,暂无与EOR相关的详细分子分层研究,可依据指南进行T2/FLAIR高信号区(影像学边界)切除的手术策略。其余主要考虑诊断为儿童弥漫性低级别胶质瘤,包括弥漫性星形细胞瘤,伴MYB/MYBL1改变、血管中心型胶质瘤及弥漫性低级别胶质瘤,伴MAPK信号通路改变等。对所有IDHwt的低级别胶质瘤的研究发现,提升T2WI/FLAIR高信号区(影像学边界)的切除率可改善生存预后[15,17]。在后续的研究中我们会更多关注不同分子分型与手术切除范围对病人预后获益的影响。另外,局限性星形细胞瘤的分子分型也为IDHwt+TERTwt,包括毛细胞型星形细胞瘤、多形性黄色细胞瘤等,影像学可表现为强化灶,如果术中检测出它们具有的特定分子特征(如BRAF、NF1、ATRX等突变),可帮助明确诊断,进行影像学边界切除即可达到很好的治疗效果[18]。
脑胶质瘤术中快速分子病理检测的研究进展
WHO CNS5对脑脊髓肿瘤分类进行了第六次修订,引入了更加丰富的分子分型,以及更加完善的与组织学类型相结合的整合病理诊断与分级。临床常见的胶质瘤病理类型有:星形细胞瘤,IDH突变型(IDH1,IDH2,ATRX,TP53,CDKN2A/B);少突胶质瘤,IDH突变+1p/19q共缺失(IDH1,IDH2,1p/19q,TERT,CIC,FUBP1,NOTCH1);胶质母细胞瘤,IDH野生型(IDH野生型,TERT,7/10染色体改变,EGFR)等。不同分型意味着不同的治疗策略和预后,所以提供实时的分子突变信息,将允许外科医生根据每个病人的基因图谱调整手术策略。在大多数神经病理学实验室中,1p/19q共缺失是通过荧光原位杂交(FISH)检测,IDH突变(IDH1 R132H)则通过免疫组化(IHC)方法进行检测。其他更详细和精确的分子突变信息将会根据病人需求进一步进行基因测序分析。然而,基于下一代测序技术(NGS)的基因检测不仅价格较高,而且检测周期较长(5~14天),无法应用于术中检测。随着神经外科的发展,人工智能的融合,研究人员开发了基于MRI的影像组学技术,可用于术前无创预测IDH突变状态。然而大部分影像组学模型尚缺乏外部验证集,不能很好解释模型构建原理,影响了临床的应用和转化。与此同时,科学家们也在尝试对组织标本的术中检测技术。下文总结了近年来胶质瘤术中分子检测技术的研究进展。
一、直接分子检测技术
基因测序技术正在快速发展,分子检测已经从选择性使用标准PCR发展到常规使用实时定量PCR(Real Time-PCR),再到最近的下一代测序或高通量测序。在整个演变过程中,桑格(Sanger)DNA测序一直是测定核酸序列的金标准,但每次反应只能检测少量的序列,且对检测标本要求较高(目标序列含量不少于20%)。NGS则可在大规模并行高通量测序时单次进行数百万到数十亿个的测序反应,明显缩短了检测时间和成本,增加了输出的序列,对科学研究和临床实践有重要意义。然而这些技术仍然耗时较长,操作复杂,只能用于对术后标本的检测。我们在临床实践中,主要是想通过术中检测获取少数已知关键分子的突变状态(如IDH、TERT等)。为此,科学家开发了一系列点突变检测的技术,使术中分子检测成为可能。
1.IDH1和IDH2的突变主要为4号外显子132密码子和172密码子的改变。有多种方法可检测这些突变,包括焦磷酸测序、免疫组化、低温变性共扩增PCR(CO-amplification at Lower Denaturation temperature PCR, COLD-PCR)等。单个核苷酸位点的突变会使双链DNA溶解的温度发生改变,COLD-PCR利用这一特征[19],在PCR过程中通过精确控制温度,使突变频率很低的目的片段呈指数级扩增。科学家对COLD-PCR继续优化,将扩增产物进行荧光溶解曲线分析(FMCA),实现了快速、灵敏、特异的术中检测IDH1和IDH2突变。该技术灵敏度高特异性好,即使突变频率低至2.5%也能准确进行检测,从取下标本到得出突变结果仅耗时约60分钟,结果准确可靠。该技术的难点在于对不同突变片段临界温度的确定,暂且只能进行IDH1和IDH2的突变检测,大规模的临床应用也尚缺乏可靠的前瞻性研究证据。
2.实验室常用的DNA提取步骤一般都需要裂解、反复多次离心和洗涤,操作比较耗时费力。科学家建立了一种简单的DNA提取方法[20],仅需将少许胶质瘤标本用Tris-EDTA缓冲液在95 ℃条件下孵育5分钟,收集上清即可。作者进一步整合已开发的IDH荧光探针(all-in-one),进行了后续的测序检测,整体流程需要90~100分钟,在保证检测结果准确性的同时大大提升了检测效率,可用于术中的分子检测。该技术可检测肿瘤细胞含量高于10%的组织,目前只能检测IDH突变状态,其他分子指标有待进一步开发。
3.扩增阻滞突变系统(Amplification Refractory Mutation System-PCR,ARMS-PCR)是基于PCR技术建立的用于检测已知点突变的方法[21]。其原理是在PCR过程中引入2条引物,使其3'端碱基分别与突变和野生型模板碱基互补,随着DNA链的延申就可以将突变状态检测出来。但在实际过程中单个错配碱基有时也可以进行DNA链的延伸,造成假阳性。Timucin等提出了包含3个错配碱基的系统(3m-ARMS),即在野生型引物3'端加入3个错配碱基,明显减弱非特异性延伸,总耗时1个小时,操作方便,非常适合术中使用。该技术对于引物设计要求较高,目前只能进行IDH1/2的检测。
4.锁核酸(Locked Nucleic Acid,LNA)是一种特殊的核酸衍生物,可与相应DNA单链片段互补结合形成杂交体。相比与普通双链DNA,杂交体具有更高的溶解温度(Tm)。基于该原理,阎海教授团队将LNA技术用于分子检测的qPCR中开发了GliomaDx技术[22],可明显增强突变位点与引物的特异性结合,促进突变片段的指数扩增,从而提高了目的基因的检测效率。GliomaDx技术的敏感性是Sanger测序的200多倍(最低可检测密度为0.2%),可识别出其他技术可能漏诊的病例,并且可在1个小时内完成对组织样本IDH及TERT突变状态的检测。该技术操作简单,如果能够扩大检测范围,将可以提升术中分子检测的实用性。
二、其他检测技术
分子病理的重要性日益凸显,科学家们提出了对术中分子分型的渴求,也一直在研发不同的检测新技术。IDH状态是胶质瘤分型和预后的重要指标,IDH突变后可形成2-羟基戊二酸(2-HG)的堆积,有学者建立了一系列检测2-HG的方法,可间接反应IDH的突变状态。质谱分析是一种测量物质质荷比的方法,已被广泛用于医疗领域。近几年来有许多经研究聚焦于质谱技术实现术中对2-HG的快速检测[23],比如高效液相色谱-电喷雾串联质谱法(Liquid Chromatography/Electrospray Ionization tandem Mass Spectrometry,LC/ESI-MS/MS)、解吸电喷雾电离质谱(Desorption Electrospray Ionization-Mass Spectrometry,DESI-MS)、气相色谱-质谱联用(Gas Chromatography Mass Spectrometry,GC-MS)[24-26]等,这些技术不仅可以间接判断IDH状态,还可以评估肿瘤细胞百分比,时效性和准确性都很好,但目前仅能作为一种辅助技术,也许未来随着技术的发展可以大规模应用于临床,整合入胶质瘤治疗管理,术中评估多种分子突变状态,甚至可用来评估肿瘤边界。
其他可快速检测分子突变状态的技术还包括拉曼光谱、快速免疫组化、微流控技术等。术中分子检测相比常规术后的分子检测要求较高,必须具备高灵敏度、高特异度、高时效性,且操作流程简捷。目前大部分的检测技术还需更新迭代,不断发展,转化成临床实践成果。各类技术的优缺点详见表1。
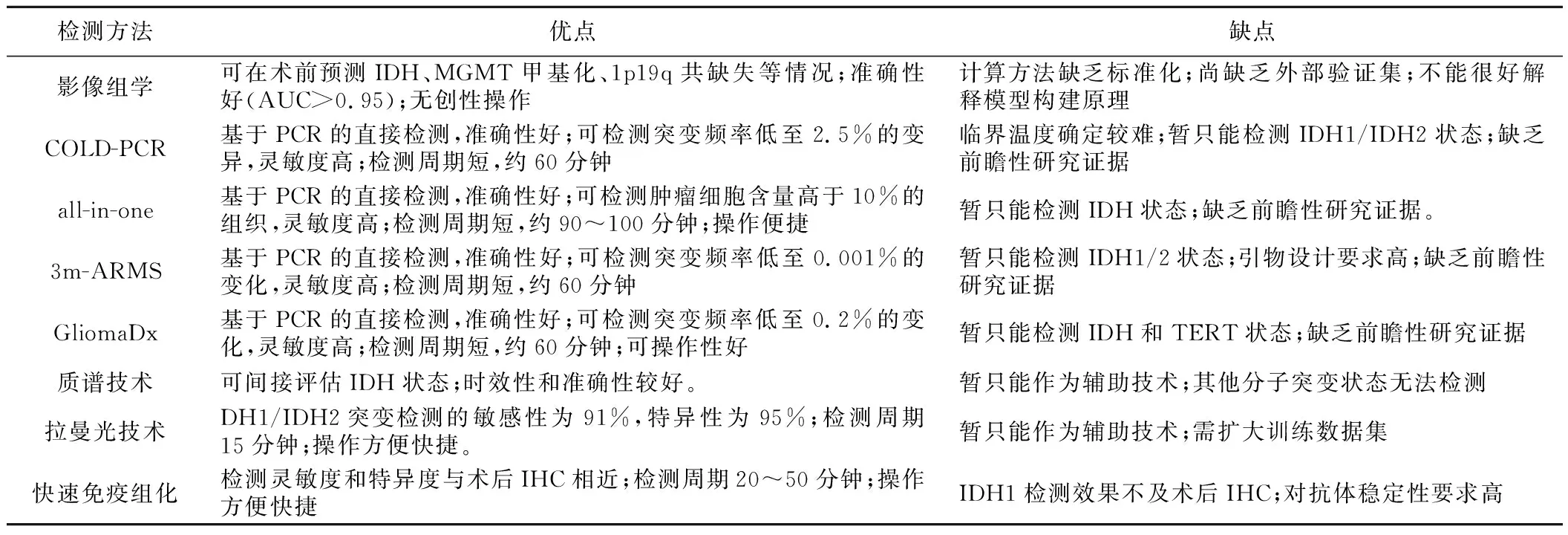
表1 各项快速分子检测技术的优缺点
脑胶质瘤分子病理已成为是脑胶质瘤诊疗中的必不可少的一环,随着研究的进展,我们发现分子病理不仅可以用于脑胶质瘤的整合诊断、预后预测、治疗指导,还影响病人手术切除所带来的预后获益。术中快速分子病理检测是实现分子病理指导脑胶质瘤手术切除的关键。当下高新技术迅速发展,测序技术、影像技术、物理化学技术、免疫技术、人工智能技术等逐渐融入各个领域,术前及术中分子病理检测也逐渐成为可能。随着相关研究对术中分子病理检测技术的优化与整合(图1),术中分子病理检测可通过准确的分子分型指导胶质瘤手术策略,推进脑胶质瘤的精准治疗。
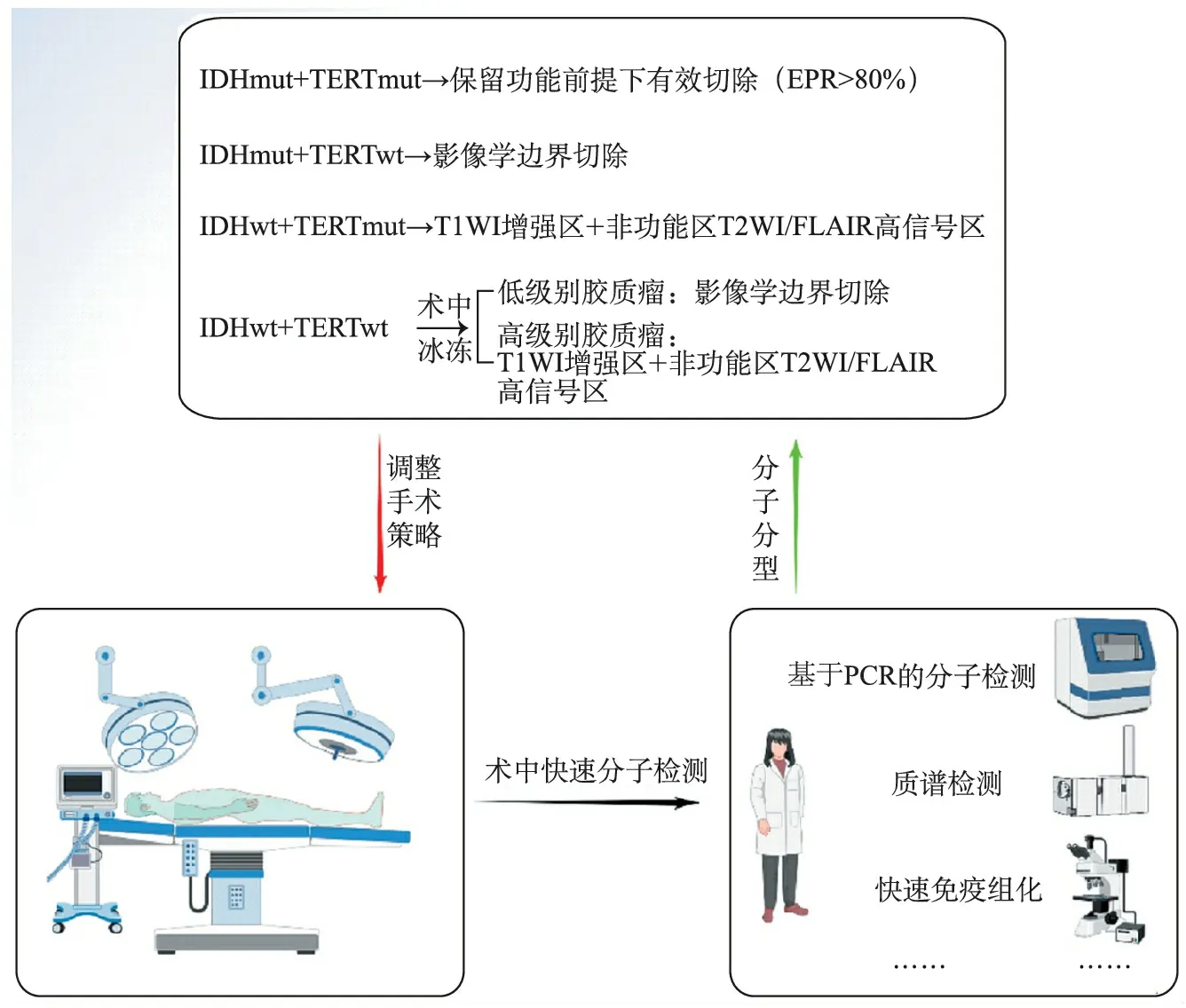
图1 脑胶质瘤分子分型指导手术切除的示意图
