利用细菌表面展示技术强化细胞固定化生产吲哚-3-乙酸
2022-11-15刘晴浩包心茹黄建忠
苏 愉,刘晴浩,包心茹,黄建忠,祁 峰*
(1.福建师范大学生命科学学院工业微生物发酵技术国家地方联合工程研究中心, 福建 福州 350117; 2.福建师范大学细胞逆境响应与代谢调控福建省高校重点实验室, 福建 福州 350108)
固定化细胞是指固定在水不溶性载体上,在特定的空间限度内完成生命活动的细胞[1-2]。由于固定化细胞能实现正常的生长、增殖和代谢,所以又称固定化活细胞或固定化增殖细胞。和游离细胞培养相比,固定化细胞可以容易地从反应介质中去除,减少细胞在介质中的损失,可以具有高热稳定性,对pH变化和有机溶剂的耐受性,细胞可反复使用、能实现连续操作等优点[3]。目前,固定细胞的方法根据细胞固定原理的不同,主要分为五类:吸附、离子结合、共价结合、包埋和交联[4-5]。生物炭是一种含炭量较为丰富的成本低廉的材料,通常由各种废弃生物质在高温高压条件下热解制作而成,其具有相对较大的比表面积、高孔隙率、较好的稳定性和丰富的官能团[6],生物炭能为细菌提供一个稳定的环境,使细菌免受外界环境的伤害,因此生物炭是适合细菌固定的优良载体[7]。已知生物炭的吸附能力与表面积、孔径分布、表面官能团、阳离子交换能力等理化性质直接相关[8]。据报道大多数未改性的生物炭表面都带有负电荷[9],对生物炭进行改性可以增加表面正电荷,从而吸附带负电的物质,提高吸附能力,Zhang等[10]用NaOH改性山桃木生物炭,改性后提高了吸附金属离子的能力。Liu等[11]用十六烷基三甲基溴化铵改性稻壳生物炭吸附2,4-二氯苯酚,改性生物炭和未改性生物炭的最大吸附量分别为59.81、20.89 mg·g-1,表明改性生物炭的吸附量显著高于未改性生物炭。
细菌表面展示(Bacterial SurfaceDisplay),是将目标蛋白表达转运并锚定细菌表面的一种重要技术[12],主要通过DNA重组把外源功能蛋白的编码基因(Coding Gene)与宿主细菌的锚定域(Anchoring Domain)编码基因融合,融合蛋白可以在锚定基序引导下,在宿主细菌中表达、分泌并锚定在细胞膜上,实现细菌表面展示,蛋白可以维持原有的构象和生物学功能,具备生物诱导催化的活性[13]。Wee等[14]利用凤梨欧氏杆菌的冰晶核蛋白INaA,成功地将木聚糖酶展示在E.coli细胞表面。Zhang等[15]利用源于丁香假单胞菌的冰晶核蛋白INaK将MalE和TorA信号肽以及3个带电多肽6×Lys、6×Glu和6×Asp锚定在INaK-N的N端,以提高对人精氨酸酶1(ARG1)的表面显示效率。
大多数细菌表面含有磷酸基和羧基,在水溶液中会因为细胞膜表面基团电离而带负电,因此细菌在水溶液中会显负电性[16]。本研究利用细菌表面展示技术,以冰晶核蛋白INaA(来源于凤梨欧氏杆菌Erwiniaananas)、INaK(来源于丁香假单胞菌pseudomonassyringae)为锚定蛋白,将能够携带负电荷的氨基酸(例如谷氨酸、天冬氨酸)锚定在E.coli表面,增加E.coli细胞膜表面携带的负电荷,以强化重组E.coli细胞与改性生物炭的吸附作用。
吲哚-3-乙酸(IAA)是生长素中最常见的激素,它调节植物生长的各个方面,在植物的生理学中起关键作用,参与细胞分裂、伸长、分化、果实发育和向光性反应[17],广泛应用于农业。本实验室已开发了1株高产IAA的E.coli菌株,利用此策略将其表达有冰晶核蛋白和负电荷氨基酸融合蛋白的质粒导入IAA高产菌株,用FeCl3改性玉米秸秆生物炭,使表面呈正电性,利用静电吸附原理,强化细胞与生物炭之间的吸附能力,能够延长生命周期,使其在全细胞催化中具有更大的潜力。
1 材料与方法
1.1 试验材料
1.1.1菌株和质粒 本研究中大肠杆菌E.coliTOP 10用于构建质粒,菌株E.coliMG1655为全细胞催化反应产IAA的工程菌株。质粒pRB1K用于载体的构建,合成的基因均来自通用生物有限公司。玉米秸秆生物炭(BC)购买自河南立泽环保科技有限公司。本研究所用的菌株和质粒见表1。

表1 菌株和质粒
1.1.2试剂和仪器 氨苄和卡那青霉素均购自生工生物工程(上海)股份有限公司;质粒提取试剂盒购自北京全式金生物技术有限公司;胶回收试剂盒购自OMEGA公司;其余试剂为国产分析纯;2×Phanta MaX Master Mix聚合酶购自Vazyme公司;Gibson Assembly无缝连接酶购自NEB公司;Waters e2695高效液相色谱系统,配置Waters2998紫外检测器。
1.1.3培养基和培养条件 LB培养基、酵母提取粉0.5%(W/V)、蛋白胨1%(W/V)、氯化钠1%(W/V)用于培养大肠杆菌,37℃、220 r·min-1摇床培养。2 g·L-1的色氨酸用于大肠杆菌的全细胞催化,Tris/HCL缓冲液(pH=7.5)。质粒pRB1K的抗性为卡那霉素,卡那霉素终浓度50 μg·L-1。
1.2 试验方法
1.2.1质粒的构建 (1)来源于凤梨欧氏杆菌Erwiniaananas的冰晶核蛋白INaA为瞄定蛋白。pRB1K-INaA-EGFP、pRB1K-INaA-9NCAs-EGFP和pRB1K-INaA-45NCAs-EGFP载体的构建:采用GibsonAssembly连接技术构建重组质粒。设计引物,通过引物INaA-45NCAs-EGFP-F、INaA-45NCAs-EGFP-R扩增出带有同源片段及RBS序列的冰晶核和带45个负电荷氨基酸(天冬氨酸、谷氨酸)的融合蛋白基因INaA-45NCAs-EGFP,再通过设计引物V-INaA-45NCAs-EGFP-F和V-INaA-45NCAs-EGFP(以载体pRB1K-EGFP为模板)扩增出含有对应骨架同源的片段V-INaA-45NCAs-EGFP,将片段和骨架片段混合,通过GibsonAssembly技术,得到pRB1K-INaA-45NCAs-EGFP质粒。设计引物,通过引物INaA-EGFP-F、INaA-EGFP-R(以pRB1K-INaA-45NCAs-EGFP质粒为模板)扩增出带有同源片段及RBS序列的冰晶核蛋白基因INaA-EGFP,再通过设计引物V-INaA-EGFP-F、V-INaA-EGFP-R(以pRB1K-INaA-45NCAs-EGFP质粒为模板)扩增出含有对应骨架同源的片段V-INaA-EGFP,将片段和骨架片段混合,通过GibsonAssembly技术,得到pRB1K-INaA-EGFP质粒。设计引物,通过引物INaA-9NCAs-EGFP-F、INaA-9NCAs-EGFP-R(以pRB1K-INaA-45NCAs-EGFP质粒为模板)扩增出带有同源片段及RBS序列的冰晶核和带有9个负电荷氨基酸(天冬氨酸和谷氨酸)的融合蛋白基因INaA-9NCAs-EGF,再通过设计引物V-INaA-9NCAs-EGFP-F、V-INaA-9NCAs-EGFP-R(以pRB1K-INaA-45NCAs-EGFP质粒为模板)扩增出含有对应骨架同源的片段V-INaA-9NCAs-EGFP,将片段和骨架片段混合,通过GibsonAssembly 技术,得到pRB1K-INaA-9NCAs-EGFP质粒。(2)来源于丁香假单胞菌(pseudomonassyringae)的冰晶核蛋白INaK为瞄定蛋白。pRB1K-INaK-EGFP、pRB1K-INaK-9NCAs-EGFP和pRB1K-INaK-45NCAs-EGFP载体的构建:采用Gibson连接技术重组质粒。设计引物,通过引物INaK-45NCAs-EGFP-F、INaK-45NCAs-EGFP-R扩增出带有同源片段及RBS序列的冰晶核和带45个负电荷氨基酸的融合蛋白基因INaK-45NCAs-EGFP,再通过设计引物V-INaK-45NCAs-EGFP-F、V-INaK-45NCAs-EGFP(以载体pRB1K-EGFP为模板)扩增出含有对应骨架同源的片段V-INaK-45NCAs-EGFP,将片段和骨架片段混合,通过GibsonAssembly 技术,得到pRB1K-INaK-45NCAs-EG1FP质粒。设计引物,通过引物INaK-EGFP-F、INaK-EGFP-R(以pRB1K-INaK-45NCAs-EGFP质粒为模板)扩增出带有同源片段及RBS序列的冰晶核蛋白基因INaK-EGFP,再通过设计引物V-INaK-EGFP-F、V-INaK-EGFP-R(以pRB1K-INaK-45NCAs-EGFP质粒为模板)扩增出含有对应骨架同源的片段V-INaK-EGFP,将片段和骨架片段混合,通过GibsonAssembly技术,得到pRB1K-INaK-EGFP质粒。设计引物,通过引物INaK-9NCAs-EGFP-F、INaK-9NCAs-EGFP-R(以pRB1K-INaK-45NCAs-EGFP质粒为模板)扩增出带有同源片段及RBS序列的冰晶核和带有9个负电荷氨基酸融合蛋白基因INaK-9NCAs-EGFP,再通过设计引物V-INaK-9NCAs-EGFP-F、V-INaK-9NCAs-EGFP-R(以pRB1K-INaK-45NCAs-EGFP质粒为模板)扩增出同源片段的骨架V-INaK-9NCAs-EGFP,将片段和骨架片段混合,通过GibsonAssembly技术,得到pRB1K-INaK-9NCAs-EGFP质粒。所有引物见表2。

表2 引物序列
1.2.2融合蛋白的表达 将重组质粒pRB1K-INaA-EGFP、pRB1K-INaA-9NCAs-EGFP、pRB1K-INaA-45NCAs-EGFP、pRB1K-INaK-EGFP、pRB1K-INaK-9NCAs-EGFP和pRB1K-INaK-45NCAs-EGFP转化到大肠杆菌E.coliTOP 10感受态中。将片段与骨架按照3∶1的比例加入PCR管中,加入6 μL的GibsonAssembly连接酶(总共10 μL),50℃孵育1 h。然后将连接产物加入到大肠杆菌化学感受态细胞中,混匀,冰上放置30 min。在42℃水浴锅中热击90 s,放置于冰上 2 min后,加入650 μL的LB,在37℃、150 r·min-1的摇床中震荡1 h复苏。4 000 r·min-1,离心4 min,留上清100 μL,轻轻吹打混匀,最后将菌液均匀地涂抹在含有卡那青霉素的固体LB平板上,在37℃培养箱过夜培养。待第2 d挑长出的单菌落做PCR验证,将验证成功的菌株抽提质粒测序验证。验证成功后将含有pRB1K-INaA-EGFP、pRB1K-INaA-9NCAs-EGFP、pRB1K-INaA-45NCAs-EGFP、pRB1K-INaK-EGFP、pRB1K-INaK-9NCAs-EGFP和pRB1K-INaK-45NCAs-EGFP质粒的E.coliTOP10菌株首先划线培养在含有卡那青霉素抗性和20%阿拉伯糖的LB固体培养基上,37℃培养12~15 h,第2 d挑取单菌落加去离子水稀释,并均匀涂在载玻片上,放置烘箱烘干后用荧光显微镜观察细胞,以大肠杆菌E.coliTOP10菌株作为阴性对照,确认融合蛋白是否表达。
1.2.3生物炭的改性 取出BC各10 g,分装于1 L的烧杯中,加入500 mL盐酸(1 mol·L-1)浸泡24 h,然后将BC过滤、清洗并在烘箱中过夜干燥。将盐酸处理过的BC分别浸泡在1 mol·L-1FeCl3、2 mol·L-1FeCl3溶液(固液比为1∶10)中并放入超声波清洗机中,在30℃下分别进行1 h。最后,将BC用去离子水清洗至pH值不变,过滤并在烘箱中过夜干燥。改性生物炭的粒径分布在50目范围内。将BC用去离子水溶解,浓度为0.5、1、1.5、2 mg·L-1,改性完的BC按照FeCl3浓度标记为BC1和BC2,采用英国马尔文NANO ZS-ZEN3600 Zeta电位仪测定不同浓度下BC、BC1和BC2表面电性。
1.2.4吸附试验 将构建好的菌株以1‰的接种量接种于含有Kan抗生素的LB液体培养基中,37℃、220 r·min-1培养1.5 h,其间每隔0.5 h测1次600 nm处的吸光值,待OD600达到0.5~0.6时,加入20%的阿拉伯糖2%,过夜培养。待第2 d再次测定600 nm处的吸光值,并收集菌体,用85%的生理食盐水调整OD至1,取10 mL的菌液,并加入终浓度为2 mg·mL-1的生物炭,150 r·min-1震荡24 h后用滤纸过滤除去未吸附的细胞。滤液测定600 nm处的吸光值,并用以下公式计算固定化率:

式中:OD0为吸附前用生理食盐水调整OD至1;OD1为滤纸过滤除去未吸附的细胞,滤液测定600 nm处的吸光值。
1.2.5全细胞催化 全细胞催化:将含有pTrc99a-iaam-tac-ami1质粒的MG1655菌株制作成感受态,将质粒pEPA01、pEPA02、pEPA03、导入制作好的感受态中,待第2 d挑长出的单菌落做PCR验证,将验证成功的菌株抽提质粒测序验证。将验证成功的菌株从-80℃冰箱中取出,用枪头沾取菌液,在含有氨苄青霉素和卡那青霉素的固体LB平板上画线,37℃过夜培养。挑取大小适中的单菌落接入含有氨苄青霉素和卡那青霉素的试管液体LB中,在37℃、220 r·min-1过夜摇床震荡培养。以1%的接种量接入50 mL LB 中,加入氨苄抗性和卡那抗性,37℃、220 r·min-1恒温震荡培养。当OD600=0.5~0.6时,加入IPTG( 异丙基-β-D-硫代半乳糖苷)诱导表达,终浓度为0.5 mg·L-1,并加入2 mg·mL-1的生物炭,然后放至30℃、220 r·min-1的恒温振荡器培养 15~20 h。用孔径为20 μm的快速定性滤纸将菌液过滤,双蒸水洗涤3次后过滤,除去未吸附的细胞,并将固定在生物炭的细胞用50 mL的缓冲液(Tris/HCL,pH=7.5)转移到250 mL的三角瓶中,加入2 g·L-1的色氨酸,在 30℃、220 r·min-1摇床反应,间隔12 h取样检测IAA 产量。
1.2.6摇瓶重复分批发酵 每批发酵结束后,5 000 r·min-1离心5 min,弃去上清液,沉淀用50 mL的Tris-HCL缓冲液重悬,转移到三角瓶中并加入2 g·L-1的色氨酸后30℃、220 r·min-1继续发酵,间隔12 h,取样检测IAA 产量,重复10次。
1.2.7HPLC检测IAA产量 Waters e2695高效液相色谱系统,配置Waters2998紫外检测器,色谱柱为月旭科技的XB-C18反向液相色谱柱。采用梯度洗脱分离样品,流速1 mL·min-1,检测波长为270 nm,柱温40℃,运行时间为23 min,流动性为由蒸馏水(0.1%甲酸)(溶剂B)和甲醇(溶剂D)组成。
2 结果与分析
2.1 荧光显微镜结果
融合蛋白的N端带有EGFP标签,本试验中用20%的阿拉伯糖诱导融合蛋白的表达,取诱导12~15 h的重组菌处理后在荧光显微镜下观察,锚定蛋白为INaA的菌株EPA01-1、EPA01-2、EPA01-3成功将融合蛋锚定在细胞膜上,发出绿色荧光;锚定蛋白为INaK的菌株未能将融合蛋白锚定在细胞膜上(图1)。

注:AE.coli TOP10(对照);B EPA01-3;C EPA01-2;D EPA01-3
2.2 Zeta电位仪分析改性生物炭电性结果
本研究中生物炭先用1 mol·L-1的盐酸处理后,再用1 mol·L-1FeCl3、2 mol·L-1FeCl3改性,用去离子水清洗至pH稳定后用Zeta电位仪测定不同浓度下的生物炭电性。由图2可知,未改性生物炭呈负电性,1 mol·L-1的FeCl3改性后的生物炭在2 mg·mL-1的浓度下Zeta电位为3.14 mV,2 mol·mL-1的FeCl3改性后的生物炭在1.5、2 mg·mL-1的浓度下Zeta电位分别为0.84、8.33 mV,说明在此浓度下生物炭表面呈电正性(图2)。
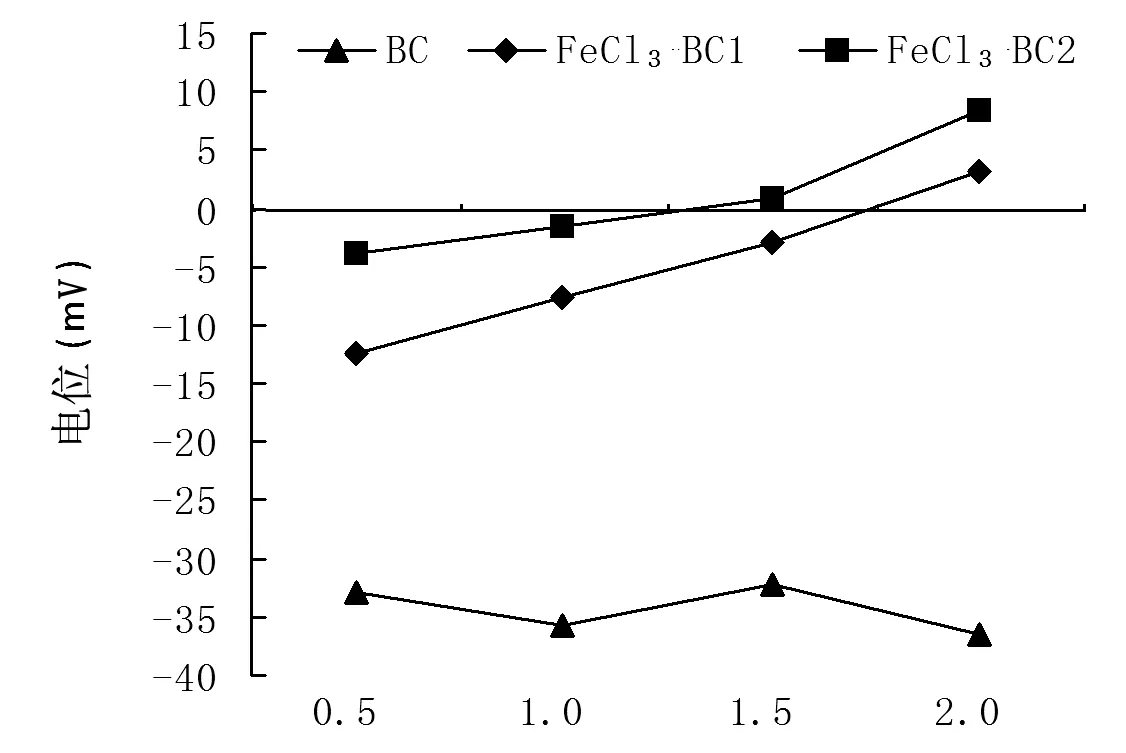
注:BR-1 1 mol·L-1 FeCl3改性生物炭;BR-2 2 mol·L-1 FeCl3改性生物炭
2.3 不同菌株吸附率测定结果
由上述结果得知,2 mol·L-1FeCl3改性的生物炭在2 mg·mL-1的浓度下表面正电荷较多,与重组菌株进行吸附。由图3可知,吸附率EPA03(59.45%)>EPA02(50.1%)>EPA01(48.25%)>EMP09(27.6%),且重组菌株融合蛋白中表面携带负电荷氨基酸数量EPA03>EPA02>EPA01>EMP09。
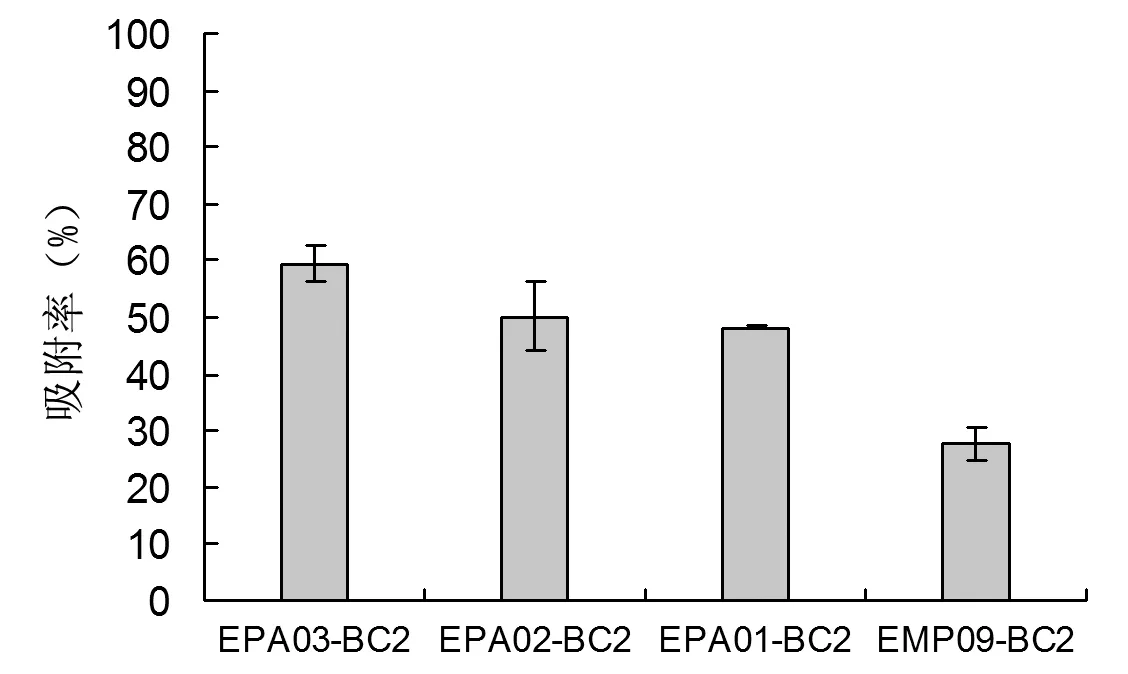
注:EM09-BC2为空白对照
2.4 全细胞催化吲哚-3-乙酸和色氨酸HPLC检测结果
由图4可知,在以色氨酸为底物全细胞催化条件下,用改性生物炭吸附重组菌株,菌株EPA02、EPA01负载生物炭全细胞催化连续循环2次,第1次循环IAA产量在60 h达到最大,分别为1.256 g·L-1和1.29 g·L-1;第2次循环IAA产量在60 h达到最大,分别为0.289 g·L-1和0.369 g·L-1;第3次循环IAA产量在60 h达到最大,分别为0.037 g·L-1和0.069 g·L-1,几乎不产IAA。菌株EMP09负载生物炭和菌株EMP09游离细胞全细胞催化连续循环3次,第1次发酵IAA产量在60 h达到最大,分别为1.239 g·L-1和1.333 g·L-1;第2次IAA产量 在60 h达到最大,分别为0.854 g·L-1和1.049g·L-1;第3次IAA产量在60 h达到最大,分别为0.284 g· L-1和0.295 g· L-1,第4次IAA产量在60 h达到最大,分别为0.073 g· L-1和0.05 g· L-1,几乎不产IAA。菌株EPA03负载改性生物炭全细胞催化连续循环6次,第1次循环IAA产量在60 h达到最大,为0.39 g· L-1;第2次循环IAA产量在60 h达到最大,为0.542 g·L-1;第3次循环IAA产量在60 h达到最大,为0.971 g·L-1;第4次循环IAA产量在60 h达到最大,为0.812 g·L-1;第5次循环IAA产量在168 h达到最大,为0.782 g·L-1,第6次循环IAA产量在168 h达到最大,为0.617 g·L-1。菌株EPA03和空白对照组菌株EMP09游离细胞相比连续循环周期较长,IAA总产率最高。
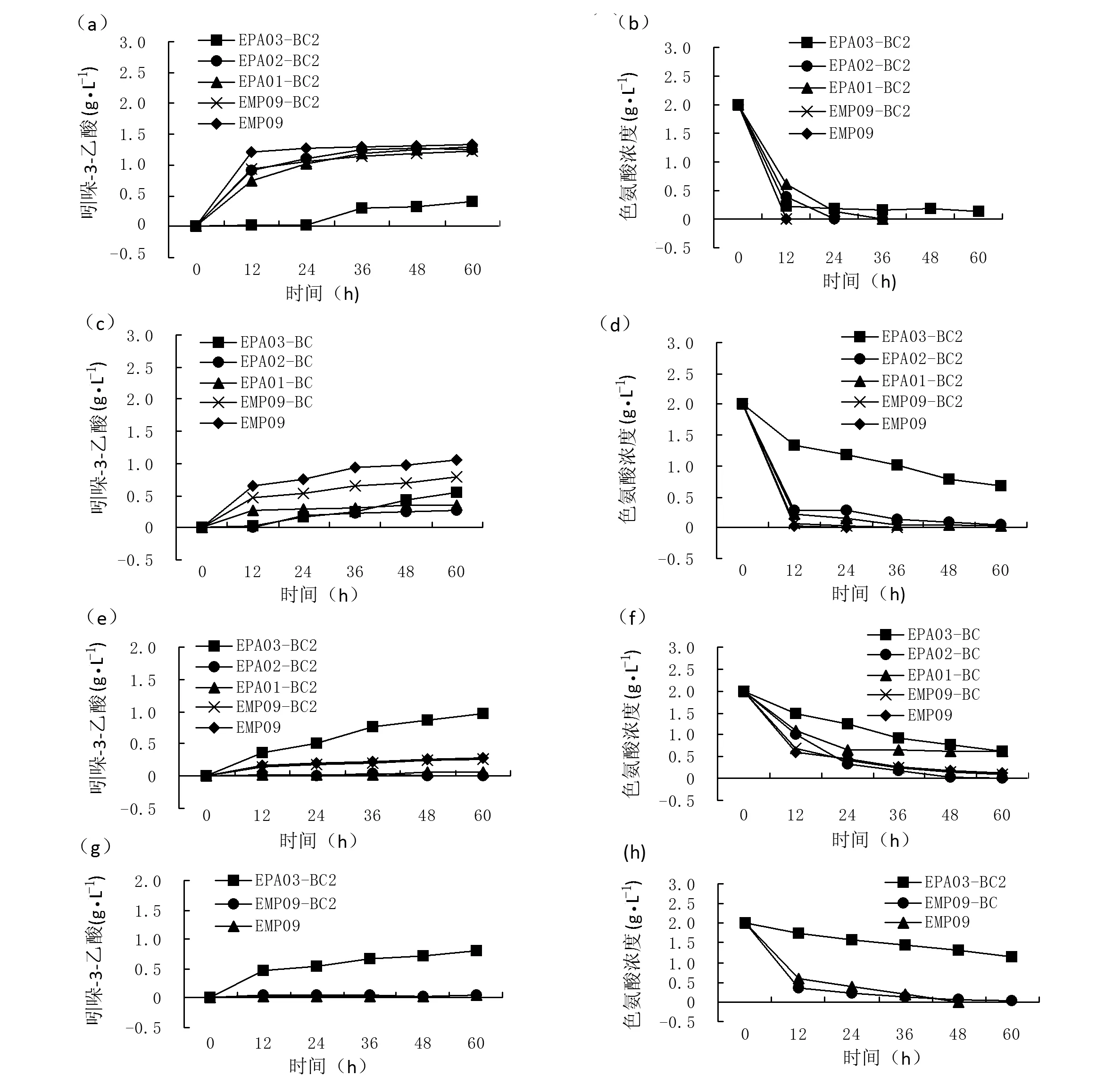
注:菌株EMP09和EMP09-BC2为空白对照:(a)第1次循环IAA产量;(b)第1次循环色氨酸消耗量;(c)第2次循环IAA产量;(d)第2次循环色氨酸消耗量;(e)第3次循环IAA产量;(f)第3次循环色氨酸消耗量;(g)第4次循环IAA产量;(h)第4次循环色氨酸消耗量;(i)第5次循环IAA产量;(j)第5次循环色氨酸消耗量;(k)第6次循环IAA产量;(l)第6次循环色氨酸消耗量
3 结论与讨论
固定化细胞技术是指固定在水不溶性载体上,在一定空间范围进行生命活动的细胞。固定化细胞技术在过去30年发展迅速[18],在环境治理领域、食品发酵领域、能源开发领域、药物制备中得到广泛的应用,但同时许多固定化细胞载体对细胞有一定的毒性,价格昂贵。生物炭具有较大的孔隙结构,含碳量较为丰富,价格廉价,对细胞没有损伤,并且生物炭是从一些废弃生物质如玉米、小麦秸秆热解而来,较为环保,可使废弃生物质循环利用。目前报道过的生物炭作为载体吸附细胞,大多是利用生物炭多孔的特点,将细胞吸附在孔隙结构中,然而这种吸附方式过程中往往存在载体与细胞之间结合率降低等局限性。
据Wee等[14]研究,来源于欧文凤梨欧氏杆菌Erwiniaananas的冰晶核蛋白INaA成功将木聚糖酶展示细胞表面,相较于其他两种冰晶核蛋白INaK和INaZ全细胞木聚糖酶的活性更高。本研究中利用细菌表面展示技术,以INaA、INaK结构域为锚定基序,绿色荧光蛋白(EGFP)为报告蛋白,构建了表面展示系统pRB1K-INaA-EGFP,pRB1K-INaK-EGFP,通过荧光显微镜结果显示,锚定蛋白为INaA的菌株EPA01、EPA02、EPA03成功将带有负电荷氨基酸(天冬氨酸、谷氨酸)融合蛋白锚定在细胞膜上,以此来增加细胞表面的负电荷。
据Yao等[9]的报道,大多数未改性的生物炭表面呈负电性,本试验中使用FeCl3改性生物炭[19],将生物炭从负电性改性为正电性,改性的生物炭固定化重组菌株,菌株EPA03吸附率与对照EMP09相比提高了31.85%,菌株EPA02提高了22.5%,菌株EPA01提高了20.65%。
吲哚-3-乙酸(IAA)是生长素中最常见的激素,它调节植物生长的各个方面,将含有表面展示系统的质粒导入本实验室开发的IAA高产菌株,以色氨酸为底物,全细胞催化连续生产IAA循环中,菌株EPA03具有巨大潜力,能连续循环6次,IAA产量还能达到0.617 g·L-1,相比于对照菌株EMP09游离细胞和生物炭固定化细胞生命周期有所提高。菌株EPA03融合蛋白中表达了较多的负电荷氨基酸,使其细胞膜表面有较多的负电荷,将带正电荷的生物炭吸附时,由于静电引力,彼此之间结合的较为牢固,生物炭能为细菌提供一个稳定的发酵微环境,使固定化细胞能较好地生长和代谢,在全细胞催化连续生产IAA中能够维持更长的生长周期和活性,使菌株一直持续不断产IAA。
