晚期非小细胞肺癌患者外周血程序性死亡受体1和程序性死亡受体配体1的表达及临床意义*
2022-11-15戴凡罗文夏航彪邓燕肖情邱容
戴凡,罗文,夏航彪,邓燕,肖情,邱容
629000四川 遂宁,遂宁市中心医院/重庆医科大学附属遂宁市中心医院/川北医学院附属遂宁医院 呼吸与重症医学科
肺癌是中国及全球范围内死亡率最高的恶性肿瘤[1-2],按照病理类型可以分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC约占85%[3]。有约80%的NSCLC患者在确诊时已处于中晚期,其5年生存率仅17.4%[4],原因之一为NSCLC细胞可以通过不同机制逃脱机体的免疫监控,使机体不能产生或不能及时产生抗肿瘤的免疫应答[5]。近年来,肿瘤免疫治疗已逐渐成为包括肺癌在内的多种恶性肿瘤的重要治疗手段之一[6],其中免疫检查点程序性死亡受体1(programmed death 1,PD-1)和及其配体1(programmed death-ligand 1,PD-L1)受到了很大的关注[7]。PD-L1与PD-1结合可抑制T淋巴细胞的增殖,参与肿瘤免疫逃逸、促进肿瘤生长与侵袭[8]。因此,PD-1/PD-L1表达水平作为肿瘤监测及免疫治疗效果的生物标志物的相关研究备受关注。本研究采用流式细胞学技术检测NSCLC患者外周血T细胞亚群和单核细胞表面的PD-1和PD-L1表达水平,并探讨其临床意义,为寻找PD-1/PD-L1抑制剂的有效预测生物标志物提供参考。
1 对象与方法
1.1 研究对象
连续收集2020年1月至2021年2月遂宁市中心医院呼吸与重症医学科二病区收治的符合入排标准的晚期NSCLC患者作为肺癌组。纳入标准:1)经病理学和(或)细胞学检查确诊为NSCLC;2)依据国际肺癌TNM分期标准(第7版)分期为ⅢB~Ⅳ期;3)年龄>18岁,首次治疗患者;4)患者对研究知情同意。排除标准:1)有肿瘤疾病史或罹患其他恶性肿瘤;2)临床信息不完整。共纳入56例NSCLC患者,其中,男性38例(67.86%)、女性18例(32.14%);年龄48~79岁,平均年龄(61.86±7.11)岁;ⅢB期10例(17.86%)、Ⅳ期46例(82.14%);肺腺癌18例(32.14%)、肺鳞癌36例(64.29%)、肺腺鳞癌2例(3.57%)。
按照1∶2的比例选择科室同期收治的性别(同性别)、年龄(±3岁)相匹配的普通肺部疾病患者为作为对照组,排除肺癌及其他恶性肿瘤疾病史。共纳入112例普通肺部疾病患者,男性76例(67.86%)、女性36例(32.14%);年龄46~77岁,平均年龄(60.12±8.23)岁;疾病类型:慢阻肺48例(42.86%)、支气管扩张27例(24.11%)、社区获得性肺炎26例(23.21%)、哮喘11例(9.82%)。两组患者性别、年龄差异无统计学意义(P>0.05),基线资料具有可比性。
1.2 研究方法
1.2.1 外周血PD-1/PD-L1表达水平检测
1.2.1.1 外周血单核细胞(peripheral blood mononuclear cells,PBMC)制备 分别抽取两组患者新鲜外周血5 mL送至检验科备用,在15 mL容量的离心管中加入5 mL外周血淋巴细胞分离液(上海索宝生物科技公司生产),再将经肝素抗凝的5 mL外周血缓慢加入离心管中,使用低速离心机(美国Thermo公司)在室温环境下离心20 min,转速为1 500 r/min,吸出单核细胞层将其移至新的离心管备用,即为PBMC。
1.2.1.2 流式细胞学检测 取3支流式细胞仪试管分别标记为CD4/PD-1、CD8/PD-1和CD14/PD-L1,加入2 mL磷酸盐缓冲溶液(phosphate buffer solution, PBS)清洗制备待用的PBMC细胞3次,细胞密度保持在1×106个/mL。在3支试管中分别加入CD4-FITC/PD-1-PE、CD8-FITC/PD-1-PE和CD14-FITC/PD-L1-PE(美国Biolegend公司),室温环境下避光反应20 min,加入200 μL红细胞裂解液(美国Beckman-Couter公司)和2 mL的PBS,转速1 500 r/min,离心5 min,后弃上清液,加入2 mL的PBS,通过流式细胞仪(美国Beckman-Couter)检测CD4+T细胞PD-1、CD8+T细胞PD-1和CD14+单核细胞PD-L1的表达率。
1.2.2 疗效评价及亚组分析
采用实体肿瘤疗效评价(RECIST 1.1)标准对肺癌组中完成2~4个周期化疗患者进行疗效评价,其中,部分缓解(partial response, PR):治疗后靶病灶的总直径相比基线水平减少>30%;疾病进展(progressive disease, PD):治疗后靶病灶的总直径相比总直径最小测量值增加>20%,且靶病灶的总直径的绝对值增加>5 mm或出现一个及以上新病灶。比较PR组(n=10)和PD组(n=12)治疗前后外周血PD-1和PD-L1表达水平的差异。
1.3 统计学方法
采用SPSS 22.0进行统计学分析,对服从正态分布或近似服从正态分布的计量资料采用均数±标准差表示,组间比较采用t检验;计数资料采用率/百分比/构成比[n(%)]表示,组间比较采用χ2检验。以P<0.05作为差异有统计学意义。
2 结 果
2.1 两组患者外周血CD4+T细胞、CD8+T细胞PD-1表达率
NSCLC组患者外周血CD4+T细胞、CD8+T细胞PD-1表达率均明显高于对照组,差异有统计学意义(均P<0.05,表1)。

表1 两组患者外周血CD4+T、CD8+T细胞PD-1表达率及CD14+单核细胞PD-L1表达率
2.2 两组患者外周血CD14+单核细胞PD-L1表达率
NSCLC组患者外周血CD14+单核细胞表面PD-L1表达率明显高于对照组,差异有统计学意义(P<0.05,表1)。
2.3 不同疗效肺癌患者治疗前后外周血CD4+T细胞、CD8+T细胞PD-1表达率
组间比较:治疗前不同疗效两组患者的外周血CD4+T细胞、CD8+T细胞PD-1表达率之间差异均无统计学意义(均P>0.05);而治疗后PD疗效组NSCLC患者的CD4+T细胞、CD8+T细胞PD-1表达率均明显高于PR疗效组,差异均有统计学意义(均P<0.05)。
组内比较:PR疗效组中,治疗后NSCLC患者的外周血CD4+T细胞、CD8+T细胞PD-1表达率均低于治疗前基线水平,差异有统计学意义(P<0.05);PD疗效组中,治疗后NSCLC患者的外周血CD4+T细胞、CD8+T细胞PD-1表达率均明显高于治疗前基线水平,差异有统计学意义(P<0.05,表2)。
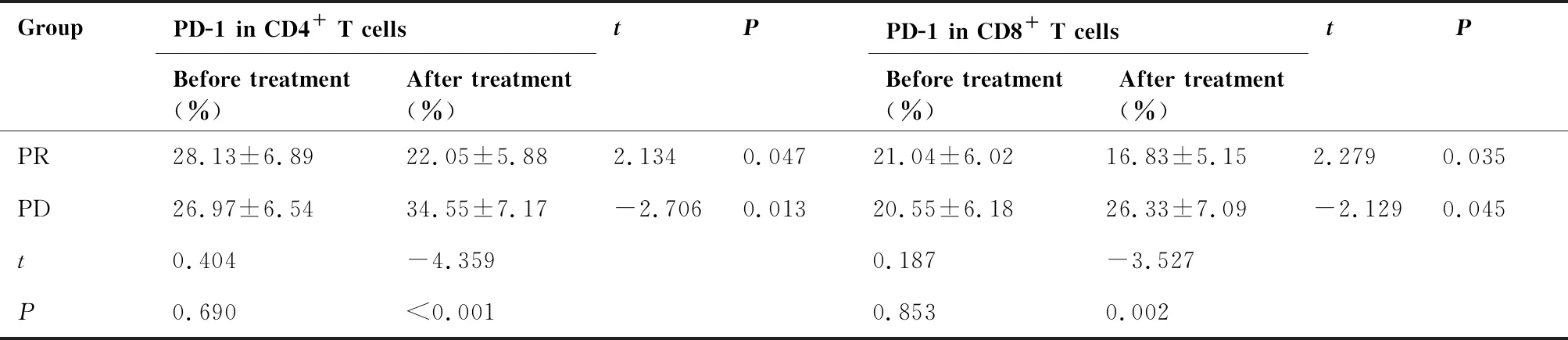
表2 不同疗效肺癌患者治疗前后外周血CD4+T、CD8+T细胞PD-1表达率
2.4 不同疗效肺癌患者治疗前后外周血CD14+单核细胞PD-L1表达率
组间比较:治疗前不同疗效两组患者的外周血CD14+单核细胞PD-L1表达率之间差异无统计学意义(P>0.05);而治疗后PD疗效组NSCLC患者的CD14+单核细胞PD-L1表达率明显高于PR疗效组,差异有统计学意义(P<0.05)。
组内比较:PR疗效组中,治疗后NSCLC患者的外周血CD14+单核细胞PD-L1表达率低于治疗前基线水平,差异有统计学意义(P<0.05);PD疗效组中,治疗后NSCLC患者的外周血CD14+单核细胞PD-L1表达率明显高于治疗前基线水平,差异有统计学意义(P<0.05,表3)。

表3 不同疗效肺癌患者治疗前后外周血CD14+单核细胞PD-L1表达率
3 讨 论
目前肿瘤免疫疗法是近几年肿瘤治疗领域研究的热点,其中PD-1/PD-L1检查点抑制剂被认为是最有前景的治疗方式[9],且在肺癌患者的治疗中取得了令人瞩目的成效[10]。PD-1在活化T细胞、NK细胞及B细胞中大量表达,而PD-L1则在各种免疫细胞如单核细胞、肿瘤细胞中大量表达。肿瘤细胞可以通过高表达的PD-L1与T细胞表面PD-1结合后,抑制T淋巴细胞免疫功能,诱导肿瘤抗原特异性T细胞程序性死亡,从而实现肿瘤细胞的免疫逃逸[11]。有研究显示[12],PD-1/PD-L1抑制剂能显著延长晚期NSCLC患者的总生存时间和无进展生存时间。美国食药监局已经批准了帕博利珠单抗、阿替利珠单抗等多种抗PD-1/PD-L1单克隆抗体在晚期NSCLC患者中的应用,FDA还批准了多种商业化的PD-L1检测试剂盒用于临床检测[13]。在中国,PD-1/PD-L1抑制剂及PD-L1检测试剂盒已逐步上市,并应用于NSCLC的治疗和诊断[14]。
本研究中采用流式细胞学检查方法,检测外周血CD4+T细胞、CD8+T细胞表面PD-1分子及CD14+单核细胞表面PD-L1分子的表达率,结果证实晚期NSCLC患者外周血CD4+T细胞、CD8+T细胞表面PD-1分子表达百分率相较于呼吸内科收治的肺部普通疾病患者群体明显升高,同时在晚期NSCLC患者的外周血CD14+单核细胞表面同样存在PD-L1分子的高表达。据此推测位于CD14+单核细胞表面高表达的PD-L1分子也可以通过与T细胞表面的PD-1分子相互作用,抑制T细胞的活化功能,甚至导致细胞凋亡,进而抑制了CD4+T细胞和CD8+T细胞的免疫功能,最终导致NSCLC肿瘤细胞免疫逃逸的发生[15-16]。
与此同时,本研究还对完成单纯采用三代含铂方案的全身化疗治疗2~4周期后患者的PD-1/PD-L1表达水平进行随访,按照实体肿瘤疗效评价(RECIST 1.1)标准,选择治疗后PR和PD患者进行亚组分析,结果发现,临床疗效为PR的NSCLC患者治疗后其外周血CD4+T细胞、CD8+T细胞PD-1表达率及CD14+单核细胞PD-L1表达率均较治疗前的基线水平明显下降;与此相反,PD组患者的PD-1、PD-L1表达水平均较治疗前基线水平进一步上升[17]。这与国内学者邢玉斐等[18]报道的晚期NSCLC患者PBMC表面PD-L1分子表达率的强弱决定了PD-L1分子与T细胞相互作用过程中所发挥的抑制T细胞增殖作用具有一致性。
综上所述,晚期NSCLC患者外周血T细胞和单核细胞存在PD-1和PD-L1表达的异常上调,提示可通过检测免疫细胞表面PD-1/PD-L1的表达水平来判断疾病严重程度和作为预后的辅助生物学预测指标,但由于本研究样本量较小、也并未做不同临床病理特征之间的比较,因此研究结论还需要更多的前瞻性、大样本研究进一步探讨。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
