IL-6致非小细胞肺癌PD-1抑制剂治疗抵抗的效应和机制研究*
2022-11-15张衡卢从华赵茜罗诺李鑫王任源赵呈龙王治国祝梦晓封明霞何勇李力
张衡,卢从华,赵茜,罗诺,李鑫,王任源,赵呈龙,王治国,祝梦晓,封明霞,何勇,李力
400042 重庆,陆军军医大学附属陆军特色医学中心 呼吸与危重症医学科
肺癌的发病率和死亡率均位居我国恶性肿瘤首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的85%[1-2]。大多数NSCLC患者在确诊时已处于晚期阶段,丧失手术机会[3]。近年来,分子靶向治疗和免疫治疗显著改善了NSCLC患者的预后[4]。对于驱动基因阴性的晚期NSCLC患者,以程序性细胞死亡蛋白1(programmed cell death protein-1,PD-1)/程序性死亡配体1(programmed cell death ligand-1,PD-L1)抑制剂为代表的免疫治疗显著改善了患者生存,已成为一线标准治疗方案[5]。然而,并非所有NSCLC患者都能对PD-1/PD-L1抑制剂治疗产生良好应答,甚至可能出现严重的不良反应。所以,发现PD-1/PD-L1抑制剂疗效预测因子,阐明其治疗抵抗机制,对于扩大免疫治疗获益人群、增强免疫治疗疗效至关重要[6]。
目前,肿瘤细胞PD-L1表达已被广泛用于预测PD-1/PD-L1抑制剂治疗的疗效。对于PD-L1表达强阳性(≥50%)的患者,可一线单药免疫治疗[7]。除此之外,肿瘤突变负荷(tumor mutation burden,TMB)、微卫星不稳定(microsatellite instability,MSI)对免疫治疗疗效也有一定的预测作用[8]。近年来研究发现,肿瘤免疫微环境(tumor immune microenvironment,TIME)在肿瘤生长和转移的调控中起着重要作用。TIME包括各种微环境中的免疫细胞(髓样细胞、淋巴细胞、抗原呈递细胞等)以及细胞因子、趋化因子和生长因子等可溶性免疫因子[9]。细胞因子在募集免疫细胞到肿瘤微环境过程中起重要调节作用[10],其中白细胞介素-6(interleukin 6,IL-6)是TIME中重要的细胞因子,可激活肿瘤细胞和肿瘤浸润免疫细胞中的JAK/STAT3信号,促进免疫抑制性微环境形成并导致肿瘤细胞增殖、存活、侵袭和转移,抑制抗肿瘤免疫反应[11-12]。近期研究报道,IL-6可能为PD-1抑制剂治疗黑色素瘤的疗效预测标志物[13],但其在NSCLC免疫治疗中的作用和机制尚未完全阐明。
因此,本回顾性研究拟探索IL-6与NSCLC患者PD-1抑制剂疗效的相关性,同时通过一系列相关体外研究,初步探讨IL-6导致PD-1抑制剂抵抗的作用机制。
1 资料与方法
1.1 研究设计和对象
筛选2017年1月1日至2021年10月31日期间,在陆军特色医学中心(即大坪医院)确诊为NSCLC且接受PD-1抑制剂治疗的患者,纳入标准如下:1)病理证实为Ⅲ/Ⅳ期NSCLC患者,无法接受手术;2)接受PD-1抑制剂单药或联合治疗,治疗线数不限,治疗周期≥2个;3)免疫治疗前1周之内检测外周血IL-6;4)随访时间≥6个月。主要排除标准:1)基线合并细菌感染;2)6个月之内失访;3)资料不全,无法评估疗效。IL-6的数据自病历系统采集,IL-6检测由本中心检验科使用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)完成。本研究经陆军特色医学中心伦理委员会审查并批准(编号:2022132)。数据随访截止日期为2022年4月12日。
1.2 疗效评估
依据实体瘤疗效评价标准1.1版(RECIST 1.1),每位患者的短期疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)或疾病进展(progressive disease,PD)。无进展生存期 (progression-free survival,PFS)被定义为从开始治疗到临床医生评估影像学进展、死亡或末次随访的时间。总生存期 (overall survival,OS)被定义为第一次接受治疗的日期至因任何原因死亡的日期,或最后一次随访的日期。持续临床获益(durable clinical benefit,DCB)定义为CR、PR或SD≥6个月,无持续获益(non-durable clinical benefit,NDB)定义为SD<6个月或PD[14]。客观缓解率(objective response rate,ORR)定义为完全缓解加上部分缓解之和(CR+PR)占总研究人群的比例。
1.3 细胞培养和试剂
人肺癌细胞系H1299和A549细胞购自美国模式培养物集存库(American Type Culture Collection,ATCC)。人外周血T细胞自上海赛笠生物科技有限公司(中国上海)采购。肿瘤细胞均采用含10%胎牛血清和1%青霉素/链霉素的RPMI-1640(Hyclone)培养基,在37℃及5% CO2细胞培养箱中培养。重组人IL-6蛋白和白细胞介素2(interleukin 2,IL-2)蛋白均购自PeproTech(美国新泽西州),抗STING、TBK1、p-TBK1、STAT3、p-STAT3、AKT、p-AKT和β-tubulin均从Cell Signaling Technology(美国马萨诸塞州)采购。
1.4 T细胞介导的肿瘤细胞杀伤试验
活化T细胞步骤参考先前研究[15],简述如下:人外周血T细胞通过在含有IL-2(10 ng/mL)和ImmunoCult human CD3/CD28/CD2 T细胞激活剂(25 μL/mL)的ImmunoCult-XF T细胞扩增培养基(均购自STEMCELL Technologies,加拿大温哥华)中培养1周而活化。所有T细胞介导的肿瘤细胞杀伤试验都在含有抗CD3抗体(100 ng/mL;Thermo Fisher Scientific,美国马萨诸塞州)和IL-2(10 ng/mL)的DMEM/F12培养基中进行。
1.5 CCK-8检测细胞存活率
细胞存活率通过细胞计数试剂盒(CCK-8;MedChemExpress,美国新泽西州)检测。将长势良好且处于对数期的各肺癌细胞株接种于96孔板内,接种量为每孔3 000个细胞,设置3个复孔,按每孔100 μL加入RPMI-1640完全培养基培养过夜。第二天,以不进行任何处理的细胞为对照组,以含T细胞及T细胞和IL-6处理的细胞为实验组,更新DMEM/F12培养基并再培养48 h。然后更新培养基,每孔加入10 μL的CCK-8溶液,设置只有培养基和CCK-8溶液的孔作为调零孔。轻轻摇晃混匀后放入培养箱中继续培养2 h,酶标仪检测450 nm下吸光度值并进行记录。
1.6 Ki67染色
细胞增殖通过Ki67标记(Boster,中国武汉) 检测。取长势良好的细胞经胰蛋白酶消化并计数。在6孔板中放入无菌盖玻片,于盖玻片上滴加细胞悬液,每孔接种细胞数30万,每孔加入RPMI-1640完全培养基2 mL培养过夜。待细胞贴壁,于次日按细胞存活率测定方案分对照组、T细胞处理组及T细胞和IL-6处理组,更换培养基继续培养48 h。于显微镜下初步观察,去除培养基,磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗3次后用4%多聚甲醛固定20 min。再次用PBS清洗3遍,每次2~3 min,然后加入0.25% TritonX-100透化处理20 min。PBS洗3次后用10%山羊血清封闭1 h,然后加一抗Ki67(1∶100稀释)于4℃孵育过夜。经PBS 3次清洗后加荧光二抗CY3(1∶100稀释)及4’,6-二脒基-2-苯基吲哚(DAPI,1∶500)孵育1 h。最后经PBS清洗后在荧光显微镜下观察。
1.7 蛋白质印迹(Western Blot)
蛋白质印迹步骤参考先前研究[16]。细胞接种于6孔板,根据实验分组处理48 h,置于显微镜下观察后去除培养基,用PBS清洗3次,于冰上操作,加入RIPA 裂解液(添加了1%蛋白酶和磷酸酶抑制剂)裂解30 min。经震荡超声充分裂解后于4 ℃下12 000 g离心20 min,取上清液,采用BCA法测定蛋白浓度。按说明分别配制分离胶和浓缩胶,待胶体凝固,根据测定的蛋白浓度确定上样量,配制上样体系。将样品于100 ℃热变性5 min,110 V电泳90 min。然后以90 V电转80 min将蛋白移至PVDF膜上。之后,在室温下用TBST配置的5%脱脂牛奶封闭1 h。根据目标蛋白相对分子质量切膜并与相应抗体(1∶1 000)在4 ℃下孵育过夜。然后用TBST洗膜3次,每次5 min,分别加辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000)室温孵育1 h。最后,经TBST洗膜3次,每次5 min后,用ChemiDoc Touch凝胶成像系统对膜进行显影。
1.8 统计学方法
计量资料首先采用Shapiro-Wilk test进行正态性检验,符合正态分布的采用均数±标准差进行描述,组间比较采用独立样本t检验;非正态性分布数值描述采用中位数进行描述,组间比较采用Mann-Whitney U test。计数资料采用频数和百分比进行描述,组间比较采用卡方检验或Fisher′s精确检验。基线IL-6水平根据临床界值确定为高(≥7 pg/mL,n=20)或低(<7 pg/mL,n=10)两组, Kaplan-Meier分析两组PFS。三次独立实验数据以均数±标准差进行描述,组间比较采用独立样本t检验。所有统计分析均使用SPSS 26.0软件进行,以P<0.05为差异有统计学意义。
2 结 果
2.1 患者特征
本研究共筛选出160例确诊为晚期NSCLC且接受PD-1抑制剂治疗的患者。根据纳入及排除标准,130例被排除,剩余30例患者纳入研究。其中25例诊断为腺癌,5例诊断为鳞癌。共有22例的患者有吸烟史。28例的患者接受一线免疫治疗,25例的患者接受了免疫联合治疗。研究人群中位随访时间为12.0个月(IQR:9.0~17.3个月),中位PFS为11.0个月(IQR:7.0~15.3个月)。在随访期间,30名患者中有83.3% (n=25)通过PD-1抑制剂治疗达到DCB,16.7%(n=5)达到NDB。另外,6.7%(n=2)的患者达到CR,43.3%(n=13)的患者达到PR,23.3%(n=7)的患者达到SD,26.7%(n=8)的患者疗效为PD(表1)。
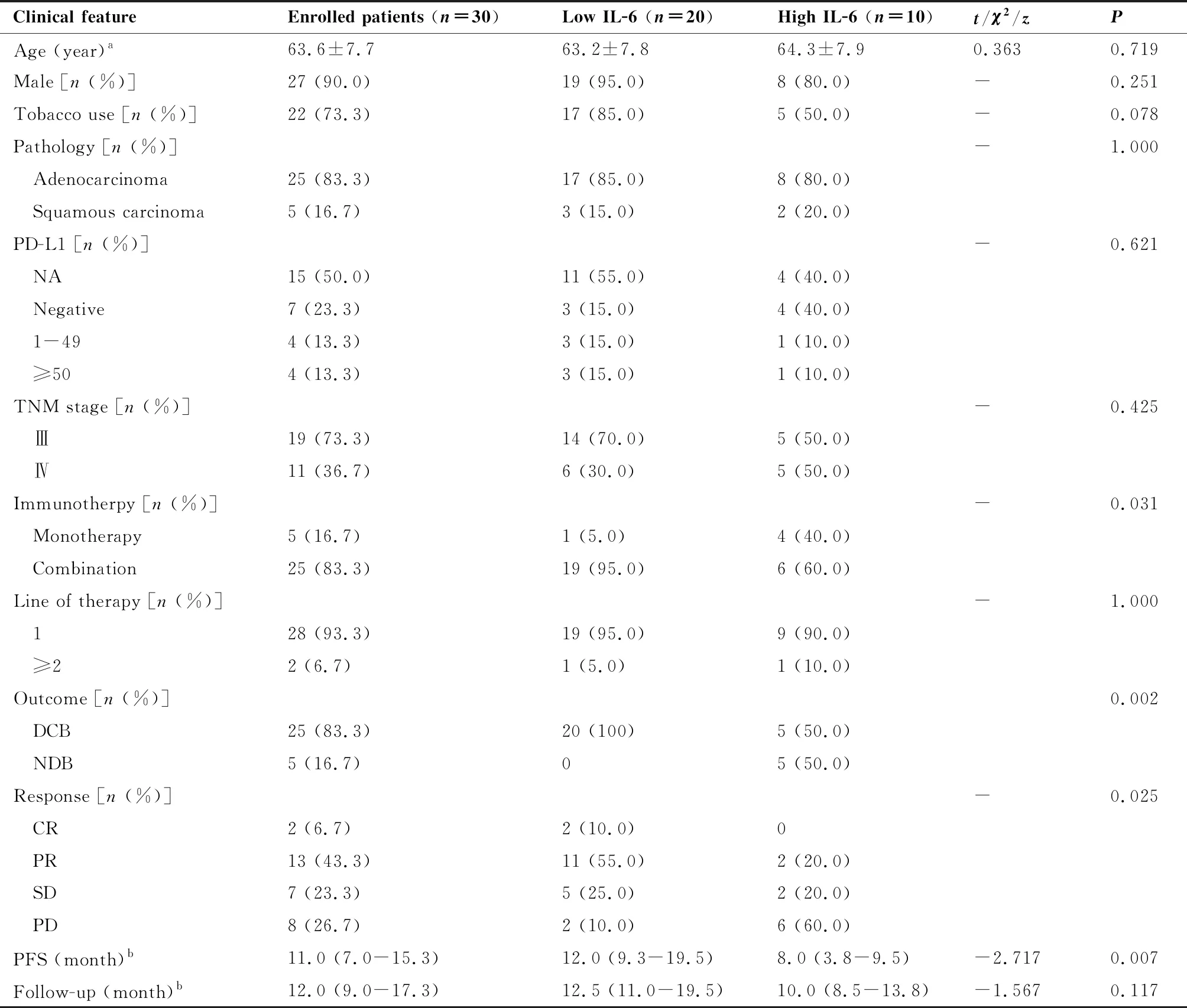
表1 入组患者的临床特征
2.2 基线外周血IL-6水平与NSCLC患者PD-1抑制剂治疗疗效负相关
为了探究基线外周血IL-6水平与NSCLC患者PD-1抑制剂治疗疗效的相关性,我们首先对比了DCB和NDB患者的基线外周血IL-6水平,结果显示DCB组IL-6水平显著低于NDB组(中位数4.60 pg/mLvs12.88 pg/mL,P=0.002)(图1A)。根据基线IL-6水平临床参考阈值分为高(≥7 pg/mL,n=20)或低(<7 pg/mL,n=10)两组。如图1B所示,低IL-6组的DCB率显著高于高IL-6组(100%vs50%,P=0.002)。另外,与高IL-6组相比,低IL-6组ORR更高(65%vs20%,P=0.025)。其中,高IL-6组60%的患者疗效为PD(图1C)。接下来,我们进一步分析了基线IL-6水平与PFS的相关性。结果显示,基线外周血IL-6水平高的患者的中位PFS为 8.00 个月(IQR:3.8~9.5个月),而基线外周血IL-6水平低的患者未达到(未达到vs8个月,P=0.007)(图1D)。

图1 IL-6与PD-1抑制剂疗效的相关性
2.3 IL-6减弱T细胞介导的对肺癌细胞H1299和A549细胞的杀伤作用
接下来,我们通过T细胞介导的肿瘤细胞杀伤试验观察IL-6对T细胞杀伤效应的影响。Ki67实验结果提示,与对照组相比,活化T细胞能显著降低Ki67阳性细胞的百分比,而外加IL-6后Ki67阳性细胞百分比显著增高,提示在IL-6存在的情况下,T细胞不能有效抑制H1299和A549肺癌细胞的增殖(图2A)。与之类似的是,CCK-8实验提示,活化的T细胞可显著降低H1299和A549肺癌细胞的存活率,而外加IL-6后,肿瘤细胞存活率显著升高,提示IL-6显著抑制活化T细胞对肿瘤细胞的杀伤(图2B)。这些结果表明IL-6 对T细胞介导的肿瘤细胞杀伤起抑制作用。

图2 IL-6抑制T细胞介导的对肺癌细胞的杀伤作用
2.4 IL-6活化STAT3-AKT并抑制STING-TBK1通路
为了初步阐明IL-6影响免疫治疗疗效的机制,我们采用Western blot检测了关键信号通路的活性。既往研究及我们近期的研究均提示,STING的活化在抗肿瘤免疫治疗中起关键作用[15,17]。Western blot结果显示,相较于单独T细胞处理,外加IL-6处理可显著上调p-STAT3和p-AKT的表达,同时降低了STING和p-TBK1的水平(图3)。以上结果提示,IL-6可能通过活化STAT3-AKT通路抑制STING表达并减弱TBK1的活化,进而引起免疫治疗抵抗。

图3 Western blot检测IL-6处理对H1299和A549细胞中STAT3/AKT和STING/TBK1通路的影响
3 讨 论
本研究发现,接受PD-1抑制剂治疗的晚期 NSCLC患者治疗前IL-6水平与治疗疗效相关。IL-6可能通过活化STAT3-AKT通路抑制STING表达并减弱TBK1的活化,进而抑制T细胞介导的肿瘤细胞杀伤作用,导致免疫治疗抵抗。
IL-6是一种促炎细胞因子,是癌症和多种炎症性疾病的核心参与者[18],已被证实可促进肿瘤细胞增殖和转移,调控肿瘤的发生、发展[19-21]。研究发现,在接受PD-1抑制剂治疗的黑色素瘤患者中,较高的IL-6水平与较短的OS有关[13]。另有研究表明在NSCLC接受PD-1抑剂制治疗过程中,IL-6水平下降与PFS较长有关[22]。本研究发现,接受PD-1抑制剂治疗的NSCLC患者治疗前低IL-6水平与临床获益相关,与既往研究同样表明IL-6的水平可能作为NSCLC患者免疫治疗的疗效预测因子。目前,预测肺癌免疫治疗疗效的生物标志物主要是PD-L1表达和TMB[23]。但是PD-L1表达和TMB需要对肿瘤组织进行检测,存在异质性且标本不易获得[24],而外周血IL-6检测方便易行,在预测免疫治疗疗效方面有潜在的临床应用价值。本研究TMB、PD-L1表达的检测病例少,未能进一步深入进行IL-6与TMB一致性检验,需要扩大样本量来验证PD-1抑制剂治疗疗效与PD-L1的关系,以及进一步探索IL-6预测PD-1抑制剂治疗疗效与PD-L1预测疗效的效能是否具有一致性。
IL-6导致免疫治疗抵抗的可能机制主要有, IL-6增加树状突细胞的凋亡,从而减少CD8+和CD4+T细胞激活和分化[25];另IL-6活化JAK/STAT3通路促进肿瘤增殖和细胞代谢[26]。既往研究发现STAT3的活化可抑制STING,而STING的活化对抗肿瘤免疫治疗起关键作用[27-28]。近期我们同样发现STING的活化是免疫治疗当中很重要的一个关键分子[15]。本研究中,我们发现IL-6可能通过活化STAT3-AKT通路抑制STING的表达,进而减弱p-TBK1的活化,提示这可能是IL-6引起NSCLC患者PD-1抑制剂治疗抵抗的潜在机制。近年来,抗IL-6受体抗体托珠单抗(tocilizumab)[29]和抗IL-6抗体司妥昔单抗(silkuximab)已经在某些肿瘤的治疗方面显示出潜在的临床获益[30],但其能否克服IL-6所致的PD-1抑制剂治疗抵抗、增强免疫治疗疗效,有待进一步研究。
本研究有几个局限性。首先,本研究为回顾性研究,且纳入病例数偏少,可能存在选择偏倚,限制了结果的普遍性;其次,由于病例数限制,本研究仅收集了基线IL-6数据,无动态IL-6水平变化;第三,本研究采集的为外周血IL-6,这与组织IL-6水平可能存在差异,需要进一步的研究来评估两者关联。
综上所述,IL-6可能通过抑制STING-TBK1通路,减弱T细胞介导的肿瘤细胞杀伤作用,进而导致NSCLC患者PD-1抑制剂治疗抵抗。本研究的发现为扩大免疫治疗获益人群、增强免疫治疗疗效提供了参考。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
