蒲公英提取物对白念珠菌的抑制作用及机制研究
2022-11-15杨建婷梁引库王全华兵器工业五二一医院药剂科西安70065陕西理工大学生物科学与工程学院陕西汉中73000
杨建婷,梁引库,王全华*(.兵器工业五二一医院药剂科,西安 70065;.陕西理工大学生物科学与工程学院,陕西 汉中 73000)
临床上真菌感染性疾病不断增多,白念珠菌(又称白假丝酵母菌)是最常见的一种条件致病性真菌病原体,定植于人体的各个部位,其生长主要受宿主免疫力、压力、微生物菌落和其他因素的影响[1]。随着真菌耐药性不断升高且日益严重,开发新型抗白念珠菌的植物药成为近些年来的研究热点[2]。我国科学家经过几十年的探索,发现许多中草药具有抗真菌作用,对白念珠菌有抑制作用的中药有决明子、苦参、黄芩、乌梅等[3]。中草药活性成分抗白念珠菌的作用机制是通过破坏菌体的细胞壁、细胞膜和细胞质的形态和结构而达到抗真菌作用[4]。有研究发现,蒲公英提取物对金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌和大肠埃希菌等均有不同程度的抑制作用[5]。还有学者发现,通过水提、醇提、超声提取法等分别提取出蒲公英多糖、黄酮和酚酸等,利用平板打孔法研究各活性成分对沙门菌、痢疾杆菌、大肠埃希菌、葡萄球菌和金黄色葡萄球菌的抑菌效果,结果显示不同提取方法对四种菌的抑制作用不同[6]。本文在蒲公英提取物对细菌抑菌作用的研究基础上,研究其对真菌的抑制作用,以白念珠菌为研究对象,从最低抑菌浓度(MIC)、扫描电镜(SEM)、抑菌动力学、细胞膜通透性和对细胞壁葡聚糖合成的影响五个方面,研究蒲公英提取物对白念珠菌的抑制作用及机制,旨在从植物中寻找抗真菌药物,为开发广谱、高效、低毒的抗真菌药物提供参考。
1 材料
1.1 菌株
白念珠菌(Candida albicans,C.albicans,批号:ATCC10231,该菌株冻干菌种由陕西理工大学陕西省资源生物重点实验室菌种保藏中心提供),-80℃低温冰箱冻存,实验前复苏传代使用。
1.2 试药
氢氧化钠、浓盐酸(37%)、无水乙醇、戊二醛、磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钾(天津市富宇精细化工有限公司);吐温80(Tween 80)、二甲基亚砜(DMSO)(天津市光复精细化工研究所);氯霉素(上海瑞楚生物科技有限公司);葡萄糖、蛋白胨、酵母浸粉、琼脂粉(北京奥博星生物技术有限责任公司);溴化钾(PIKE,光谱纯,北京英莱克科技发展有限公司);蒲公英全草(汉中市中药材市场,经陕西理工大学吴三桥教授鉴定为菊科植物蒲公英)。
1.3 仪器
紫外分光光度计UV250(日本岛津);电热恒温培养箱DHP-9162(上海一恒科学仪器有限公司);立式压力蒸汽灭菌锅LDZX-50KBS(上海申安医疗器械厂);台式高速离心机TGL-20(湖南湘仪仪器开发有限公司);超低温冰箱-80℃DW-86L338J(青岛海尔特种电冰柜有限公司);超净工作台SW-CJ-1F(苏州净化有限公司);低温冷冻干燥机SJIA-10N(宁波市双嘉仪器有限公司);扫描电子显微镜JSM-6390LV(日本电子公司);红外光谱仪FT-IR(美国Nicolette 公司);真空干燥箱XMTD-8222(上海精宏实验设备有限公司)。
2 方法
2.1 蒲公英活性成分的提取分离与纯化
蒲公英有效成分根据图1 工艺路线进行提取。提取样品Ⅰ经干燥后密封冻存。

图1 蒲公英活性成分的分离纯化工艺路线Fig 1 Extraction and purification of active ingredients in dandelion
2.2 液相色谱分析条件
色谱柱:DiKMA Diamonsil C18柱(250 mm×4.6 mm,5 μm);流速:1.0 mL·min-1;柱温:30 ℃;进样量:10 μL。乙腈为流动相A,0.1%甲酸水溶液为流动相B,使用梯度洗脱(0 ~10 min 92% B;10 ~24 min,92% →86%B;24 ~35 min,86%→77%B;35 ~56 min,77%→76%B;56 ~60 min,76%→68%B)[7]。
2.3 MIC 测定
将活化后的白念珠菌单菌落接种于沙式液体培养基,37℃、200 r·min-1培养12 h,用沙式液体培养基将菌液浓度调至1×107CFU·mL-1,配制280 mg·mL-1蒲公英样品Ⅰ母液,备用。分别向装有2 mL 沙式培养基的试管中加入蒲公英样品Ⅰ,使培养基中蒲公英样品Ⅰ最终质量浓度为0、4.0、8.0、16.0、32.0、48.0、64.0 mg·mL-1,以0 mg·mL-1作为对照,按5%(V/V)接入备用菌液,分别于37℃、200 r·min-1培养24 h,用分光光度计测A600nm值。与前一浓度相比较,当A600nm下降≥95%时的样品的浓度即为蒲公英样品Ⅰ的MIC[8]。每组设置3 个平行。
2.4 SEM
用1×107CFU·mL-1菌液配制280 mg·mL-1蒲公英样品Ⅰ母液,备用。取2 mL 悬浮菌体,分别加入蒲公英样品Ⅰ母液,使溶液中蒲公英样品Ⅰ最终浓度为0、0.5、1、2×MIC,以0×MIC作为对照,分别于37℃、200 r·min-1培养。当培养至5 h 时,取1 mL 的菌体样品,4℃、8000 r·min-1离心6 min,PBS(pH 5.8)洗涤2 次。加入2.5%戊二醛过夜固定,使用呈梯度浓度的乙醇溶液(50%、60%、70%、80%、90%)重悬浸泡10 min,于4℃、8000 r·min-1离心6 min;乙醇重悬浸泡10 min,4℃、8000 r·min-1离心6 min,2 次,脱水,用真空冷冻干燥机干燥12 h。镀金后上SEM 观察[9]。每组设置3 个平行。
2.5 抑菌动力学分析
用1×107CFU·mL-1菌液配制280 mg·mL-1蒲公英样品Ⅰ母液,备用。分别向装有4 mL 沙式液体培养基的试管中加入蒲公英样品Ⅰ,使培养基中蒲公英样品Ⅰ最终浓度为0、1、3×MIC,以0×MIC作为空白对照,按5%(V/V)接入备用菌液,分别于37℃、200 r·min-1培养,每隔3 h 取样200 μL,测其A600nm值。每组设置3 个平行。按式1 计算白念珠菌存活率和抑菌率[10-11]。
式1:存活率(%)=A600nm(加入抗菌样的吸光度)/A600nm(未加入抗菌样的吸光度)×100%。
2.6 核酸吸光度法研究细胞膜通透性
按照“2.3”项下方法培养白念珠菌,将菌液于6000 r·min-1离心10 min,收集菌体,pH 5.8 PBS 洗3 次。用含0.01% Tween 80 的pH 5.8 PBS悬浮菌体,调整为1×109CFU·mL-1。分别向装有2.5 mL 悬浮菌体的10 mL 试管中加入蒲公英样品Ⅰ,使溶液中蒲公英样品Ⅰ最终浓度为0、0.5、1、2×MIC,以0×MIC作为空白对照,37℃、200 r·min-1培养,分别于0、1、2、4、6 h 取样200 μL,6000 r·min-1离心10 min 后测上清液A260nm值[12]。每组设置3 个平行。
2.7 数据分析
数据分析使用SPSS 22.0、Origin 8.0 软件,物质结构式绘制使用ChemDraw 软件,图片处理使用Photoshops 5.0。数据进行统计学评估,使用单因素方差分析(ANOVA)来比较差异组,P<0.05 代表差异有统计学意义。
3 结果与分析
3.1 蒲公英抑菌成分的分离及鉴定
HPLC 分析蒲公英样品Ⅰ组分(见图2),发现该组分在280 nm 处主要有8 种化合物,其保留时间依次为21.5、27.9、30.3、37.2、38.9、39.8、44.7 和66.2 min,相对百分含量分别为11.45%、3.96%、10.48%、34.24%、3.91%、11.80%、3.65%和4.21%。经比对发现峰1、峰2、峰3、峰4、峰5 和峰6 依次被初步确定为4-香豆酸、阿魏酸、槲皮素戊糖苷、3,5-二-O-咖啡酰奎尼酸、4,5-二-O-咖啡酰奎宁酸和木犀草素,而峰7 和峰8为未知化合物。

图2 蒲公英样品Ⅰ的HPLC 色谱图Fig 2 HPLC chromatogram of dandelion sampleⅠ
3.2 MIC 的测定
结果表明随着蒲公英样品Ⅰ质量浓度增加,白念珠菌A600nm逐渐下降,在32.0 mg·mL-1时,菌液A600nm为对照的0.048%,吸光值下降幅度达95%。表明蒲公英提取物对白念珠菌的抑制率可达95%,且随着浓度增加,菌液A600nm下降幅度均大于95%。表明蒲公英提取物对白念珠菌的MIC值为32.0 mg·mL-1。
3.3 SEM 分析
SEM 观察发现,对照组处理5 h 后,白念珠菌结构完整,外观饱满,菌体成近乎椭圆形,表面光滑,折光性好(见图3A ~C)。0.5×MIC样品Ⅰ作用5 h 后的白念珠菌细胞表面基本和空白对照组一样,但表面变得粗糙,折光性减弱(见图3D ~F)。1.0×MIC样品Ⅰ处理白念珠菌5 h后,多数白念珠菌细胞不再呈现椭球形,结构基本完整,但表面有褶皱,部分菌体出现凹陷。表面比较粗糙,细胞体积开始缩小(见图3G ~I)。2.0×MIC样品Ⅰ处理白念珠菌 5 h 后,全部白念珠菌细胞不再呈现椭球形,细胞形态结构不规则,细胞明显缩小,表面褶皱且极度粗糙,部分菌体出现严重凹陷,细胞膜破损,导致内容物外泄(见图3K、L);图3J 显示,全部白念珠菌细胞明显缩小,表面褶皱、严重凹陷及细胞膜破损在图片上不甚明显,考虑是菌体细胞明显缩小,在放大2000 倍时菌体形态变化扫描电镜不能显示出显著性差异。综上可知,样品Ⅰ能够使细胞体积缩小,结构不对称并且表面形成褶皱,从而破坏白念珠菌的正常形态。其原因可能是由于细胞内容物的大量外泄使得白念珠菌细胞壁、细胞膜凹陷,形成褶皱。

图3 白念珠菌的SEM 图像Fig 3 SEM images of C.albicans
3.4 抑菌动力学分析
微生物生长包括四个时期:缓慢期、对数期、稳定期和衰亡期。样品Ⅰ对白念珠菌生长周期的抑制可根据生长曲线中的指数期进行分析。白念珠菌对数生长期的动力学方程可表示为[13]:
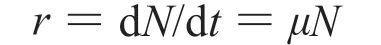
其中,μ是生长速率,N为t时刻的微生物数量。

假设微生物的比生长速率为一个常数,
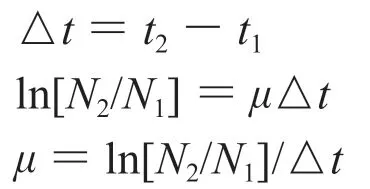
抑菌动力学是通过绘制白念珠菌的抑制生长曲线来研究抗菌性能。样品Ⅰ对白念珠菌生长曲线的影响如图4 所示,由图4 可知,空白对照组的菌体生长状态良好,当加入样品Ⅰ后,菌液的光密度值降低,表明样品Ⅰ对白念珠菌有较好的抑制作用。当样品Ⅰ浓度为1.0×MIC时A600nm随时间有明显变化,样品浓度为3.0×MIC时A600nm变化不大,表明白念珠菌生长受到严重抑制,样品Ⅰ对白念珠菌的抑菌作用增强。分析样品Ⅰ对白念珠菌生长速率及白念珠菌的抑制率发现(见表1),正常情况下白念珠菌的比生长速率为0.05,分别加入1.0×MIC和 3.0×MIC的样品Ⅰ后,其生长速率则分别减小到0.02 和0.00,加入3.0×MIC样品Ⅰ后白念珠菌基本不生长,其抑制率达到了97.13%。由此可知样品Ⅰ对白念珠菌的抑制作用主要是作用于其对数期的生长,使白念珠菌的生长速度大幅度的降低,而抗菌效果取决于样品Ⅰ的浓度和作用时间[10]。
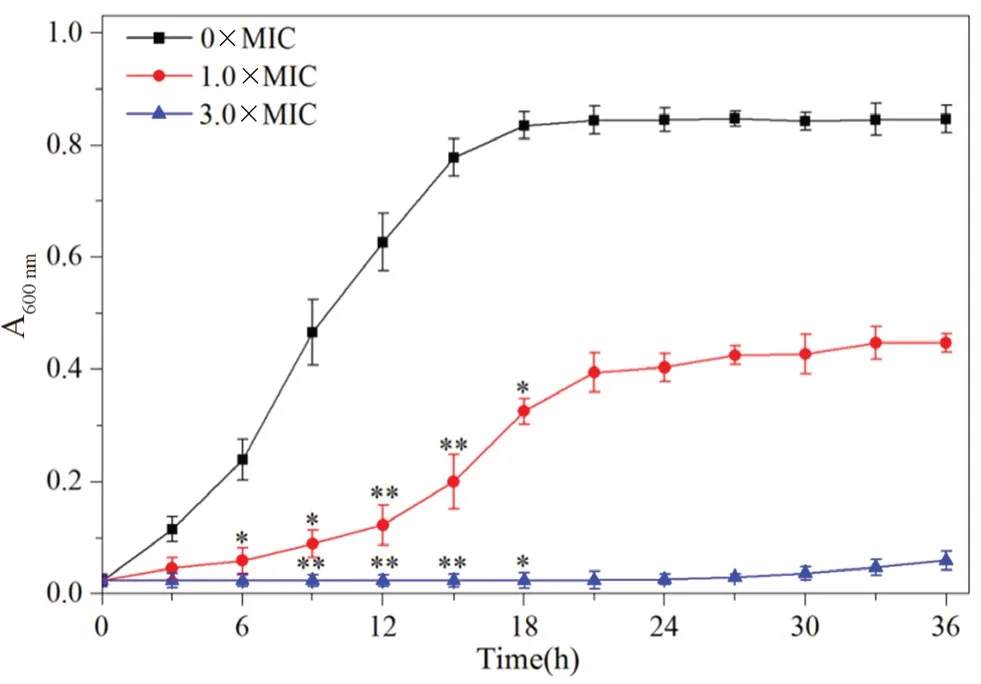
图4 三种浓度的样品Ⅰ对白念珠菌的抑菌曲线Fig 4 Antibacterial curves of three concentrations of sampleⅠ on C.albicans

表1 C.albicans 在不同浓度样品Ⅰ中的抑制率及比生长速率(对数生长期)Tab 1 Inhibition rate and growth rate of C.albicans in different concentrations of sampleⅠ(logarithmic growth phase)
3.5 细胞膜通透性分析
正常情况下,完整的细胞膜选择性通透,会阻挡胞内大分子物质外流。而当导致膜损伤的杀菌剂存在时,杀菌剂会破坏细胞膜,本来不能透过细胞膜的具有紫外吸收的核酸类物质便泄漏到培养液中,导致培养液在260 nm 处的吸光度值增大。因此,通过测定培养液260 nm 处的吸光度值能够预测菌体细胞膜的完整性。由图5 可知,空白对照组(0×MIC)的培养液在260 nm 波长的紫外吸光值随着培养时间的增加逐渐增大,表明白念珠菌在培养过程中伴随细胞膜破坏,菌体的死亡。分别加入0、0.5、1.0、2.0×MIC的样品Ⅰ后,培养液的紫外吸收值也随着培养时间的增加而增大,且都表现出在同一时间高于对照组的现象,且有些达到了显著水平。这表明蒲公英样品Ⅰ损坏了白念珠菌细胞膜,导致膜的通透性增加,进而导致细胞死亡。

图5 三种浓度的样品Ⅰ对白念珠菌细胞膜通透性的影响Fig 5 Influence of samplesⅠ at three concentrations on cell permeability of C.albicans
4 讨论
白念珠菌细胞壁的主要成分是己糖或氨基己糖,对于维持细胞形态和胞内高渗状态起着重要作用。白念珠菌细胞膜主要由磷脂类、鞘脂类和麦角甾醇等组分构成,是一种渗透屏障,是小分子和信号传导的通路,并为各种功能蛋白提供基质结构。细胞壁和细胞膜对完成胞内外物资交换、营养物质吸收和生物合成等方面起重要作用,这些结构一旦被破坏,其功能作用丧失,将导致真菌细胞死亡[14]。抗真菌药物的作用机制包括作用于真菌细胞膜中甾醇合成、作用于真菌细胞壁合成、作用于核酸合成,其实质都是破坏菌体的超微结构。本文研究发现蒲公英提取物可以破坏白念珠菌的细胞膜,可能是其抗真菌活性的抑菌机制。但是,对中药抗白念珠菌作用机制的研究,不应该只局限于电镜观察细胞超微结构变化和对白念珠菌的宏观影响上,应从分子水平上探讨中药活性成分是如何作用于这些细胞结构并使其发生改变,尤其是对生物膜主要成分合成酶的影响,分离酶基因从基因层面揭示中药抗真菌作用机制。
White 等[15]研究发现,白念珠菌在受到外界环境的抑制时,其编码目标酶ERG11基因会发生改变改变,而细胞外排泵基因CDR1、CDR2和MDR1会过表达进而菌体死亡。Denning[16]研究发现,从溶菌芽孢杆菌C3 分离得到的酰胺B(ATB)可诱导细胞凋亡,ATB 通过抑制细胞G2/M 期细胞周期停滞的微管蛋白聚合而发挥作用的。表面活性剂对白念珠菌的作用,主要是对菌丝发育、细胞膜形态有强烈的影响,这种影响与肌动蛋白骨架的异常组织和随后的菌丝相关因子的极化转运缺陷有关[17]。细胞壁β-葡聚糖在白念珠菌生长过程中起到了重要作用[18-19]。卡泊芬净通过抑制白念珠菌细胞壁β-葡聚糖的合成,从而达到抑制白念珠菌增长的目的[20]。本研究分析了样品Ⅰ对白念珠菌的MIC值为32.0 mg·mL-1。抑菌动力学方程分析发现样品Ⅰ对白念珠菌的抑制作用主要是作用于其指数生长期。样品Ⅰ可破坏白念珠菌细胞结构,导致细胞表面凹陷,形成褶皱。细胞膜通透性分析发现,样品Ⅰ导致细胞内容物外泄。这进一步表明蒲公英提取物是通过作用于白念珠菌细胞的细胞壁,通过破坏细胞壁进而导致内容外泄而引起细胞凋亡的。
虽然在中药抗白念珠菌的研究方法和作用机制方面已经取得了不少进展,但仍然存在诸多未知领域,需要进一步深入探讨,为真菌疾病的治疗提供新的选择。
