超声与CT联合应用对甲状腺结节良恶性诊断的价值
2022-11-15赵朝伦
赵朝伦 杨 倩
(1修文县人民医院放射科,贵州 修文 550200;2贵州省第二人民医院放射科)
甲状腺结节很常见,临床可触及结节占总体人群的4%-7%[1],经超声发现结节占总体人群的50%-60%,其中结节性甲状腺肿占绝大部分,而甲状腺癌仅占甲状腺结节的5%-10%,尽管它占的比例不高,但是甲状腺结节如此大发病基数,这个比例不可小觑。甲状腺结节检查传统首选超声,CT虽然在发现结节及结节定性诊断方面不如超声,但在显示大病灶周围关系、增强CT对病灶血供的显示有独特的优势,胸骨后甲状腺肿、粗大钙化等观察优于超声[2],而成为超声检查的有力补充,本文回顾性分析超声和CT诊断后经手术病理证实的病例,结合文献探讨两者联合应用的价值。报告如下。
临床资料
1一般资料:本文搜集了2018年9月-2020年6月本院经手术病理证实的甲状腺结节患者23例、共32枚结节,其中男性3例、女性20例,年龄最小27岁、最大67岁,平均年龄48.7岁,所有病例有完整超声和CT检查。32枚结节中良性18枚,其中结节性甲状腺肿17枚、桥本氏结节1枚;恶性14枚,其中甲状腺乳头状癌15枚、髓样癌1枚。所有病例临床表现无特异性,以体检和颈部包块被发现,病程1周-10余年不等。
2检查方法:(1)超声检查。采用日本ALOKA ALPHA6型超声诊断仪,探头频率5-7.5MHz。检查体位:患者仰卧位,头部尽量后仰充分暴露颈前区,对甲状腺进行纵切、横切、斜切面扫描,观察甲状腺结节的数目、大小、形态、边界、周围晕征、内部回声、钙化、结节内部和周围血供以及颈部淋巴结情况。(2)CT检 查。采 用 荷 兰 飞 利 浦ingenuity Core128螺旋CT机。检查体位:患者仰卧位,两手置于身体两侧,双肩放平,颈部尽量后仰,扫描范围从口咽至锁骨上窝,发现病灶向胸部延伸时,加扫至胸腔内主动脉弓处,扫描螺距1.0,层厚2mm,层距2mm。所有检查均为平扫加增强双期扫描,对比剂为碘佛醇80ml,高压注射器经肘静脉团注,注射流率2-3ml/s,动脉期30秒、静脉期50秒进行扫描。
3甲状腺结节评价:所有超声和CT图像传入PACS系统,请2位中级以上诊断经验丰富的放射科、超声科医生对图像进行观察并作出定位、定性诊断,分别得出各自的CT和超声结论;然后再对CT和超声共同讨论,两者诊断意见不同时,经共同协商后作出最后诊断。良恶性结节评估,参照甲状腺结节影像检查流程专家共识标准,良性结节超声征像:形态规则、等高回声、有声晕、囊性为主、海绵状外观、周围环形血流;恶性结节超声征像:实性为主、低或极低回声、形态不规则、纵横比>1、有为钙化、中央血流模式等。CT良性结节:边界清楚、形态规则、有囊变、增强后边界较平扫清楚、高强化;恶性结节:边界模糊、形态不规则、咬饼征、微钙化、增强轻度或磨玻璃样强化,边界较平扫模糊。因本文病例数少,不采用统计学进行论证。
4结果:超声、CT、超声联合CT结节评估情况,32枚结节中良性18枚,直径约0.8-5.8cm,平均3.1cm,右侧叶10枚、左侧叶8枚;恶性结节14枚,直径约0.3-2.2cm,平均1.6cm,右侧叶8枚、左侧叶6枚。良性结节2枚、恶性结节1枚因钙化影响超声判断,其余结节均有比较典型的超声征像。1枚恶性结节直径约0.3cm,CT未能发现,其余结节均有比较典型的CT征像。与病理结果对照,超声、CT、超声联合CT检查对甲状腺结节良恶性结节的检查结果见表1。
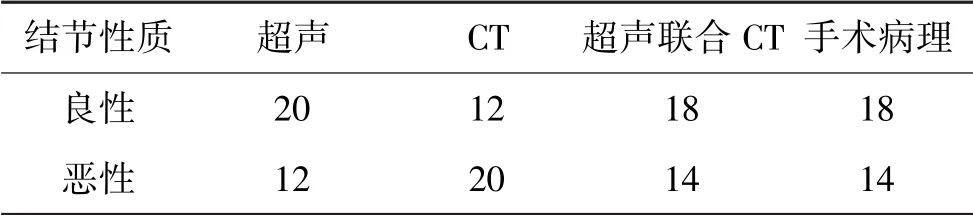
表1 超声、CT、超声联合CT 3种检查方式与病理结果对照(单位:枚)
讨 论
甲状腺结节依据病理性质分为良性、恶性。良性结节中以结节性甲状腺肿(nodular goitres NG)和滤泡性腺瘤(follicular adenomas FA)多见;恶性结节中乳头状癌(Papillary thyroid carcinoma,PTC)最多见、其次滤泡细胞癌(follicular thyroid carcinoma,FTC)、髓样癌(medullary thyroid carcinoma,MTC)等。NG女性多见,可能与女性的妊娠、哺乳和月经等有关[3]。NG分为3个期:增生期:是结节早期,由于碘缺乏,甲状腺激素生成不足导致TSH分泌增多,滤泡上皮增生,类胶质含量减少;静止期:此期胶质储积、甲状腺增大,对称,滤泡萎缩,大量胶质潴留;结节期:因长期交替发生的增生和退缩过程使甲状腺内纤维组织增生,从而包绕增生或萎缩的滤泡形成结节[4]。影像检查方法中,超声检查在很大程度上优于CT检查,尤其是微小结节。NG由于增生、复旧及继发出血囊变、坏死、纤维化、钙化等程度不同,超声、CT表现多种多样,易与滤泡性腺瘤及甲状腺癌相混淆,尤其是单发结节[5]。超声表现为甲状腺双侧叶对称性或不对称性肿大,甲状腺内见单发或多发结节,可成实性或囊性、囊实性。结节大小不等,超声能够发现1.0-2.0mm的微小结节,并对典型微小结节做出正确的定性诊断。NG典型超声表现如下:甲状腺双侧叶形态大小可正常,也可出现不对称性肿大,甲状腺内见单个或多个大小不一的结节,其边界清晰,形态规则或不规则,纵横比<1,部分结节周边可见包膜;结节内部成分可为实性、囊实混合性或“海绵样”结构,回声多种多样,可表现为低回声、高回声、等回声以及混合回声,结节内部可有钙化灶,多为粗大的钙化斑;彩色多普勒超声显示,若结节以增生为主,内部血流可见轻度或明显的血流信号,若结节以退化为主,则结节内大多没有血流信号或只有少量的血流信号;超声造影可见大多数结节性甲状腺肿呈均匀等增强。然而我们在实际工作中还会遇到一些不典型的结节性甲状腺肿,这些结节中的囊性成分随着时间的推移逐渐被吸收,导致病灶萎缩,内部出现纤维化及微小钙化,而形成所谓的“僵尸结节”,其声像图上类似PTC,因此这类病变容易被误诊,针对此类型结节,我们可与此前检查进行对比诊断,如若实在难以明确性质,可与穿刺协助诊断。CT常表现为密度不均、大小、形态不一的结节影,对较大单一结节术前诊断不难,平扫结节与正常甲状腺之间边界模糊,增强后边界较平扫清楚,这是CT诊断NG比较可靠的征像(见图1),其原因可能为NG富含纤维成分、梗死、胆固醇结晶沉着及玻璃样变性等,这些成分占据了毛细血管床,故强化程度低于周围明显强化的甲状腺组织[6]。钙化是甲状腺结节最常见征像之一,有学者统计出占良性病变的15.7%-38.7%,占恶性病变的49.6%-78.8%[7-8]。多为营养不良性钙化,影像常将钙化分为微钙化、粗钙化、环形钙化。超声软组织分辨率高,检查微钙化具有明显优势。良性结节钙化一般以粗钙化、环形钙化为主,其在超声上表现后方伴声衰伪影而影响结节观察;CT无声衰限制,能清楚完整显示钙化的大小、形态及内部结构,并可通过对比钙化与甲状腺组织之间平扫和增强之间的密度差异,对结节性质进行判断[8](见图2)。
PTC是甲状腺癌中常见的亚型,也是生长最快的恶性肿瘤之一[8]。超声是最常见的检查方法,其4大主要征像已普遍到认可,即形态不规则、纵横比>1、低回声、微钙化[9-10],本文超声诊断PTC病例中,至少包含有3种征像,与病理对照有很高的符合率(见图3)。CT也有四大主要征像,即形态不规则、咬饼征、增强后病灶磨玻璃样强化/范围缩小、微钙化,CT多征像联合诊断PTC有很高的敏感性、特异性[11-12],本文CT诊断PTC病例至少具备2个征像,与病理对比也有很高的符合率,但其中1枚结节病理证实为MTC(见图4),作者认为在超声、CT诊断为恶性结节时,提示临床结合CEA、降钙素排除MTC。恶性结节常并发有粗钙化,超声在判断其性质方面已没有优势,可能是因为粗钙化在大小及形态变化多样,且会引起明显声衰而致超声诊断价值减低;还有粗大钙化的良恶性结节多伴有显著的纤维化,在超声上表现为相似的回声不均和低回声,难以对良恶性结节进行鉴别。有多位学者研究认为[13-15],CT判断粗钙化方面具有明显优势,通过增强前后钙化周围的情况有助于结节性质的判定,CT平扫前钙化周围见晕征,增强后晕征变模糊,调节窗宽窗位观察,钙化显示较松散,这是因为癌细胞浸润致钙化松散呈小斑片状、砂砾状。FTC是以滤泡状结构和包膜或血管被侵犯为主要组织学特征的分化型甲状腺癌,是仅次于PTC的甲状腺第2常见恶性肿瘤,既往文献报道约占甲状腺恶性肿瘤的20%,而近年来由于PTC发病率迅猛增长,其占比下降至10%-15%。FTC分为微小型和广泛侵袭型两种,本病多见于碘缺乏地区,因此推测其发病可能与碘营养状态有关。本病可发生于任何年龄,以年龄较大者多见,女性发病率高于男性。一般生长缓慢、病程较长,少数也可在短期内快速生长,常缺乏明显局部恶性特征。多数无明显症状,极少数可引起甲状腺功能亢进表现,较少发生淋巴结转移,但较PTC容易出现远处转移,转移部位主要是肺和骨,因此预后较PTC差。FTC病理上显示滤泡细胞分化的侵袭性细胞肿瘤,缺失PTC典型特征。FTC显示不同的形态学变化,生长方式通常类似于胚胎或胎儿性腺瘤,可见含有胶质的滤泡,结构和细胞的非典型性特征不能作为诊断恶性的可靠依据,因为这些变化也可见于良性病变,恶性的诊断取决于包膜和血管侵犯的证据。滤泡性腺瘤与腺瘤性甲状腺肿、FTC、滤泡亚型PTC之间具有很多重叠的影像学征象,很难通过单一的影像学方法将4种病变完全鉴别开。FTC典型超声表现表现为低回声或等回声,囊性变少见形态呈椭圆形或类圆形超声显示肿块周围晕环消失或出现厚薄不一的晕环,诊断FTC有较高的阳性预测值。由于FTC存在包膜,局部癌细胞反复突破包膜,然后纤维组织覆盖,当癌细胞突入周围正常组织较深时,显示晕环厚薄不一,晕环消失,边缘不光整FTC一般无微小钙化;血流信号方面,肿瘤内部有较丰富、紊乱或不规则的血流信号。CT诊断FTC表现四大主要征象:形态不规则、低强化、星芒状瘢痕或者坏死、环状钙化。超声判断环形钙化结节没有优势,仅能观察钙化的前缘,其后方被声衰伪影掩盖而无法显示。CT没有声衰伪影干扰能完整显示钙化的大小、形态及环形钙化内部的情况。MTC是起源于甲状腺滤泡旁C细胞的恶性肿瘤,占甲状腺癌约1%-2%。临床发病以散发性多见,发病高峰年龄为50-60岁,女性稍多于男性,常累及一侧腺体,不伴有其他内分泌疾病;家族性MTC占20%-30%,属于常染色体显性遗传病,外显率高,发病年龄较散发性提前10-20岁,男女发病无差别。目前认为MTC主要分子发病机制为RET基因突变所引起的RET信号异常活化。MTC可分泌多种物质,其中降钙素最为常见,其次有促肾上腺皮质激素、前列腺素、血清素、5-羟色胺等,并可引起一系列内分泌综合征,有腹泻、面色潮红、心悸、色素增多等症状。病理学方面,MTC显示滤泡旁C细胞分化的甲状腺恶性肿瘤,显微镜下见圆形或多角形细胞无粘附性生长,呈小梁状、器官样、巢状、腺样或假乳头状结构排列,肿瘤细胞染色呈细颗粒状,常被不等量的纤维血管间质分隔,部分间质见淀粉样物质沉积;免疫组化肿瘤细胞除表达CgA、Syn、CEA外,还表达C细胞特异度产物降钙素,但甲状腺球蛋白通常阴性,而TTEI、PAX8可局灶阳性,在瘤巢周边可见到S-100蛋白阳性的支持细胞。MTC超声表现:多位于甲状腺中上极,这是因为滤泡旁C细胞主要位于中上极;散发性者多为单发,遗传性者多为双侧多发;结节相对较大,多具有规则的边缘,更易呈现为卵圆形,纵横比多<1,呈“躺鸡蛋”样;钙化发生率相对较低,且粗钙化发生率较高,较PTC的钙化灶更致密、更粗糙;CDFI多为高血供;发生淋巴结转移的几率高于PTC,转移淋巴结的回声与原发灶接近,且两者钙化表现一致,呈“子母瘤”样改变。值得注意的是,部分MTC无显著恶性征象:形态规则,边缘光整,边界清晰,无钙化,容易误诊。还应注意的是,部分MTC的超声表现与甲状腺腺瘤类似,都表现为单发性类圆形低回声结节;但两者存在不同之处:(1)髓样癌多位于腺体中上部,钙化发生率较高:(2)髓样癌多无包膜,而腺瘤则有完整包膜;(3)髓样癌边缘的声晕不完整、厚薄不一,而腺瘤的声晕则完整、厚度均一;(4)髓样癌内部及周边血流丰富、紊乱,而腺瘤则多为环状血流,血管走行规则。CT表现为甲状腺内形态不规则、边缘不清肿物,可见不均匀强化伴内部不规则低密度区,部分可见点状或圆形钙化,增强扫描多明显强化。淋巴结转移多见,表现为与原发肿瘤一致的不均匀强化背景下低密度区。临床工作中,出现此类表现的甲状腺肿物患者,如降钙素显著升高,应考虑MTC的可能,确诊需结合病理及免疫组化,此外应全面检查除外其他部位的远处转移。微小MTC的影像学表现与非微小MTC有很多相似之处,如实性、低回声、钙化、无声晕、血供丰富等,但也具有一定的特别征象,如形态不规则等,后者极易与微小PTC混淆。与超声比较,CT在微小MTC显示、判断上不及超声检查。
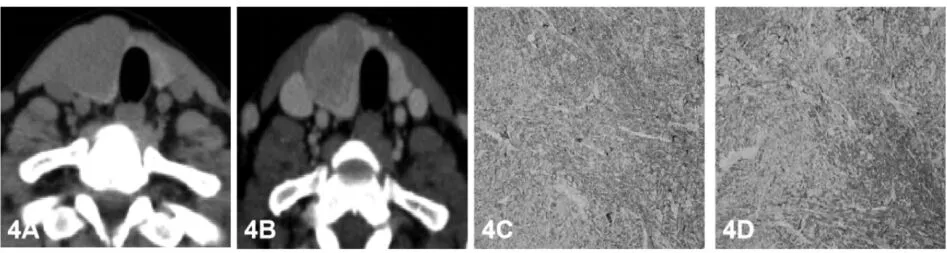
图4 与图3同一病人,图4A右侧叶病灶CT平扫低密度、咬饼征;图4B增强磨玻璃样强化;图4C、图4D病理提示(免疫组化ck+、CK7+、CK19+、CD56+、CgA+、Syn+、TTF—1+、Tg-、TP0-、Ki67约1%-3%)髓样癌。
总之,超声、CT联合诊断甲状腺结节具有重要的价值,单一超声、CT诊断在某些征像方面缺乏特异性,两者联合应用取长补短,提高结节良恶性诊断的正确率,从而能在术前减少误诊,避免不必要的手术。
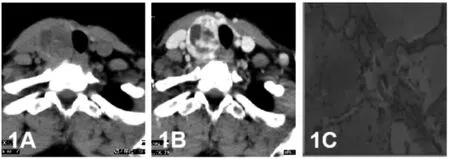
图1A 右侧叶结节CT平扫等低混杂密度、边界不清;图1B增强结节不均匀强化,边界较平扫清楚;1C病理结果示结节性甲状腺肿并出血及囊变,局部区域腺瘤形成。
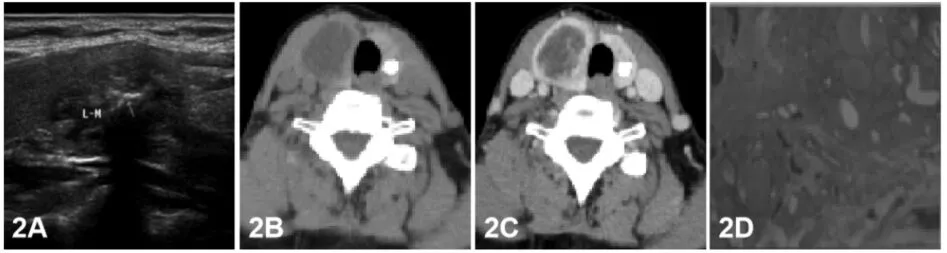
图2A 超声显示条状钙化,后方伴声衰伪影;图2BbCT平扫显示左侧叶粗钙化,边缘见晕征;2C增强钙化周围晕征未见消失,边界清楚;2D病理结果示左侧叶结节性甲状腺肿伴纤维瘢痕及钙化。
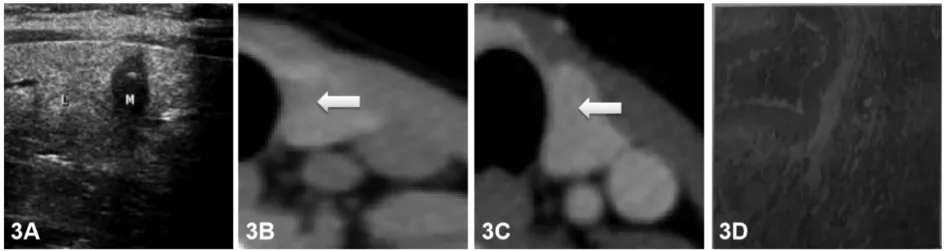
图3A 超声显示左侧叶病灶具有四大主要征像;图3BCT平扫病灶显示不清(白箭头);3C增强病灶强化与周围甲状腺密度几乎一致(白箭头);3D病理结果提示乳头状癌,直径0.3cm。
