核糖体蛋白的类泛素化修饰及其功能的研究进展
2022-11-12陈依军
吴 玥,陈依军
(中国药科大学生命科学与技术学院,南京 211198)
真核胞质核糖体分别由小核糖体亚基(40S)和大核糖体亚基(60S)组装形成80S核糖体。在功能方面,大亚基负责结合tRNA 并介导肽基转移,小亚基负责调控mRNA 的结合和解码[1]。核糖体蛋白(ribosomal protein,RP)作为核糖体的组成成分之一,被普遍认知的功能为参与核糖体生物合成及调控蛋白质翻译过程。RP 被证实在核糖体生物合成过程中发挥促进rRNA 的正确折叠和稳定大小亚基结构的功能[2]。此外,核糖体上不同位置的RP 协同参与并完成蛋白的翻译过程,任何一个RP 的缺失都有可能引起某一种或一类蛋白质合成的异常,导致相应细胞功能的异常甚至疾病的发生[3-4]。
除了参与由核糖体负责的蛋白质翻译及合成以外,RP所发挥的其他作用被称为非核糖体功能,例如调节细胞生长和增殖、细胞凋亡、细胞周期、DNA 修复和转录等过程[5-8]。大量研究表明,RP 存在多种翻译后修饰来介导不同非核糖体功能的实现[9]。除经典的泛素化修饰外,类泛素化修饰因独特的修饰过程和显著并多样的生物学功能引起了广泛的关注。类泛素化修饰(如SUMOylation、Neddylation、UFMylation 等)与泛素化相似,类泛素分子通过E1、E2 和E3 酶级联反应与底物蛋白的赖氨酸残基结合(图1)[10]。与此同时,越来越多的研究证实,RP 是类泛素化修饰过程中一类非常普遍和重要的底物,提示RP 可能存在更多潜在生物学功能,这也极大地扩展了RP 的非核糖体功能。因此,本文对RP 的不同类泛素化修饰过程以及所导致细胞功能的变化进行概述。此外,由于RP 的类泛素化修饰机制及功能研究仍然较少,因此随着这一领域研究的不断深入,将有可能阐明多种疾病的相关机制以及获得更多潜在的药物治疗靶点。
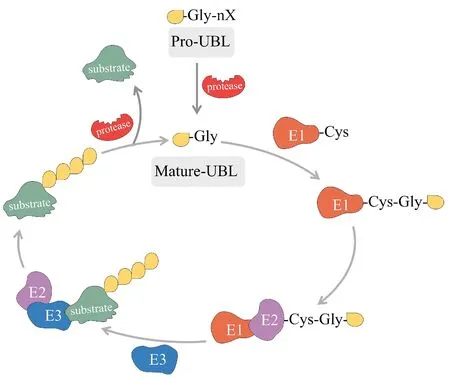
Figure 1 Schematic overview of the Ublylation cascadeUbiquitin-like protein (UBL) generally exists in a precursor form (except for FAT10). Modified proteins are first cleaved to form an active form with glycine at the C-termini under the catalysis of a de-Ublylation enzyme. Next, the C-terminal glycine in UBL reacts with cysteine residue of the E1 activating enzyme to form a thioester bond. UBL is then transferred to the E2 conjugating enzyme through a similar reaction.E2 conjugating enzyme transfers UBL to substrate proteins by interacting with E3 ligase. The UBL bounds to the substrate can be further cleaved by de-Ublylation enzymes, and the cleaved UBL can undergo Ublylation for next cycle
1 核糖体蛋白的类泛素化修饰
RP 是人类核糖体的重要组成成分,主要参与核糖体的生物合成以及蛋白质的合成。除此以外,越来越引人注目的还有它们所表现出的大量非核糖体功能。研究发现RP 在血液病、病毒诱发的免疫反应、肿瘤的发生发展以及肿瘤免疫微环境变化等方面发挥广泛的非核糖体功能[11-14]。目前已报道的人源RP 有80 种,但所涉及的RP 的功能远多于其种类和数量,因此人们一直困惑这种不对称情形。近期,由于质谱技术和高通量分析方法的快速发展,使得这个谜团被逐渐揭开。Odintsova 等[9]通过从人胎盘核糖体中分离出 60S 核糖体蛋白,用反相高效液相色谱法进行分离,酶解后采用质谱分析发现,RP 确实含有大量的翻译后修饰(PTM)。该研究有效地扩增了RP 的存在形式,同时这些PTM 与各种RP 的非核糖体功能有着密切的联系。在众多PTM 中,泛素化修饰是最被广泛研究和熟知的。泛素是一种由76个氨基酸组成的小蛋白,其序列和结构在不同物种均非常保守[15]。经水解成熟的泛素分子依次通过E1 激活酶、E2 结合酶以及E3 连接酶的级联反应,将泛素分子连接到底物蛋白的Lys 残基[16]。泛素化修饰在蛋白质稳定性方面发挥非常重要的作用,同时也参与众多细胞调控过程发挥其他功能[17]。随着泛素化修饰的深入研究并与此平行,有一类分子被定义为类泛素蛋白(ubiquitin-like protein,UBL)。虽然这类蛋白在氨基酸序列上与泛素分子同源性不高,但是立体结构却高度相似(图2)。同时,UBL 也与泛素分子一样需要被切割后暴露出甘氨酸残基,随后发生类似的酶级联反应将UBL共价连接到底物的Lys 残基,这一由3 个酶介导的级联过程被称为类泛素化修饰。目前,已有超过12 种 UBL 被鉴定和报道,例如 SUMO、NEDD8、UFM1、ISG15、FAT10 等[18]。不同蛋白质底物与不同UBL 的结合也已被证实参与多种细胞功能的调节,而且与心血管疾病、糖尿病和癌症等多种重大疾病相关[19-21]。研究发现,RP 可以作为底物被不同的UBL 发生类泛素化修饰,进而产生功能的多样性。有趣的是,在哺乳动物细胞中,几乎一半的 RP 可作为 Neddylation 修饰的底物[22]。除此之外,许多RP 也被发现能与其他UBL 连接而发挥其功能。同时,RP 的类泛素化修饰与其他类型的PTM 还可能发生共修饰或竞争等交互作用,从而进一步扩展了RP 的非核糖体功能。RP 类泛素化修饰的普遍性及多样性为理解疾病发生发展的机制以及发现新的药物作用靶点提供了新的途径和视角。

Figure 2 Comparison of the ubiquitin-like domain in UBL with the structure of ubiquitinA:Representative structures of the modifiers (UBL);B:Structural overlays of different modifiers (UBL). The ubiquitin-like domain was compared with the structure of ubiquitin using PyMOL software. The structural information of these proteins was obtained from the Protein Data Bank (PDB)database or AlphaFold website:Ubiquitin(PDB 1C3T),SUMO1(PDB 1A5R),NEDD8(PDB 1NDD),UFM1(PDB 1WXS),a ubiquitin-like domain of ISG15(PDB 1Z2M),a ubiquitin-like domain of FAT10(AlphaFold AF-O15205-F1)
1.1 SUMOylation
小类泛素修饰因子(small ubiquitin-like modifier,SUMO)最初在酿酒酵母中被发现,称为Smt3,后来被发现普遍存在于其他真核生物。在人体中,SUMO 存在 3 种形式:SUMO-1、SUMO-2 和 SUMO-3,其中 SUMO-1 最受关注[23]。SUMO-1 由 101个氨基酸组成,与泛素的序列同源性约18%,而SUMO-3在SUMOs家族中表达量最高,与小鼠胚胎发育密切相关[23-24]。SUMOylation 与 Ubiquitination过程类似,是一个ATP 依赖的可逆或循环过程。首先,SUMO 以前体形式存在,经特异性蛋白酶(SENtrin-specific proteases,SENP)切割暴露C 端甘氨酸位点,然后被以异二聚体(由SAE1 和SAE2组成,酵母同源蛋白被称为Aos1 和Uba2)形式存在的E1 酶激活。活化的SUMO 被传递给UBC9,也就是目前已知参与SUMOylation 过程的E2 酶仅为UBC9。随后,在E3 酶的作用下将SUMO 共价结合到底物蛋白的Lys 残基[25]。但是,在某些特殊情况下,即使没有E3 酶的催化,也可以发生SUMOylation 修饰[26]。带有SUMO的底物蛋白也可以在SENP 的作用下将SUMO 从底物上切割下来。SUMOylation 参与调控一系列细胞功能,包括DNA损伤修复、信号转导、细胞周期、转录调控和蛋白质的质量控制[27-29]。从底物蛋白而言,某些RP也能够发生 SUMOylation 修饰,包括 RPS3、RPS4、RPS8、RPS11 和 RPS18[30-32]。据报道,RPS3在大肠埃希菌和哺乳动物细胞中能够通过UBC9 发生SUMO 修饰,进一步研究发现能够发生SUMOylation 修饰的位点是 RPS3 的 Lys18、Lys214 和 Lys230,而 RPS3发生SUMOylation 修饰最主要的功能是增加其蛋白稳定性[30]。当蛋白酶体被抑制时,核仁总蛋白的SUMOylation 修饰水平整体增加,通过质谱鉴定了能与SUMO结合的底物蛋白,最终确定可能的修饰底物中有8 个为RP[33]。此外,可能还有许多RP同样也是SUMOylation 修饰的底物,其修饰的发生与细胞定位和细胞所处状态密切相关,有待于深入研究和验证。
1.2 Neddylation
神经前体细胞表达的发育性下调蛋白8(neural precursor cell-expressed developmentally downregulated 8,NEDD8)与泛素的序列以及结构都极为相似,NEDD8与泛素的序列同源性约60%,远远超过了其他的UBL[34]。NEDD8在调节蛋白质稳定性方面发挥着特别重要的作用[35]。NEDD8也是以前体蛋白的形式存在,为了使NEDD8 能够高效地参与Neddylation 修饰酶级联反应过程,需要对NEDD8 进行水解以暴露末端双甘氨酸残基,活化后的NEDD8 再进一步反应[36]。与泛素化修饰相比,Neddylation 修饰的作用机制相对简单,主要归结于目前已知参与Neddylation 修饰过程的酶较少。Neddylation 修饰系统由一种异二聚体E1激活酶、两种E2结合酶和数种具有底物特异性的E3连接酶组成。其中,E3 连接酶根据对应底物是否属于 Cullins 家族主要分为两大类[36-37]。Cullins 家族是第一个被鉴定为NEDD8 底物的一类特殊底物,它同时也是泛素E3 连接酶复合物的重要组成成分。大量研究表明,Cullins的neddylation修饰对于特定底物的泛素依赖性蛋白水解过程有着重要的调节作用[38]。
Neddylation修饰过程与Ubiquitination类似,暴露C 末端甘氨酸的NEDD8 与NEDD8 激活酶(NEDD8-activating enzyme,NAE)的半胱氨酸残基反应结合形成硫酯键,其中NAE 由NAE1(也称为APPBP1)和 UBA3 组成[39-40]。激活的 NEDD8 通过转硫酯反应被转移到E2 结合酶UBC12(也称为UBE2M)或UBE2F的半胱氨酸残基。最后,通过E3连接酶(如MDM2或SMURF1)将NEDD8从E2结合酶转移至底物的赖氨酸残基。共价连接了NEDD8的底物同样可以在去Neddylation 修饰酶的作用下,将NEDD8 从底物上解离下来。去Neddylation修饰酶在这个过程中承担两部分的工作,既水解NEDD8 前 体 又 解 离 底 物 上 的 NEDD8[41]。 去Neddylation 修饰酶中最主要也是研究得最多的一类就是由8 个亚基组成的COP9 信号复合体(COP9 signalosome,CSN)。该酶中的每个亚基都是实现酶催化活性所必需的,其中CSN5 因能与Cullins 底物结合而最为重要,这也是CSN 复合物能够发挥去 Neddylation 修饰酶活性的关键[42]。近年来,越来越多的研究表明,Neddylation修饰在调节蛋白质稳定性和活性方面发挥着重要的作用,在这些新鉴定的底物蛋白中有许多属于RP。
Xirodimas 等[22]通过蛋白质谱分析鉴定出 36种RP 为Neddylation 修饰的底物蛋白,其中30 种RP 经过体内外实验验证确实存在Neddylation 修饰。当Neddylation 修饰被抑制时,大量RP 出现蛋白质加速降解的现象,说明RP 的Neddylation 修饰能够保护自身不被降解[22]。因此,Neddylation 修饰对于维持RP 的稳定性具着重要意义。此外,RP的Neddylation 修饰对MDM2-p53 通路也有重要的调节作用。当RP 功能发生紊乱时会引发核仁应激,RP 通过与MDM2 相互作用将应激信号传递给p53,使p53 信号通路被激活,最终导致p53 依赖性细胞周期阻滞与凋亡的发生。这一过程也被称为RP-MDM2-p53 信号通路,是体内非常重要的肿瘤抑制途径[43]。许多能与 MDM2 结合的 RP 也被鉴定为 Neddylation 修饰的底物,比如 RPS3、RPS7、RPS27、RPL5和RPL11,但大部分RP的Neddylation修饰的过程及功能还有待进一步确定[6,22,44]。近期研究进一步发现,RP 的Neddylation 修饰对核仁应激诱导的RP-MDM2-p53 信号轴发挥重要调节作用。一方面,RP 的Neddylation 修饰能够调节与MDM2 的相互作用而调控下游p53 信号。例如,RPL11 发生Neddylation 修饰后有助于它定位于核仁,但是当细胞处于应激状态时,RPL11 会发生去Neddylation 修饰,使它重新定位于核质,并在核质中通过结合 MDM2 激活 p53[45]。同样地,当 RPS14的Neddylation 修饰受到抑制时,其蛋白稳定性受到影响,并且定位发生错误,从而导致p53 稳定性下降[46-47]。另一方面,RP 的 Neddylation 修饰也可以通过调节p53 的转录直接调控p53 的活性。例如,发生去Neddylation 修饰的RPL11 可以直接结合p53 的启动子位点,并促进转录共激活物p300/CBP 的招募,从而发挥直接激活p53的作用[48]。这些研究结果提示,生物体内RP 的Neddylation 修饰带来多种多样的功能变化,深入研究将有助于更全面和详细地了解多种生物学过程。
1.3 UFMylation
泛素折叠修饰酶1(ubiquitin-fold modifier 1,UFM1)是近年发现的新型类泛素蛋白之一,对胚胎发育至关重要[49]。UFM1 由 85 个氨基酸组成,与泛素分子有16%的序列同源性[50]。UFM1 与靶蛋白发生共价结合的修饰过程被称作UFMylation修饰,这是一种高等动物特有的翻译后修饰[51]。UFMylation 修饰与泛素修饰过程类似,同样也是三级酶联反应,反应体系中包括E1(ubiquitin-like modifier 1 activating enzyme 5,UBA5)、E2(ubiquitinlike modifier 1 conjugating enzyme 1,UFC1)和 E3(UFM1-specific ligase 1,UFL1)[52-53]。在反应启动前UFM1 以前体的形式存在。反应开始后,经UFM1 特异性蛋白酶体(UFM1-specific proteases,UfSP)的酶切作用,切掉C端丝氨酸和半胱氨酸,暴露出甘氨酸,从而产生活化状态的UFM1;活化后的UFM1 首先与UBA5 形成非共价复合物,接着在ATP 的作用下,UFM1 第83 位的甘氨酸残基与UBA5第250位的半胱氨酸残基以高能硫酯键的形式结合形成一个二元复合物;当UFC1 与UBA5 的C 末端结构域结合后,转硫酯反应被启动,此时UFM1 被转移至UFC1 的第116 位半胱氨酸残基;而UFL1可以募集UFC1和底物蛋白,并将UFC1上的UFM1转移至底物蛋白,与底物蛋白上的赖氨酸残基共价结合,从而完成UFM1 对底物蛋白的修饰。反之,UfSP 可将UFM1 从底物蛋白分子上解离下来,实现 UFMylation 修饰的可逆化过程[54]。UfSP 包括 UfSP1 和 UfSP2,但由于 UfSP1 在哺乳动物细胞中表达量少且活性很低,因而在研究人体细胞中UFMylation 修饰时往往只考虑UfSP2 这一种去UFMylation修饰酶[55]。
迄今,已报道能被UFMylation 修饰的底物较少,可能与目前所知参与UFMylation 修饰的酶种类较为单一有关,尤其是目前仅有UFL1 一种E3连接酶,而在类泛素化修饰中E3 连接酶的数量与底物多样性有着紧密的联系[56]。第一个被报道的底物是UfBP1(也称为DDRGK1),后续研究发现它包含N 端信号序列和穿膜序列,能够帮助它定位于内质网,并通过其PCI 结构域与UFL1 相互作用有利于UFL1 的亚细胞定位。同时,UfBP1 能够调控另一底物——ASC1 的UFMylation 修饰,因此目前UfBP1 被广泛认为是作为UFMylation 修饰系统中的E4 酶发挥作用,其主要功能是与UFL1 结合进而提高其酶活[57]。类似于UfBP1,CDK5RAP3也作为UFL1 识别底物过程中的配体发挥功能[49]。此外,RPL26 作为UFMylation 修饰系统的底物,近年来研究较多。Walczak 等[51]通过结合 CRISPR-cas9 与质谱技术发现了细胞中最为主要的UFMylation 修饰底物——RPL26,其修饰位点被鉴定为K132 和K134。UFMylation 修饰后的RPL26在内质网附着的核糖体上被高度富集,因此猜测这一过程可能与内质网应激(ER)相关蛋白质生物合成相关。后续研究发现,核糖体停滞会诱导RPL26 的 UFMylation 修饰,而 RPL26 的 UFMylation修饰能够促进易位停滞的内质网蛋白靶向溶酶体进行降解[58]。考虑到UFMylation 修饰系统组成成分普遍定位于内质网,并且与内质网相关蛋白质生物合成过程有着密切联系,更重要的是UFL1 已被鉴定为与核糖体相互作用的分子[59],因此其他许多RP 可能与RPL26 类似,也能作为UFM1 的底物,并且它们之间可能协同或单独发挥各种不同的功能。在探索是否存在其他的RP 作为UFMylation 修饰底物的研究中,Simsek等[59]发现了3 个 发 生 修 饰 的 新 RP,包 括 RPS3、RPS20 和RPL10。这3个RP在80S核糖体上的位置相邻,意味着它们的UFMylation 修饰可能协同参与80S 核糖体的组装和蛋白质的生物合成过程[59]。此外,最新研究发现,在表达人巨细胞病毒US2 的细胞中存在大量 RP 发生 UFMylation 修饰的现象[60]。虽然RP 是UFMylation 修饰过程中非常重要的一类底物,但这些修饰如何调控细胞的运动规律和命运以及与疾病的关系还有待进一步的研究。
1.4 其他类泛素化修饰系统
干扰素刺激基因15(interferon-stimulated gene 15,ISG15)和人类白细胞抗原F 介导转录因子10(human leukocyte antigen-F adjacent transcript 10,FAT10)是另外两种UBL,它们与UFM1 类似,都是脊椎动物特有的。与SUMO、NEDD8和UFM1不同的是,它们包含有两个与泛素相似的结构域[61]。ISG15 是 UBL 中最早被发现的,ISG15 的每个结构域与泛素有30%的序列同源性。ISG15 由165 个氨基酸组成,同样是以前体形式存在[62]。ISG15的前体活化过程以及后续的一系列酶级联反应与其他类泛素化修饰一样。ISGylation修饰途径中最主要 的 E1、E2 和 E3 酶 分 别 是 UBE1L、UBCH8 和HERC5。与E2和E3酶不同的是,目前已报道的参与ISGylation 修饰过程的E1 酶只有UBE1L 一种。同时,UBP43(也被称为USP18)被鉴定为ISGylation修饰过程中的去修饰酶[63]。最初研究发现,Ⅰ型干扰素(IFN)和病毒感染可以诱导表达ISG15。后续研究发现,除了ISG15 以外,ISGylation 修饰系统的基本组成成分均能由IFN 刺激诱导表达,包括UBE1L、UBCH8、HERC5和UBP43[64]。这些现象表明ISG15在抵抗病毒感染方面具有重要作用。
FAT10 于 20 世纪 90 年代被首次发现,它的两个结构域与泛素分别有着29%和36%的序列同源性[65]。与其他 UBLs 不同的是,FAT10 本身就是以C末端为两个甘氨酸的活性形式存在,它不需要经特异性蛋白酶进行前体切割处理[66]。这可能也是为什么与泛素分子相比,FAT10 的半衰期非常短。同时FAT10 的蛋白水平还受非常独特的机制调节,例如在HCT116 细胞中FAT10 受细胞周期调控的影响,呈现动态规律性的变化[67]。尽管FAT10与其他UBLs 相比有着自己独特的性质,但事实表明它也能发生类似于其他类泛素化修饰的三步酶级联反应。但目前只报道了一种E1激活酶和一种E2 结合酶参与到FATylation 修饰过程,分别为UBA6 和 USE1[66,68]。而 UBA6 和 USE1 又分别是泛素化修饰的E1 和E2 酶,其中USE1 又可以作为FATylation 的底物,在 K323 位点发生 FATylation 修饰[69]。至于参与 FATylation 修饰的 E3 连接酶和去修饰酶目前还没有被发现。关于FAT10 的功能研究发现,它与泛素非常相似,能够靶向蛋白进行蛋白酶体降解,但与泛素不同的是,与靶蛋白结合的FAT10并不会被解离下来,而是一同被蛋白酶体降解,因此FATylation 修饰在这一机制中也不需要去修饰酶的参与[66]。但是否存在一些不同的作用机制还有待进一步的研究。
目前关于ISGylation 和FATylation 修饰的功能研究还比较少,发现的底物蛋白种类也较少。近来有研究表明,非常重要的一个核糖体相关蛋白4EHP 能够发生ISGylation 修饰进而增强它的cap结合活性。4EHP 是一种能够结合mRNA 5'cap 结构的结合蛋白,在抑制缺陷mRNA 翻译起始方面有着重要的功能[70]。此外,研究发现新合成的蛋白是 ISG15 和 FAT10 的底物[71]。然而,RP 作为核糖体的重要组成成分,同时又对蛋白质翻译过程有着重要的调控作用。因此,RP发生ISGylation 和FATylation修饰的可能性较大。
2 核糖体蛋白类泛素化修饰对细胞功能的影响
2.1 对细胞增殖、凋亡、自噬的影响
细胞增殖对于组织器官的发育和生物体的生长至关重要。大量研究发现,细胞增殖的异常与胚胎发育缺陷、血液病以及恶性肿瘤等疾病的发生发展密切相关。近年来,越来越多的研究表明类泛素化修饰系统对于细胞生长的调控发挥重要的作用(图3)。例如,在血管重塑和LPS 诱导的内皮细胞损伤过程中,UFMylation 被广泛激活,并且UFMylation 修饰能够影响胚胎和肝脏发育[49,72-73]。RP 作为UFMylation 修饰系统非常重要的一类底物,它的修饰过程也可能有着类似的功能。除了上述猜想以外,也有直接的证据表明RP 的类泛素化修饰对于细胞增殖调控的重要性。据报道,RPL30的SUMOylation修饰对细胞分化发挥重要的调节作用[74]。RPS27 的 Neddylation 修饰能够促进癌细胞存活,而这一功能依赖于细胞环境信号,主要是通过调节 MDM2-p53 信号轴实现[44]。RP-MDM2-p53对调节细胞增殖非常重要[43]。研究表明许多UBL通过与RP 相互作用对该通路产生影响,进而调控细胞增殖。例如,当RPL11 发生Neddylation 修饰后会抑制p53 的激活,而p53 是非常重要的能够调控细胞增殖的抑癌基因。当过表达去修饰酶NEDP1 时,RPL11 的 Neddylation 修饰水平下调,增强了RPL11 与MDM2 之间的相互作用,从而激活p53 的活性。此外,RPL11 也是 SUMOylation 的底物,并且同样起到调控p53 活性的作用[75]。此外,RPS14 的 Neddylation 修饰对 RP-MDM2-p53 信号轴也有类似的调控作用[46]。

Figure 3 Involvements of RP Ublylation in the regulations of cell functions
RP的类泛素化修饰在细胞凋亡和自噬方面也显示出重要的作用。RPL26 被发现是UFMylation修饰的主要底物蛋白。RPL26 位于核糖体易位子SEC61附近,而RPL26的UFMylation 修饰能够调控新生蛋白易位至内质网[51,76]。因此,RPL26 的UFMylation 修饰可以维持内质网的稳态[58]。由于内质网稳态失调会引发内质网应激进而诱导细胞凋亡和自噬的发生,进而有助于清除错误的蛋白质或受损的细胞器[77]。因此,RPL26的UFMylation修饰对于调控细胞凋亡和自噬也具有重要的影响。近期通过全基因组范围筛选技术的研究进一步证实,RPL26 的UFMylation 修饰是调控饥饿诱导的内质网自噬的关键因素[76]。此外,p53 也参与调控细胞凋亡。RP 的类泛素化修饰也通过调节RP-MDM2-p53 信号通路的方式而改变细胞凋亡过程。另外,还有一些自噬相关蛋白如LC3 和ATG8,它们虽然也被定义为类泛素化修饰物,但尚未发现其底物。如果发现RP 可以作为它们的底物,人们对自噬过程的认识和了解可能会发生本质的变化。
2.2 对蛋白质生命周期的调控
在哺乳动物细胞中,有几乎一半的RP 能够发生Neddylation修饰。同时,当细胞内的Neddylation修饰过程被抑制时,RP 的稳定性明显下降[22]。例如,RPL11 在发生长时间的去Neddylation 修饰后,会很容易通过蛋白酶体途径降解[78]。与此类似,当RPS14 的Neddylation 修饰受到抑制时也会降低其蛋白稳定性[47]。除了 Neddylation 修饰,其他类泛素化修饰也具有类似的功能,例如,RPS3 的SUMOylation 修饰可以增强其蛋白稳定性[30]。RP的类泛素化修饰除了能够调节自身稳定性以外,也会影响其他蛋白的稳定性。其中,由于泛素化修饰是蛋白质降解的主要途径之一[79-81],类泛素化修饰过程与泛素化修饰之间存在的广泛交联和竞争是非常重要的原因。一方面,泛素化修饰系统中的酶能够参与多种类泛素化修饰过程。例如,UBA6 和 USE1 分 别 是 FATylation 和 Ubiquitination修 饰 系 统 共 用 的 E1 激 活 酶 和 E2 结 合 酶[68,82]。作为泛素连接酶的MDM2 也被证实可以作为Neddylation 修饰过程中的 E3 连接酶[44]。另一方面,许多泛素化修饰系统的组成成分被证明是类泛素化修饰的底物。例如,Neddylation 修饰系统最特别的一类底物就是Cullins,而Cullins 是非常重要的一类 E3 连接酶的组成部分[83]。Cullins 的Neddylation 修饰能够通过增强E3泛素连接酶活性进而促进其底物蛋白的泛素-蛋白酶体降解[84]。然而,RP 又参与许多重要的信号调控网络,比如RP-MDM2-p53信号轴,因此RP 的类泛素化修饰可以通过与其他结合蛋白的PTM修饰过程交叉互作,进而发挥更为广泛的调节蛋白质稳定性的作用。
2.3 在疾病治疗方面的应用
随着人们逐渐意识到蛋白质翻译后修饰过程对于维持机体正常生理活动以及多种疾病发生发展的重要性,关于新型类泛素化修饰系统的研究越来越多。RP是引人注目的一类参与类泛素化修饰过程中的底物。研究表明,RP 与UBL 的结合能够广泛调节RP和MDM2-p53信号通路中的蛋白稳定性,影响RP 的非核糖体功能。同时,RP 功能紊乱也会引发许多疾病,包括恶性肿瘤等。除RP 以外,其他多个肿瘤相关分子也被报道是类泛素化修饰的底物,比如 c-MYC、p53、Akt、PTEN 和 Rb等[81,85-88]。据报道,c-MYC 的 SUMOylation 修饰能够调节其蛋白稳定性。c-MYC 既是泛素化修饰的底物也是SUMOylation 修饰过程的底物,两种修饰之间相互竞争[85]。与此类似,p53 与泛素分子和UFM1 之间的结合也是决定其蛋白降解速度的重要影响因素[81]。Akt 的 Neddylation 修饰能够调控肝癌细胞能量代谢[89]。此外,类泛素化修饰系统本身也被报道与肿瘤的发生发展存在密切联系。有研究报道,SUMOylation 通路的组成成分在许多肿瘤中高表达,并且与肿瘤的恶性程度呈正相关[90]。
鉴于上述原因,以类泛素化修饰为靶点来寻找新的抗肿瘤药物已经成为一种新的策略。从机制角度出发,人们可以分别设计靶向并干预E1、E2、E3或去修饰酶活性的药物。但是,考虑到不同修饰系统组成间的差异,针对它们的靶点选择会有所不同。例如,靶向SUMOylation 修饰系统的小分子抑制剂分别由靶向SAE1/2(E1)、UBC9(E2)和SENPs(去SUMOylation 修饰)的化合物组成。这些化合物既有天然产物也有化学设计和合成,它们已经在临床前研究模型中显示出良好的抗肿瘤活性,有望推进至临床研究阶段[91]。此外,通过噬菌体展示技术筛选获得了能高效结合UBC9 的SUMO2 突变体,它可以作为UBC9 抑制剂(SUBIN)发挥作用[92]。然而,针对 Neddylation 通路的小分子抑制剂主要以 E1 和 E3 酶为靶点[93]。无论是SUMOylation 还是 Neddylation 途径,E1 激活底物的过程都被选择为药物作用靶点,旨在抑制起始环节而阻断修饰过程[94]。据报道,靶向SUMOylation途径的第一个药物TAK-981就是通过抑制E1酶发挥抗肿瘤活性,它也是目前临床试验中最有潜力成药的一个化合物[91]。因此,除E1 酶外靶向其他环节的小分子抑制剂还有待进一步研究和开发。并且,目前除了SUMOylation 和Neddylation 通路以外,针对其他类泛素化修饰系统的药物研究还相对较少。
通过加速解析其他类泛素化修饰系统的作用机制,发现和验证更多潜在的疾病治疗靶点,将为筛选或理性设计抗肿瘤药物奠定扎实的基础。从药物设计角度考虑,如果设计能抑制E1 酶活性的小分子抑制剂,可以通过直接靶向半胱氨酸活性位点、占据ATP 结合口袋或占据底物结合位点等方式发挥作用[94]。此外,Neddylation 通路被报道能够调节肿瘤免疫微环境,也有研究表明SUMO具有抗肿瘤免疫调节活性,因此当修饰过程被抑制以后这种调节作用有可能影响其抗肿瘤作用[91,95]。基于这些因素,免疫调节药物与类泛素化修饰抑制剂如TAK-981 的联合应用已经进入临床试验[91]。因此,在疾病治疗阶段,类泛素化修饰抑制剂与其他化疗或免疫治疗药物的联用已成为一种新的发展趋势。
3 总结与展望
活跃生长的细胞需要动态调节RP 的数量和活性以维持细胞生物合成的正常功能。其中,翻译后修饰是不可或缺的调节蛋白质功能多样性的手段。近年来,越来越多的研究聚焦于类泛素化修饰过程。由于参与这一过程的修饰物的结构与泛素高度相似,并且同样发生由E1、E2 和E3 介导的酶级联反应,最终将修饰分子连接到相应的底物并发挥调节底物功能的作用。研究证实,UBL能够修饰RP 而调节核糖体的生物合成和蛋白质合成过程。同时,这些类泛素化修饰过程也在很大程度上扩展了RP 的非核糖体功能。本课题组前期研究表明,RPL10 是胰腺癌治疗的潜在新靶点,且能够通过NF-κB 通路影响胰腺癌细胞增殖[96]。本课题组进一步研究发现RPL10 在胰腺癌细胞中能够发生UFMylation 修饰进而对肿瘤干性起到重要的调控作用,这为旨在靶向胰腺癌干性设计抗肿瘤药物的相关研究提供了新思路。此外,SUMO、NEDD8 和 UFM1 等 UBL 介导的翻译后修饰在调节RP 稳定性和活性方面发挥重要的作用,并在这个过程中发现了UBL 参与RP-MDM2-p53信号通路的调控。
尽管许多质谱数据显示大多数RP 都可能是UBL 的底物蛋白,但是深入系统的实验验证和功能研究还为数不多。此外,几种UBL 与RP 的关系尚不清楚,它们是否被修饰及如何被修饰还未被揭示。特别需要关注的是,基于E3 酶的底物特异性,往往一类底物的成功发现都离不开全新E3 酶的鉴定。与此同时,已有许多研究证实了PTM 之间的相互串扰,尤其是在泛素化和类泛素化之间[97-99]。因此,RP 与另外几种 UBL 的结合也存在需要特定条件的可能性,包括在特定的另一修饰水平状态下或其他修饰类型被抑制时才能发生。
RP 作为参与发挥细胞功能的重要蛋白,其类泛素化修饰以及带来的功能变化已成为类泛素化修饰研究领域的重要方面。随着类泛素化修饰与疾病发生发展研究的不断深入,越来越多类泛素化修饰途径的抑制剂将被设计和发现,其疾病治疗作用有可能代表了新一代治疗药物及策略。所以,深入探讨和了解RP 的类泛素化修饰将有助于深刻认识RP 的功能的多样性以及在疾病发生发展中的作用,为进一步探索肿瘤等疾病的发生、预防和药物治疗提供新的依据。
