四价铂前药研究现状与进展
2022-11-12吴建兵张奕华黄张建
朱 杰,张 宸,吴建兵,张奕华,黄张建
(中国药科大学新药研究中心,南京 210009)
20世纪60年代顺铂抗肿瘤活性的发现成为无机化学领域的一个里程碑[1]。尽管多年来治疗癌症的策略已从细胞毒性转变为靶向治疗,再到免疫学治疗,但铂类药物仍在癌症患者治疗方案中占据约一半的数量[2]。目前临床批准上市的铂类药物都是方形平面二价铂[Pt(Ⅱ)]类药物,它们具有两个处于顺式方向的惰性氨碱供体和不稳定的氯化物或氧供体[3]。顺铂(cisplatin)、卡铂(carboplatin)和奥沙利铂(oxaliplatin)是经美国FDA批准,在世界范围内得到广泛使用的铂类药物。日本批准了两种铂类药物,其中奈达铂(nedaplatin)用于治疗非小细胞肺癌(NSCLC)、小细胞肺癌(SCLC)、食管癌和头颈癌[4],米铂(miriplatin)用于治疗肝细胞癌。此外,韩国批准了庚铂(heptaplatin)治疗胃癌,中国批准了洛巴铂(lobaplatin)用于治疗骨髓性白血病(CML)、SCLC和转移性乳腺癌[5](图1)。

Figure 1 Structures of platinum drugs
顺铂主要通过主动运输(通过铜转运蛋白ctr1)或被动转运进入细胞后靶向核DNA[6-7]。顺铂易水解并生成更具反应性的Pt(Ⅱ)水络合物,后者更容易与DNA 交联从而抑制转录[8]。顺铂与细胞中其他活性物质尤其是谷胱甘肽、蛋白质中的半胱氨酸以及蛋氨酸的巯基也可能会发生结合[9],尽管其研究不如铂-核碱基加合物广泛,但有助于理解顺铂的全身毒性和耐药性的产生。
顺铂虽使用至今,但也存在诸多缺点,比如顺铂水解产生的活性Pt(Ⅱ)水络合物与蛋白质反应,可能会导致生物利用度不佳、难以穿过细胞膜、出现不良反应乃至失活等问题。此外,如何将顺铂或者铂类药物靶向递送至患者的肿瘤组织仍是亟待解决的问题。此外,顺铂最大缺点是其耐药性,耐药性取决于癌症的类型,例如睾丸癌、卵巢癌、头颈癌和小细胞肺癌对顺铂较为敏感,而非小细胞肺癌和结直肠癌则较容易对顺铂产生耐药,耐药性产生后顺铂的治疗效果急速下降[10]。
四价铂[Pt(Ⅳ)]前药是解决这些问题的有效方法之一[11]。八面体低自旋5d6Pt(Ⅳ)络合物相比平面5d8Pt(Ⅱ)络合物在动力学上更加惰性,这种差异可使Pt(Ⅳ)化合物作为前药递送,并且在到达目标肿瘤部位之前具有较少的副反应。与Pt(Ⅱ)相比,Pt(Ⅳ)的轴向取代基的引入可通过调节还原电位以及亲脂性来改善分子的药代动力学性质[12]、生物活性[13]和靶向能力[14]。本文首先归纳了铂类药物的耐药机制,综述了Pt(Ⅳ)前药的构效关系、主要类型及研究进展,并提出了解决铂类药物耐药性的可能途径。
1 顺铂的耐药机制
1.1 涉及铂流入/流出的转运蛋白
1.1.1 溶质载体超家族(solute carrier superfamily,SLCs)铂类药物在细胞内的积累是细胞毒性的必要保证,因此铂类药物产生耐药性的主要原因之一是减少药物内流或增加药物外排。SLCs 包含300多个成员和65 个亚家族[15],如有机阴离子转运多肽(organic anion transporting polypeptides,OATP)、有机阴离子转运蛋白(organic anion transporter,OAT)和有机阳离子转运蛋白(organic cation transporter,OCT)。正常情况下,SLCs在全身表达,通过调节内源性物质和外源性物质的运输来维持细胞内稳态,顺铂和奥沙利铂都是SLCs蛋白的底物[16]。Gao 等[17]报道,奥美拉唑可降低 OCT2 的蛋白质水平,从而减少顺铂在细胞中的蓄积。Aguilar 等[18]发现参与奥沙利铂细胞摄取的主要转运蛋白有机阳离子转运蛋白2(OCT2)在肾癌细胞(renal cell carcinoma,RCC)中受到转录抑制。与非肿瘤组织相比,RCC 细胞中OCT2 启动子中胞嘧啶磷酸鸟嘌呤位点(CpG 位点)的甲基化增加,这与OCT2 的转录抑制相关。研究还发现,去甲基化试剂地西他滨可有效逆转OCT2 启动子中CpG 位点的高甲基化,因此,地西他滨和奥沙利铂的联合治疗是一种很有希望的降低耐药产生的治疗方案。
1.1.2 铜伴侣蛋白(atox1、atp7a and atp7b) 铜(Cu)是细胞增殖和血管生成所必需的元素,其转运需要高度特异性的蛋白质-蛋白质相互作用。在人体内,抗氧化剂1 铜伴侣蛋白(antioxidant 1 copper chaperone,atox1)介导 Cu(I)向 P 型 ATP 酶atp7a和atp7b的转运,后两种蛋白负责铜转运和过量的铜外流。Lasorsa 等[19]发现顺铂和奥沙利铂类似物可以特异性结合到异二聚体复合物atox1-铜-mnk1(mnk1 是atp7a 的第一个可溶性结构域),进而产生一种动力学稳定的加合物,其结构已进行溶液NMR 和X 射线晶体学表征。这些结果表明,Pt(Ⅱ)类药物可以通过atox1 和atp7a 实现转运甚至外排,因此对铜伴侣蛋白的抑制是解决铂类药物耐药性的可能途径。
1.2 解毒系统
1.2.1 谷胱甘肽 谷胱甘肽(glutathione,GSH)在细胞氧化还原状态中起着至关重要的作用,它可以清除自由基,保护细胞免受外源性物质的侵害并维持多种蛋白质的巯基处于还原状态。GSH的活性巯基基团对铂具有很高的亲和力,从而使GSH成为一个简单有效的铂清除剂[20],减少了Pt(Ⅱ)类药物与肿瘤DNA 的结合。因此降低癌细胞内GSH 含量能逆转耐药性,进而提高Pt(Ⅱ)类药物的抗肿瘤效率[21]。
1.2.2 金属硫蛋白 铂类药物也通过与金属硫蛋白(metallthioneins,MTs)螯合而失活。MTs 是含有1/3 半胱氨酸残基的低相对分子质量金属结合蛋白,这使得MTs 很容易成为铂螯合的靶点[22]。在卵巢癌细胞中,金属硫蛋白的含量降低能显著逆转卵巢癌细胞顺铂耐药性[23]。
1.3 自 噬
自噬(autophagy)是一种将受损的细胞器、错误折叠的蛋白及其他大分子物质等运送至溶酶体降解并再利用的过程。自噬是广泛存在于真核细胞的现象,并且可分为巨自噬、微自噬和分子伴侣介导的自噬3 大类。这是一个受到精密调控的步骤,此步骤是细胞生长、发育与稳态中的常规步骤,帮助细胞产物在合成、降解以及接下来的循环中保持一个平衡状态。铂类药物治疗后,在铂耐药细胞中观察到药物诱导的自噬增加,同时基础自噬也有增加[17]。使用3-甲基腺嘌呤或氯喹抑制早期/晚期自噬都能增强铂介导的细胞毒性[24]。
1.4 缺氧微环境
最近的研究发现硫氧还原蛋白(thioredoxin-1,Trx-1)是缺氧诱导因子1α(hypoxia-inducible factor 1-alpha,HIF1α)的上游调节剂。Trx-1 通过增强与Ref-1 的相互作用来增加HIF1α 的表达和结合能力,抑制Trx-1/Ref-1 可以加强氧化磷酸化,并逆转对顺铂的耐药性[25]。除了HIF1α,缺氧诱导因子2α(hypoxia-inducible factor 2-alpha,HIF2α)也与铂耐药相关。下调HIF2α 可显著提高人胶质瘤细胞U251 和U87 以及非小细胞肺癌细胞A549 对顺铂的敏感性。
1.5 DNA修复
铂原子能与嘌呤碱基的N7 位共价结合形成Pt-DNA 加合物,导致DNA 链内或链间交联,其中1,2-链内交联占90%以上。众所周知,与DNA 形成加合物是铂类药物细胞毒性的决定性步骤,它会导致复制和转录抑制以及DNA 双链断裂(double strand breaks,DSB)。随着细胞启动DNA 修复,增加的DNA 修复过程被认为是细胞产生铂耐药重要的原因之一,因此DNA 修复抑制剂与铂类药物的联用能显著减少铂类药物耐药的发生。
2 Pt(Ⅳ)的结构、还原性及构效关系
2.1 Pt(Ⅱ)和 Pt(Ⅳ)的配位化学
顺铂是一种方形平面Pt(Ⅱ)络合物,具有两个顺式胺配体和两个氯代配体。Pt-N 键在热力学上是稳定的,而Pt-Cl键是半不稳定的。因此,该氯代配体可以被水(H2O)或被其他亲核试剂缓慢取代[26]。与方形平面Pt(Ⅱ)不同,Pt(Ⅳ)络合物则是八面体几何形状,更难进行配位取代反应(图2)。Pt(Ⅳ)的这种性质从某些方面来说是有利的,因为它限制了Pt(Ⅳ)前药与体内生物分子在到达其作用靶点肿瘤之前的相互作用,从而减少了相关不良反应。此外,两个轴向配体可进一步增强Pt(Ⅳ)前药的多样性。例如,可以利用轴向配体对分子进行微调以增加细胞摄取或改善肿瘤细胞的靶向性,或者在轴向配体中引入具有抗肿瘤活性的分子从而增强对肿瘤的杀伤力。值得一提的是,轴向配体也可以设计成包括纳米颗粒在内的载体系统,已有很多文献对这方面进行了总结[27-28]。
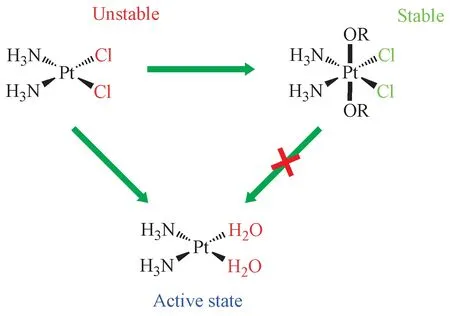
Figure 2 Coordination chemistry of platinum(II)and platinum(IV)
2.2 体内可使Pt(Ⅳ)还原的还原性物质
尽管细胞中有许多还原剂,但通常认为抗坏血酸和GSH 是还原Pt(Ⅳ)前药的细胞还原剂。抗坏血酸是一种双电子还原剂,具有还原水溶液中的Pt(Ⅳ)配合物的能力。抗坏血酸在血浆中的浓度较低(50~150µmol/L),在中性粒细胞的细胞质中浓度较高(约1 mmol/L)[5]。癌细胞中抗坏血酸的浓度与细胞环境中的抗坏血酸浓度有较大的关联,当细胞环境中有充足的抗坏血酸时肿瘤细胞的抗坏血酸浓度可达 0.5~18 mmol/L[29]。GSH 作为一种电子还原剂在血液中浓度约为900µmol/L,正常细胞内浓度约为2 mmol/L[30]。不同肿瘤细胞中GSH 浓度不同,其浓度范围约为0.5 ~ 3 mmol/L[31],GSH 水平升高与肿瘤进展和对化疗药物的耐药性增加有关[32]。
2.3 Pt(Ⅳ)还原的构效关系
Pt(Ⅳ)络合物的抗癌活性通常归因于它们还原为Pt(Ⅱ)产物。因此,Pt(Ⅳ)到Pt(Ⅱ)的转化对于Pt(Ⅳ)络合物的生物学活性来说是十分重要的。细胞内还原剂(例如GSH 和抗坏血酸),通常作为还原性物质促进Pt(Ⅳ)的还原。Pt(Ⅳ)脱除两个轴向配体还原为Pt(Ⅱ)是不可逆的过程,Pt(Ⅳ)络合物的还原速率取决于轴向配体和平面配体的性质[33]。
首先,轴向配体还原速率由小到大依次为:OH <OCOCH3<Cl <OCOCF3(表1),表明吸电子能力越强还原速率越快[33]。

Table 1 Reduction potential and reduction rate of various axial ligand Pt(IV)complexes(1 mmol/L in 0.1 mol/L KCl,pH=7)
其次,平面配体的大小影响Pt(Ⅳ)络合物的还原速率,平面配体越大则还原速率越快。例如,抗坏血酸不会还原[Pt(en)2(OH)2Cl2],但很容易还原[Pt(ipa)2(OH)2Cl2](ipa=异丙胺)配体,原因是异丙胺的基团更大。需要指出的是,具有更快还原速率的化合物有着更高的细胞毒性活性,但可能也会带来了较差的代谢表现。
3 Pt(Ⅳ)络合物的类型
3.1 传统 Pt(Ⅳ)前药
传统Pt(Ⅳ)前药的轴向配体一般无细胞毒性,主要注重于改善Pt(Ⅳ)前药的摄取、代谢及生物分布。奥马铂(ormaplatin)是第一个开展临床试验Pt(Ⅳ)前药(图3)。奥马铂在未稀释的大鼠血浆中(t1/2=3 s)被迅速还原成(1,2-二氨基环己烷)二氯化铂(Ⅱ)[34]。奥马铂在细胞和动物模型中均显示出对顺铂耐药卵巢癌细胞的增殖抑制活性[35],并被美国国家癌症研究所(NCI)和普强公司(Upjohn)委托进行临床试验,在26 名患者中进行了Ⅰ期临床试验,给药剂量为:静脉注射4.4 ~60.8 mg/m2。但奥马铂因为存在严重和不可预测的神经毒性,未能进行后续的临床试验[36]。
另一个进入临床研究的Pt(Ⅳ)配合物是异丙铂(iproplatin),也称为JM9 或CHIP(图3)。异丙铂比奥马铂更不容易被生物还原剂还原和失活,这可能是因为存在羟基轴向配体,这种络合物的缓慢失活使其在全身的分布更广泛。异丙铂的另一个优点是其非常高的水溶性。异丙铂已经完成了38 项临床试验,从Ⅰ期到Ⅲ期不等,其中许多是由Johnson Matthey 和 Bristol-Myers Squibb 委托。一项涉及儿童的Ⅰ期临床研究显示,剂量限制性毒性作用是骨髓抑制[37]。Ⅱ期临床试验在不同癌症类型的患者中进行[38-39]。另外对卵巢癌患者进行了Ⅲ期临床试验[40]。其中60 名国际妇产科协会(international federation of gynecology and obstetrics,FIGO)分期为Ⅱb、Ⅱc、Ⅲ和Ⅳ期的卵巢癌患者进行了组别1:环磷酰胺600 mg/m2与顺铂100 mg/m2联合给药;组别 2:异丙铂 240 mg/m2单独给药;组别3:卡铂300 mg/m2单独给药的随机Ⅲ期。这些研究的最终结论是:异丙铂的总体疗效没有超过顺铂或卡铂。
LA-12 是一种金刚烷胺铂衍生物,相比顺铂,LA-12 的氨基被金刚胺取代,轴向配体为乙酸根(图3)。该药物的高活性主要归因于其高脂溶性,而其高脂溶性主要归因于其配体金刚烷胺。金刚烷胺在化学结构上与批准的阿尔茨海默病药物美金刚相似,并且金刚烷胺还是美国FDA 批准的抗病毒药物[41]。LA-12进行了Ⅰ期临床试验,研究人员在动物试验阶段发现视黄醇结合蛋白4(retinolbinding protein,RBP4)水平与实验大鼠的LA-12 水平相关,并且在参与Ⅰ期临床试验的患者中观察到类似的现象。上述研究结果表明:除了通过铂离子与DNA 的结合来杀死癌细胞之外,LA-12 似乎还通过影响RBP4水平来实现肿瘤抑制[41]。
上述进入临床的3 个Pt(Ⅳ)前药均没有进入到上市阶段,原因是高毒性以及疗效未超过顺铂。传统的Pt(Ⅳ)前药只通过平面或轴向配体来改善其水溶性或者脂溶性,依旧是主要依靠铂离子与DNA 的结合来实现对肿瘤细胞的抑制,在安全性和疗效上均有待实现突破。
3.2 增强铂功效的Pt(Ⅳ)前药
近年来,具有新颖结构的新一代Pt(Ⅳ)前药和不同作用机制的Pt(Ⅳ)前药进展迅速,受到了众多研究者的青睐。
3.2.1 脂肪酸修饰提高Pt(Ⅳ)前药的半衰期Zheng 等[42]合成了一系列不同长度脂肪酸修饰的Pt(Ⅳ)前药,脂肪酸的引入可增强前药与人血清白蛋白(human serum albumin,HSA)的相互作用,有利于提高前药在体内的半衰期(t1/2),其中化合物1(图4)在人血浆中的t1/2为6.8 h,明显长于顺铂(t1/2约为 20 min)或赛特铂(satraplatin)(t1/2约为6 min)。这些化合物在还原条件下失去轴向配体,还原成经典Pt(Ⅱ)类药物发挥作用。令人满意的稳定性,加上已建立的HSA 的非免疫原性、生物相容性和增强的在肿瘤细胞的积聚性,使得化合物1 表现出优异的体外抗癌活性,在肺癌和卵巢癌细胞系中的活性比顺铂高9 ~ 70 倍。

Figure 3 Structures of ormaplatin,iproplatin and LA-12

Figure 4 Pt(IV)prodrug designed to bind non-covalently to HSA
3.2.2 偶联物提高细胞对前药的吸收 研究人员设计了许多Pt(Ⅳ)类化合物,以最大限度地提高细胞对前药的吸收,进而导致DNA 铂化的增加,提高细胞毒性。增强肿瘤细胞中药物的积累、减少顺铂失活的一个重要方法是促进Pt(Ⅳ)前药摄取并减少外排。耐药癌细胞系与高GSH 水平有关,GSH 与顺铂共价结合,结合物从细胞中排出。谷胱甘肽S-转移酶(glutathione S-transferase,GST)催化还原型谷胱甘肽与外源性物质的结合,因此被认为与顺铂耐药有关。Zanellato 等[43]设计合成了一类双作用前药ethacraplatin,它可在细胞内释放顺铂和GST 抑制剂依他尼酸(ethacrynic acid)(图5)。Ethacraplatin 表现出比游离依他尼酸更高水平的GST 抑制活性,在顺铂的肿瘤细胞积累和抗肿瘤活性方面都有非常显著的改善。
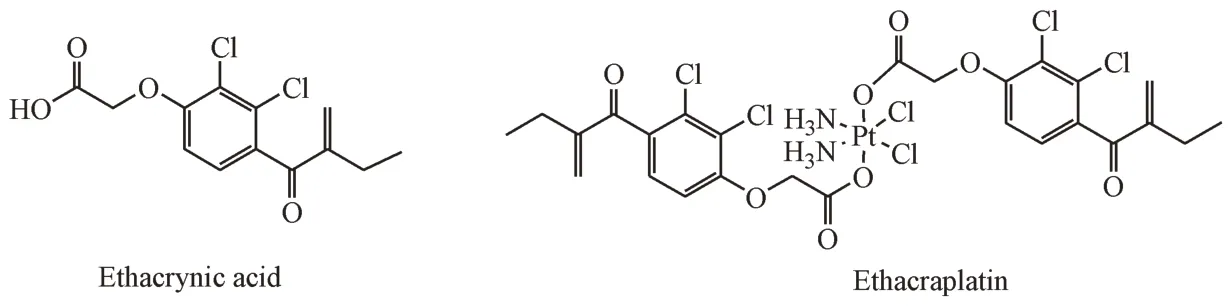
Figure 5 Structures of ethacrynic acid and ethacraplatin
3.2.3 加速DNA 铂化的Pt(Ⅳ)前药 组蛋白去乙酰化酶(histone deacetylase,HDAC)是一种锌金属酶,可从组蛋白的赖氨酸残基中去除乙酰基,从而使DNA 更紧密地包裹在组蛋白周围,形成封闭、不易接近的染色质形式。抑制HDAC 可促进染色质的开放形式,从而使核小体DNA 更容易接近。HDAC 抑制剂(HDACi)与顺铂联合给药可产生开放结构DNA,促进和增强DNA铂化,从而提高细胞毒性。Kasparkova 等[44]将 HDAC 抑制剂辛二酰双异羟肟酸(化合物2)与具有两个顺式叠氮基团和联吡啶的光活化铂络合物在轴向位置结合得到HADCi-Pt(化合物3)(图6)。当在黑暗中与A2780细胞一起孵育时,观察到HDAC 活性降低;用UVA光照射,进一步抑制了HDAC 的活性。A2780细胞活性实验进一步证实,优选化合物HADCi-Pt 在黑暗环境中对A2780的IC50为31µmol/L,在紫外光照射下IC50变为3.3 µmol/L,而同样情况下顺铂的IC50为18 µmol/L。

Figure 6 Structures of compound 2 and 3
3.2.4 阻止DNA 修复的Pt(Ⅳ)前药 顺铂可以与同一DNA 链上相邻的两个鸟嘌呤结合,从而将铂嵌合到DNA 中。DNA 损伤修复系统检测到畸变,便通过核苷酸切除修复(nucleotide excision repair,NER)从DNA中去除铂。许多对顺铂耐药的癌细胞系具有比顺铂敏感癌细胞系更有效的DNA 修复系统[45]。Wang等[46]将核苷酸切除修复抑制剂(NERi)与Pt(Ⅳ)络合得到双作用前药NERi-Pt(Ⅳ)(图7)。NERi-Pt(Ⅳ)有效地降低了NER 的活性,对顺铂耐药细胞A2780cisR 的活性是顺铂的34 倍,对A549cisR的活性是顺铂的88倍。
酪蛋白激酶Ⅱ(casein kinase II,CK2)在许多肿瘤的发生、发展和转移中起重要作用,它通过调节β-连环蛋白(β-catenin)的表达来调节Wnt 信号传导。有文献表明CK2在修复DNA 的单链和双链断裂中起关键作用[47]。因此可以通过抑制CK2介导的DNA损伤修复来逆转顺铂耐药性,从而实现对顺铂耐药癌细胞的抑制。Chen 等[48]通过靶向CK2阻碍DNA 的自我修复,设计并合成了一种Pt(Ⅳ)前药CX-Pt(图7),它含有CX-4945(一种CK2 抑制剂)作为轴向配体。在顺铂耐药细胞A2780/cisR中,顺铂的 IC50为 32.65 µmol/L,而 CX-Pt 的 IC50为2.92 µmol/L。进一步的体内实验表明,与顺铂相比,CX-Pt 显示出较高的肿瘤抑制率,在顺铂耐药细胞A2780 小鼠移植瘤模型中,顺铂的抑瘤率为26.71%,而CX-Pt的抑瘤率达到了58.28%。
3.3 具有双重作用的Pt(Ⅳ)前药
由于癌细胞的新陈代谢改变,即使在有氧条件下也偏向于进入无氧酵解通路。
二氯乙酸(dichloroacetic acid,DCA)通过抑制丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinases,PDK),从而提高丙酮酸脱氢酶的活性,使得丙酮酸变成乙酰辅酶A 从而进入三羧酸循环,抑制了无氧酵解通路进而促进癌细胞凋亡。Xue 等[49]制备了mitaplatin,这是一种带有两个DCA 作为轴向配体的Pt(Ⅳ)衍生物(图7)。细胞内释放DCA 和顺铂会同时抑制无氧酵解通路和损伤DNA。在对顺铂耐药人类表皮样腺癌和肝癌细胞进行测试时,mitaplatin 在两种细胞系中都能克服顺铂耐药性,发挥出优秀的抗肿瘤效果。顺铂对耐顺铂肝癌细胞 BEL 7404-CP 20 的 IC50为 169.56 µmol/L,而mitaplatin 的IC50为41.71 µmol/L,顺铂对耐顺铂人类表皮样腺癌细胞KB-CP 20 的IC50为123.78µmol/L,而mitaplatin的IC50为50.35µmol/L。
环氧合酶(cyclooxygenase,COX)是一种参与肿瘤发生的酶,与肿瘤细胞对铂类药物的耐药性有关。顺铂与COX 抑制剂(吲哚美辛、布洛芬)在联合治疗中观察到优异的协同作用。Neumann等[50]制备了含COX 抑制剂的Pt(Ⅳ)前药COX-Pt(图7),确保两种药物协同转运到细胞中,在随后的细胞内裂解中实现双重作用。COX 抑制剂-Pt(Ⅳ)偶联物显示出高度增加的细胞毒活性,并能够克服顺铂相关的耐药性。

Figure 7 Structures of NERi,NERi-Pt(IV),CX-Pt,mitaplatin and COX-Pt
3.4 一体化生物正交Pt(Ⅳ)前药
Oliveira等[51]发现了一种Pt(Ⅱ)催化的键断裂反应,该反应使用铂配合物(K2PtCl4)或顺铂进行药物催化。反应成功的关键是水促进的活化过程,它触发铂的反应性,导致戊炔酰氨基和炔丙氨基的断裂在水体系中迅速发生。在细胞中利用细胞毒性药物氟尿嘧啶(5-fluorouracil,5-FU)的N-炔丙基衍生物和微管蛋白抑制剂monomethyl auristatin E(MMAE)的戊炔酰胺衍生物进行了概念验证(图8)。另外该研究在结直肠斑马鱼异种移植模型中进行了顺铂催化的5-FU炔丙基衍生物的前药激活实验,揭示了一种新的基于Pt(Ⅱ)的可裂解反应,将铂配合物应用到催化和癌症治疗领域。

Figure 8 Platinum-triggered bond-cleavage of pentynoyl amide and N-propargyls
与此同时,本课题组也发现了Pt(Ⅱ)触发的丙炔基生物正交裂解反应,有意思的是同时还发现Pt(Ⅳ)无法催化此生物正交反应。基于此提出了一种一体化生物正交Pt(Ⅳ)前药的策略,并设计了整合型前药化合物4,其轴向配体为O2-丙炔基保护的偶氮鎓二醇盐(一种NO 供体)。优选化合物可被人卵巢癌细胞中的还原性物质特异性还原,释放顺铂,继而催化O2-丙炔基断裂,释放大量NO,从而产生协同有效的体内肿瘤抑制活性(图9)[52]。一体化前药策略使该前药同时具有催化活性和抗肿瘤活性,在体内肿瘤细胞中实现可控的药物活化作用和杀伤作用,给生物正交化学和铂类药物的应用提供了崭新的思路。

Figure 9 Integrated bioorthogonal prodrugs
4 总结与展望
到目前为止,顺铂、卡铂和奥沙利铂等铂类药物已经在临床使用多年并取得了较好的肿瘤治疗效果。但是在长期服用铂类药物的过程中,耐药性是铂类药物面临的主要难题。在对铂类药物耐药机制的研究中发现,其耐药机制主要分为铂的转运增加和解毒能力增加,其中Pt 转运蛋白和DNA 损伤修复受到了最多的关注。科研工作者对铂类药物耐药性的解决做出了积极探索,Pt(Ⅳ)前药有望成为铂类药物的一种新选择,新兴的Pt(Ⅳ)前药能实现双重乃至三重细胞毒作用,无论是抑制DNA 修复的Pt(Ⅳ)前药,或者是抑制PDK、COX 等与肿瘤密切相关蛋白的Pt(Ⅳ)前药,这些工作都对克服铂类药物耐药性进行了积极的探索。虽然目前尚未有Pt(Ⅳ)类药物上市,但相关研究正不断地取得进展,不仅提高了Pt(Ⅳ)前药的稳定性,改善了体内代谢,而且部分Pt(Ⅳ)药物已具有较高的成药性。另外,笔者所在课题组发现铂不仅可以作为抗肿瘤药,Pt(Ⅱ)还可以在体内催化生物正交反应的发生,而Pt(Ⅳ)则不能,并基于此提出了一体化生物正交Pt(Ⅳ)前药的概念,丰富了Pt(Ⅳ)类药物的应用范围,为克服铂类药物的耐药性提供了新的思路。
