益气活血组分黄芪甲苷配伍川芎嗪对脑缺血再灌注损伤大鼠神经血管单元的保护作用
2022-11-11陈红阳贾壮壮赵磊赵晨阳郭利平
陈红阳 贾壮壮 赵磊 赵晨阳 郭利平
(1天津市中医药研究院附属医院,天津 300120;天津中医药大学;2第一附属医院;3组分中药国家重点实验室)
缺血性脑卒中是严重危害人类健康的常见病和多发病,具有高发病率、高致残率和高死亡率的特点〔1〕,其发生发展过程中主要涉及兴奋性氨基酸毒性、氧化应激损伤、炎症反应及细胞凋亡等一系列复杂的生理及病理机制〔2〕。目前,重组组织型纤溶酶原激活剂(rtPA)被认为是最有效的治疗方法。血脑屏障(BBB)结构及功能的完整性是治疗缺血性脑卒中的关键部分,其中内皮细胞形成紧密连接(TJs),保护BBB结构与功能稳定,可有效减少脑损伤后的神经元损伤〔3〕。越来越多的研究从仅关注包括内皮细胞在内的BBB及神经元,逐渐转化为关注包括神经元、内皮细胞、周细胞、星形胶质细胞、小胶质细胞在内的神经血管单元(NVU),强调多细胞、多机制在脑卒中发生发展过程中的作用〔4〕。
缺血性脑卒中属于中医的“中风”范畴,其病理性质多为本虚标实,气虚血瘀为本病重要的病理机制之一。前期研究发现,益气活血法为名老中医治疗缺血性脑卒中的主要治法,黄芪-川芎药对为重要药物组合〔5〕。黄芪可补气健脾、益卫固表,川芎可活血行气、散瘀止痛。黄芪甲苷与川芎嗪分别作为黄芪和川芎的主要活性成分,均可有效减轻脑缺血再灌注损伤,发挥良好的神经保护作用〔6,7〕。本研究采用黄芪甲苷与川芎嗪组分配伍,探讨二者对脑缺血再灌注损伤大鼠NVU的保护作用。
1 材料与方法
1.1动物 SPF级Wistar大鼠60只,体质量250~270 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2016-0006,饲养于天津中医药大学实验动物中心。
1.2药物及试剂 黄芪甲苷(上海士峰生物科技有限公司,批号:20072518);川芎嗪(成都曼思特生物科技有限公司,批号:MUST-200514103);依达拉奉注射液(南京先声东元制药有限公司,批号:80-170510);免疫染色通透液(上海碧云天生物技术有限公司,批号P0096);冰冻切片抗原修复液(北京索莱宝科技有限公司,批号C1035);离子钙结合衔接分子(Iba)1抗体,血小板衍生生长因子受体(PDGFR)β抗体(英国Abcam公司,批号分别为ab178846,ab32570);神经元特异核蛋白(NeuN)抗体,胶质纤维酸性蛋白(GFAP)抗体(美国CST公司,批号24307,3670);番茄凝集素(LEL,美国Vectorlab公司,批号B-1175)。
1.3主要仪器 IX73型倒置荧光显微镜(日本Olympus公司);DM750M Leica显微镜(德国LEICA公司);CM-1950冰冻切片机(德国LEICA公司)。
1.4模型制备 参考Long〔8〕改良线栓法,制备大鼠大脑中动脉栓塞/再灌注(MCAO/R)模型,方法如下:予以3%异氟烷气体麻醉大鼠,并将其固定,采用多普勒脑血流仪监测大鼠局部脑血流变化;将大鼠颈部沿正中线切开,分离右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),于ECA近心端剪V形切口,然后将线栓从V形口缓慢插入大脑中动脉,观察大鼠脑血流变化。大脑中动脉栓塞1.5 h后再灌注。假手术组不做插线栓处理,其余操作同前。
1.5分组与给药 大鼠随机分为假手术组、模型组、依达拉奉组(6 mg/kg)、黄芪甲苷组(40 mg/kg)、川芎嗪组(20 mg/kg)、黄芪甲苷配伍川芎嗪(配伍用药)组(40 mg/kg+20 mg/kg),每组10只。造模后各组分别进行腹腔注射给药,每日1次,连续给药7 d,假手术组和模型组分别注射等容积生理盐水。
1.6神经功能评分 参照改良神经功能(mNSS)评分标准〔9〕,进行大鼠神经功能评分。评价包括运动测试、感觉测试、平衡测试、反射测试、异常运动。五项测试评分之和为神经功能总得分,总得分越高,大鼠神经功能缺损程度越严重。
1.7苏木素-伊红(HE)染色 大鼠脑缺血再灌注7 d后,断头取脑,脑组织使用4%多聚甲醛溶液固定48 h后,做厚度5 μm的连续冠状石蜡切片,进行常规HE染色〔10〕。将石蜡切片经脱蜡水化处理后,浸于苏木素染液5 min,盐酸乙醇分化30 s,伊红染液浸染15 s,通过乙醇梯度脱水、二甲苯透明、中性树胶封片后,于高倍镜下观察HE染色情况。
1.8尼氏(Nissl)染色 将石蜡切片经脱蜡水化处理后,浸于Nissl染液中,56℃恒温浸染1 h,使用Nissl染色分化液分化30 s,通过乙醇梯度脱水、二甲苯透明、中性树胶封片后,于高倍镜下观察Nissl染色情况。
1.9免疫荧光染色法检测NUV 大鼠脑缺血再灌注7 d后,断头取脑,将大鼠新鲜脑组织经最优切削温度(OCT)包埋后,于-20℃做厚度为20 μm的连续冠状冰冻切片。冰冻切片经通透、抗原修复、封闭后,在切片上滴加一抗,即LEL(1∶200)、Iba1(1∶400)抗体、PDGFRβ(1∶200)抗体、NeuN(1∶200)抗体、GFAP(1∶400)抗体,4℃孵育过夜;次日于37℃下避光孵育荧光二抗;使用DAPI溶液染核,滴加抗荧光淬灭封片剂,于倒置荧光显微镜下观察NVU各个组成部分的阳性细胞表达情况。
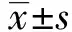
2 结 果
2.1对神经功能缺损的影响 mNSS评分结果显示,假手术组神经功能〔(0.0±0.0)分〕正常;模型组神经功能〔(13.0±1.2)分〕缺损严重;与模型组比较,依达拉奉组〔(5.5 ± 1.4)分〕、黄芪甲苷组〔(8.0 ± 1.3)分〕、川芎嗪组〔(8.2 ± 1.8)分〕、配伍用药组mNSS评分均显著降低(P<0.01),配伍用药组改善程度优于黄芪甲苷组和川芎嗪组,差异具有统计学意义(P<0.01)。
2.2对缺血半暗带组织形态的影响 HE染色结果显示,假手术组大脑皮层细胞形态规则,排列致密有序,核仁清晰可见;模型组出现大面积坏死区域,细胞排列紊乱,结构严重破坏,间质水肿,呈高度疏松筛网状结构,部分细胞核固缩;黄芪甲苷组及川芎嗪组,缺血半暗带组织形态较模型组显著改善,坏死组织疏松筛网状程度减轻,且配伍用药组改善情况明显优于单独应用,见图1。
2.3对缺血半暗带Nissl染色的影响 假手术组大鼠脑缺血半暗带Nissl体数目丰富,体积大,神经元结构正常;模型组Nissl体数量显著减少,神经元皱缩变形,结构破坏严重,排列不规则;与模型组比较,各治疗组Nissl体数目显著增加,染色加深,体积增大,神经元结构改善,且配伍用药组效果优于黄芪甲苷或川芎嗪组,见图2。
2.4对NVU各个组成部分的影响
2.4.1对NVU内皮细胞损伤的影响 假手术组内皮细胞表达丰富,血管表现为连续的线条状,分布密集;与假手术组比较,模型组内皮细胞表达显著下调(P<0.01),血管分布稀疏,连续性差;与模型组比较,黄芪甲苷及川芎嗪可显著上调内皮细胞表达(P<0.05,P<0.01),改善血管形态,且配伍用药组改善程度优于单独应用(P<0.01),见图3,表1。
2.4.2对NVU周细胞损伤的影响 与假手术组比较,模型组脑缺血半暗带PDGFRβ阳性表达显著下调(P<0.01),周细胞损伤严重;与模型组比较,各用药组显著改善脑缺血半暗带周细胞损伤,上调PDGFRβ阳性表达(P<0.01),且配伍用药组疗效显著优于单独应用(P<0.01),见表1,图4。
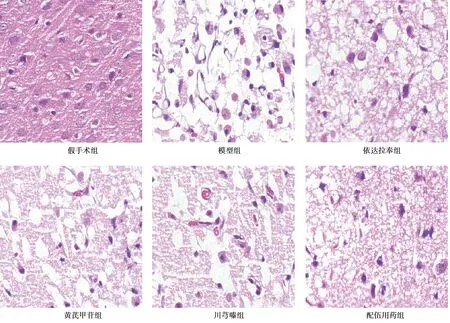
图1 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带组织形态改变的影响(HE染色,×200)

图2 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带Nissl染色的影响(Nissl染色,×200)

图3 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带内皮细胞表达的影响(IF,×200)
表1 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带NVU组成部分的影响

图4 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带PDGFRβ表达的影响(IF,×200)
2.4.3对NVU神经元损伤的影响 假手术组NeuN阳性细胞丰富,分布均匀;与假手术组比较,模型组NeuN阳性细胞数明显减少(P<0.01),神经元排列紊乱,分布稀疏;与模型组比较,黄芪甲苷及川芎嗪干预后,NeuN阳性细胞数量显著增加(P<0.01);配伍用药组NeuN阳性细胞数目显著多于黄芪甲苷组、川芎嗪组(P<0.01),见表1,图5。
2.4.4对NVU星形胶质细胞活化的影响 与假手术组比较,模型组大鼠脑缺血半暗带GFAP阳性细胞增生肥大,阳性细胞数目增加(P<0.01),星形胶质细胞过度活化;与模型组比较,黄芪甲苷及川芎嗪显著抑制了GFAP阳性细胞的增生肥大,下调活化细胞数目(P<0.01),且配伍用药组疗效优于单独应用(P<0.01),见表1,图6。

图5 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带神经元表达的影响(IF,×200)

图6 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带GFAP表达的影响(IF,×200)
2.4.5对NVU小胶质细胞极化的影响 假手术组小胶质细胞呈胞体较小、分枝较长的分枝状;与假手术组比较,模型组大鼠脑缺血半暗带Iba1阳性细胞胞体增大,突起变短,呈阿米巴状,表达数明显升高(P<0.01),小胶质细胞极化程度高;与模型组比较,黄芪甲苷及川芎嗪显著抑制小胶质细胞极化,改善阿米巴状变化,下调阳性细胞表达数(P<0.01),且配伍用药效果优于黄芪甲苷或川芎嗪单用(P<0.01),见表1,图7。
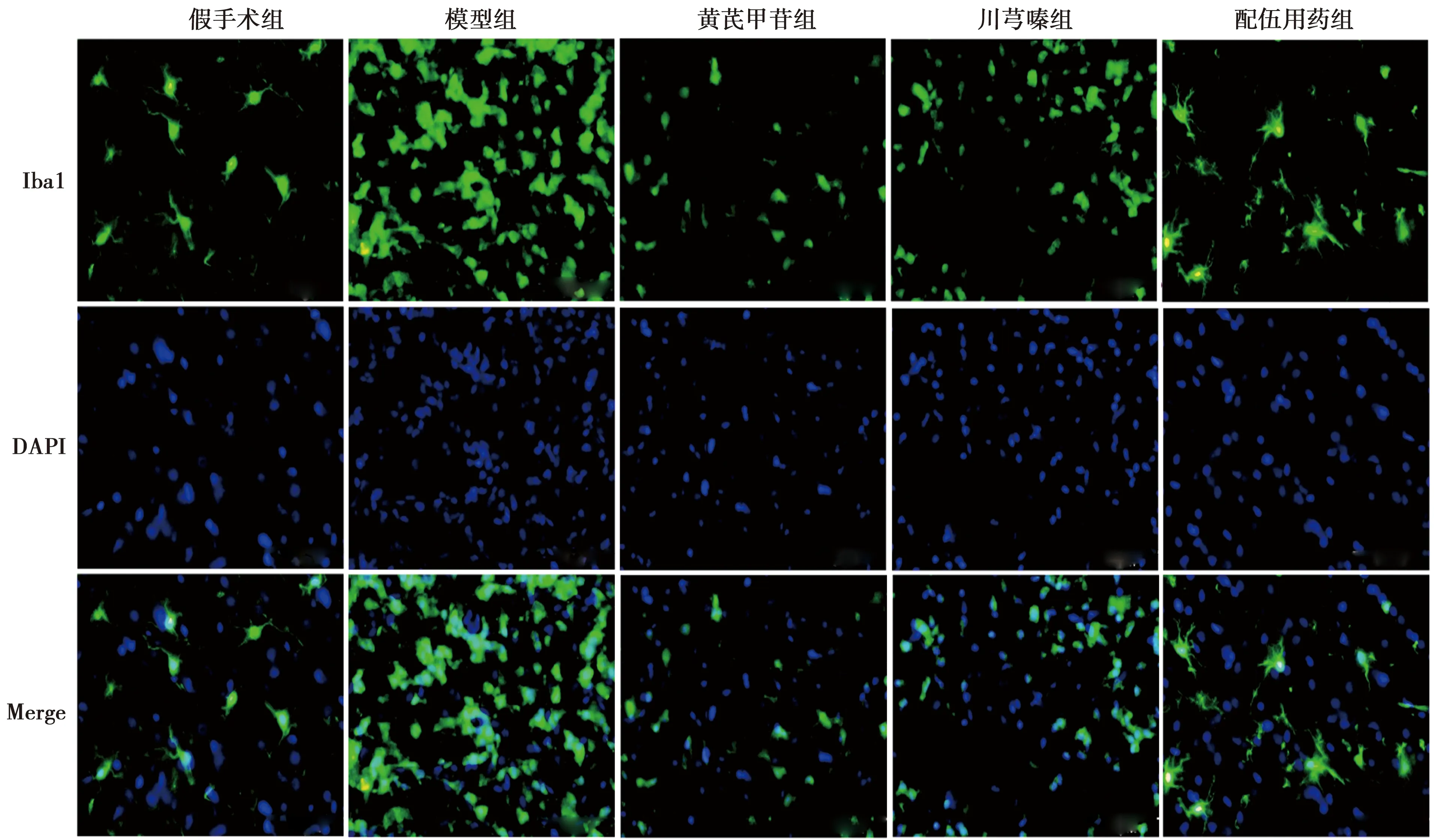
图7 黄芪甲苷与川芎嗪对脑缺血再灌注损伤大鼠缺血半暗带Iba1表达的影响(IF,×200)
3 讨 论
NVU由神经元、内皮细胞、周细胞、星型胶质细胞、小胶质细胞组成,随着脑卒中的治疗策略由仅关注“神经保护”转变为关注脑卒中病程涉及的“多细胞保护”〔11〕,NVU在脑卒中恢复中发挥的作用越来越受到重视〔12〕。对NVU所有组成部分的关注、对多细胞间信号及细胞与细胞外基质之间的信号传导的研究,对于阐明缺血性脑卒中至关重要。中药具有多组分、多靶点、多机制的作用特点,符合NVU多细胞的结构、功能特点及“多细胞保护”治疗策略。
NVU强调多细胞在结构与功能上的相互支持,其中内皮细胞是脑微血管的主要组成部分,其结构及功能的完整直接影响脑部微循环,在脑缺血再灌注损伤后神经元的恢复过程中发挥重要作用;周细胞覆盖于微血管内皮细胞周围,并嵌入到脑血管之外的基底膜〔13〕,与内皮细胞共同参与维持BBB结构与功能,并能调节毛细血管收缩和舒张,参与调节血管生成及免疫反应等。周细胞损伤后,BBB结构和功能出现异常〔14〕,可引起凝血酶原、纤维蛋白原等血清蛋白及神经元或血管损伤后释放的其他毒性物质进入脑实质,并促进小胶质细胞极化水平,参与调节神经炎症反应〔15〕;小胶质细胞作为神经系统中重要的免疫细胞,维持中枢神经系统内微环境稳态,参与炎症级联反应,在脑缺血再灌注损伤后免疫和炎症反应中起着关键的调节作用〔16〕,有研究〔17〕认为极化后的小胶质细胞由分枝状转变为“阿米巴状”,可释放炎症介质并募集炎症细胞,加剧脑缺血再灌注损伤;也有研究〔18〕发现小胶质细胞具有高度可塑性,受特定的微环境刺激可呈现不同表型,进而发挥损伤和修复的双重功能;星形胶质细胞是胶质细胞另一重要成员,作为中枢神经系统最丰富的神经胶质细胞,可参与维持离子稳态、神经递质清除及神经元的能量供应,与突触在结构上有密切联系〔19〕,并且与神经元及血管细胞连接,以提供对大脑更多功能的广泛控制。星形胶质细胞不仅在生理条件下参与调节神经元功能,并对病理条件下脑功能发挥重要的调节作用,脑缺血再灌注损伤可激活星形胶质细胞,由静息状态向活化状态转变,活化的星形胶质细胞称之为反应性星形胶质细胞,出现胞体肥大、中间丝蛋白表达水平增高等细胞形态和功能的变化,过度活化的星形胶质细胞在脑缺血再灌注损伤后引发的神经炎症反应中发挥重要的调节作用〔20〕。中医认为,气虚血瘀是缺血性脑卒中的主要病理机制之一〔21〕,益气活血法可显著改善缺血性脑卒中神经功能损伤,但对NVU多细胞保护作用及机制尚不明确。益气活血代表中药黄芪及川芎已广泛应用在脑卒中的临床治疗中,黄芪为补中益气要药,《医学衷中参西录》曰:“能补气,兼能升气”,其主要有效成分黄芪甲苷可通过调节线粒体能量代谢、抑制细胞凋亡、促进血管新生等多个环节改善脑缺血再灌注损伤〔22〕;川芎为“血中之气药”,并能“上行头目”,《神农本草经》言其“主中风入脑,头痛”,《长沙药解》言其能“行经脉之闭塞”,研究表明〔23〕,其主要有效成分川芎嗪可通过抑制神经炎症反应、调节血小板黏附、促进神经再生等途径改善缺血性脑损伤。
本研究通过线栓法诱导大鼠脑缺血再灌注损伤,采用黄芪甲苷及川芎嗪组分配伍应用。黄芪甲苷及川芎嗪干预后,可显著改善脑缺血再灌注损伤大鼠神经功能缺损及缺血半暗带组织形态学改变,改善脑微血管内皮细胞及周细胞损伤,抑制星形胶质细胞过度活化及小胶质细胞极化程度,促进神经元损伤修复,进而改善MCAO/R大鼠NVU结构及功能,且二药配伍应用治疗效果优于单独应用。
