基于金纳米线构建电化学传感器间接检测碱性磷酸酶活性
2022-11-10余婷婷杨海峰
余婷婷,王 敏,文 颖,杨海峰
(上海师范大学化学与材料科学学院,上海 200234)
0 引言
碱性磷酸酶(ALP)是一类可催化磷酸单酯水解为无机磷酸盐的酶,可以特异性识别多种底物分子[1-3].ALP几乎存在于所有生物体,在骨骼、肝、肾、肠和胎盘[2,4]等各种组织中都可以发现调节磷酸化相关的生化行为,并且ALP是常规临床测试中最常检测的酶之一[1].研究证明ALP与乳腺癌、前列腺癌、肝功能不全、骨病和糖尿病等许多疾病密切相关,因此ALP可以作为诊断此类疾病的重要生物标志物[5-6].开发简单且灵敏的方法来分析检测ALP的活性至关重要.
近年来,已开发出多种方法来测定ALP的活性,包括荧光法[7]、电化学方法[8]、比色法[9]和表面增强共振拉曼散射法(SERRS)[10]等.例如,WANG等[11]开发了基于聚阳离子诱导的非共价苝探针自组装的ALP活性测定的无标记荧光开启策略.ZHU等[12]设计了一种无标记发夹型荧光生物传感器,通过氧化石墨烯设计传感器来检测ALP活性.尽管上述检测方法具有其自身的优势,但仍需要精密的光学仪器,这限制了它们在实际ALP活性测定中的应用.相比于光学方法,电化学方法具有响应速度快、灵敏度好、成本低,以及可微型化的显著优势,并已被用于ALP活性的检测[13].例如,SERRA等[14]通过使用电流型石墨-特氟隆复合酪氨酸酶生物传感器实现了ALP的快速监测.然而,这种电化学方法需要固定化电极表面上的DNA探针或去磷酸化底物,以及其他用于构建电化学生物传感器的繁琐过程.因此,迫切需要开发更简单、更快速的无固定化电化学方法来测定ALP活性.
贵金属(特别是金)因为其独特的光、电、催化等方面的优势,使贵金属纳米材料成为众多领域的研究热潮.金纳米颗粒的低电阻率和化学惰性以及特殊的表面等离子共振(SPR)效应让一维的纳米结构备受研究者关注.近几年,金纳米线(AuNWs)在合成方法上的发展取得了重大突破,如经常使用的模板法和湿化学方法.在模板法里又可以分类为硬模板法和软模板法,例如有以DNA为模板[15],还有以多孔阳极氧化铝和介孔二氧化硅(SiO2)为模板[16].虽然模板法的优势是操作简单、产率高和低成本,但是制备的产物AuNWs如何与模板成功分离一直未得到很好的解决.在湿化学方法中有种子调控生长法[17]和有机溶剂合成法[18].其中,种子调控法分为种子制备和生长溶液制备两个过程,该方法被广泛应用于金纳米棒的制备.
本文作者设计了一种无标记的电化学传感器间接检测ALP,在金纳米线/氧化铟锡(AuNWs/ITO)导电玻璃电极上组装上铜离子(Cu2+),利用焦磷酸根阴离子(P2O74-,PPi)可以竞争性结合Cu2+,使其电化学信号降为稳定值,由于PPi是ALP的底物,加入ALP后,PPi水解,Cu2+被释放出来,使电极表面Cu2+信号上升,通过Cu2+的信号可间接定量ALP的活性.构建的Cu2+-AuNWs/ITO传感器可以用来选择性定量检测ALP活性.
1 实验部分
1.1 实验仪器
CHI660C电化学工作站(中国上海晨华仪器有限公司);电化学检测是标准的三电极系统:AuNWs/ITO作为工作电极,铂(Pt)丝作为惰性辅助电极,饱和甘汞电极(SCE)作为参比电极;采用CHI660D在物质的量浓度均为5.0 mmol·L-1的铁氰化钾/亚铁氰化钾(K3[Fe(CN)6]/K4[Fe(CN)6]),包含0.1 μmol·L-1氯化钾(KCl)的电解质溶液中记录不同电极的阻抗谱图.场发射扫描电子显微镜(FE-SEM,Hitachi S-4800);能谱能量色散型X射线荧光光谱仪(EDX,JSM-6700F);X射线衍射仪(XRD,D/Max-2000 VPC).
1.2 实验试剂
四水合氯金酸(HAuCl4·4H2O)、三水柠檬酸三钠、硫酸(H2SO4)、双氧水(H2O2)、3-氨基丙基三乙氧基硅烷(APTES,质量分数≥98%)、4-巯基苯甲酸(4-MBA,质量分数≥99%)、磷酸盐缓冲溶液(PBS)和抗坏血酸(AA)均为分析纯,购于Sigma-Aldrich公司.丙酮、异丙醇和乙醇均为分析纯,购于Adamas公司.磷酸氢二钠(Na2HPO4)、硝酸铜、焦磷酸钠、硫酸镁、氯化钾和氯化钙均为分析纯,购于Shanghai Richjoint Chemical Reagents公司.三磷酸腺苷(ATP)、ALP、血红蛋白、牛血清蛋白和葡萄糖氧化酶均购于麦克莱恩生物技术公司.所有化学品都直接使用,没有任何进一步纯化.整个实验所用溶液均用去离子水(电阻率为18.25 MΩ·cm)制备.
1.3 修饰电极的制备
1.3.1 金纳米溶胶的制备
将装有100 mL去离子水的锥形瓶置于磁力搅拌器上,然后量取0.1 mol·L-1HAuCl4于瓶中,加热至微沸状态,最后滴加2.0 mL,质量分数为1%的柠檬酸三钠.几分钟后观察到AuNPs的形成,溶液从淡黄色变为无色,再变成红色[19].
1.3.2 AuNWs/ITO电极的制备
依次使用丙酮、异丙醇和去离子水对ITO玻璃超声10 min,再在80℃下烘干1 h.将ITO玻璃切成面积为1 cm×1 cm的小板.然后,将上述ITO板先用食人鱼溶液(体积比为V(H2SO4)∶V(H2O2)=7∶3)处理30 min,以形成带有羟基的亲水表面.将处理过的ITO板浸入3-氨基丙基三乙氧基硅烷/乙醇(APTES/EtOH)溶液(体积比为V(APTES)∶V(EtOH)=5∶100)中2 h,以进行氨基的改性,用乙醇和水清洗ITO玻璃3遍及以上,以去除过量的APTES.将氨基改性的ITO板在含有金种子的溶液中浸泡1 h,用水洗涤以除去过量的金种子.最后,将组装金种子的ITO放入乙醇/水溶液(体积比为V(EtOH)∶V(H2O)=3∶1),包含1.6 mol·L-1HAuCl4和0.01 mol/L 4-MBA溶液中,并加入0.1 mol·L-1AA溶液作为还原剂,以制备AuNWs.用乙醇冲洗最终产物,即获得AuNWs/ITO,并用氮气(N2)吹干.
1.3.3 制备Cu2+-AuNWs/ITO电极
将制备好的AuNWs/ITO电极放入一定浓度的Cu2+溶液进行自组装1 h,然后用蒸馏水洗去结合不牢固的Cu2+,重复操作3次,并在N2吹干后置于室温保存.
1.4 ALP电化学检测机理
利用Pt丝电极、饱和甘汞电极、Cu2+-AuNWs/ITO电极作三电极系统完成ALP(30~60 units·mg-1)的电化学检测.首先,将Cu2+-AuNWs/ITO电极置于一定浓度的PPi溶液中,此时Cu2+电化学信号会下降到稳定;再向PPi溶液中加入分装好的不同浓度的ALP时,由于ALP水解其底物PPi,并释放出Cu2+,此时电化学信号又上升;最后,根据Cu2+的信号来间接检测ALP的活性,如图1所示.

图1 Cu2+-AuNWs/ITO复合传感器的检测原理示意图
2 结果与讨论
2.1 Cu2+-AuNWs/ITO电极的形貌表征
组装在AuNWs/ITO电极后仍能看到AuNWs均匀分布在电极表面,图2是制备的Cu2+-AuNWs/ITO电极的SEM图,可以看出当Cu2+的组装不影响AuNWs的形貌,组装原理是Cu2+可以跟AuNWs/ITO电极上的4-MBA螯合.从图2(d)~2(f)中可以看出Au、硫(S)和Cu元素均匀分布在电极表面,但Cu2+含量较少,原子含量低于0.1%.

图2 Cu2+-AuNWs/ITO的形貌和元素含量表征.
2.2 不同修饰电极的电化学表征
为了验证传感器成功组装上Cu2+,分别获得了裸ITO,AuNWs/ITO和Cu2+-AuNWs/ITO在0.1 mol·L-1三羟甲基氨基甲烷盐盐酸(Tris-HCl)(pH=6.0)中的循环伏安图,扫描速率为50 mV·s-1,如图3所示.裸ITO和AuNWs/ITO电极在Tris-HCl中无显著的氧化还原峰,而Cu2+-AuNWs/ITO电极可以观察到在0.3 V左右的氧化峰和0.1 V左右的还原峰,这是因为Cu2+在电极表面发生了氧化还原,证明Cu2+组装成功.
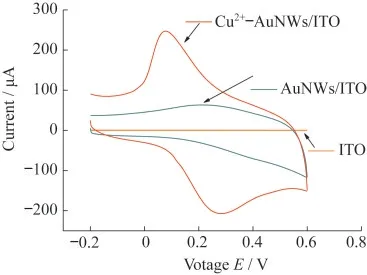
图3 裸ITO,AuNWs/ITO和Cu2+-AuNWs/ITO在0.1 mol·L-1 Tris-HCl(pH=6.0)中的循环伏安图(扫描速率为50 mV·s-1)
2.3 实验条件的优化
为了提高Cu2+-AuNWs/ITO传感的检测选择性和灵敏度,对AuNWs的生长时间、Cu2+的物质的量浓度、PPi的物质的量浓度、Cu2+与PPi的反应时间和pH进行了优化.
考察了该体系中AuNWs生长时间和不同Cu2+物质的量浓度(10,75,250,500和750 μmol·L-1)的影响,如图4(a)所示.结果表明:在生长时间为70 min时,制备的Cu2+-AuNWs/ITO电极在Tris溶液中响应最好,所以选择70 min作为最优时间.当组装时Cu2+浓度增加,电极电流响应逐渐变大,但当增加到一定程度时保持不变,这是因为AuNWs/ITO电极上修饰的4-MBA达到饱和,所以其可以与一定浓度Cu2+螯合.最终选择组装Cu2+的物质的量浓度为500 μmol·L-1,如图4(b)所示.
图4(c)和(d)显示了在不同物质的量浓度(0,1,5,10,25和50 μmol·L-1)PPi溶液中制备的Cu2+-AuNWs/ITO电极的电化学响应.从图4(c)的微分脉冲伏安法(DPV)图可以清晰地看出随着PPi物质的量浓度的变化,峰值也随之变化.而图4(d)中可以观察到随着PPi溶液物质的量浓度的增加,Cu2+的电化学响应逐渐减小,这是因为PPi可以竞争性结合Cu2+导致电化学信号下降,考虑到后续实验,选用最优条件为50 μmol·L-1.
进一步考察了Cu2+与PPi溶液孵育时间,结果显示时间在0~20 min内信号一直处于下降趋势,到30 min以后基本保持不变,证明Cu2+-AuNWs/ITO电极上的Cu2+被PPi竞争下来需要一定时间,如图4(e)所示.最后选择30 min为最佳孵育时间.考察了制备的Cu2+-AuNWs/ITO电极在pH为4.0~8.0区间内的峰值电流变化,如图4(f)所示.随着pH逐渐增加,Cu2+峰电流先增加后下降.因此,选择6.0选为最优pH.加入一定浓度ALP水解PPi后,随着孵育时间的延长峰电流也增加,说明ALP水解程度也在增加,40 min达到最大值.

图4 氧化电流随制备Cu2+-AuNWs/ITO的条件变化图.(a)不同AuNWs生长时间和(b)不同物质的量浓度(10,75,250,500和750 μmol·L-1)Cu2+的电化学响应;(c),(d)不同物质的量浓度(0,1,5,10,25和50 μmol·L-1)PPi溶液的电化学响应;(e)不同的Cu2+和PPi孵育时间制备的传感器的性能;(f)不同pH值下Cu2+-AuNWs/ITO的峰电流值响应图
2.4 对ALP活性的线性考察
在最佳检测条件下,通过DPV研究了Cu2+-AuNWs/ITO电极对ALP活性检测的分析性能.如图5(a)所示,当逐渐增大ALP的单位浓度,DPV电流响应值逐渐增大.图5(b)为相应的标准线性图,可以看出基于Cu2+-AuNWs/ITO的传感器,在ALP单位浓度为60~180 U·L-1范围内线性响应良好,线性回归方程可以表示为:I=0.37CALP(其中,I表示不同ALP的单位浓度下的电流密度,单位为μA;CALP表示ALP的单位浓度,单位为U·L-1;相关系数R2=0.998),检测限为12.75 U·L-1.与其他文献中利用荧光法[20]测定的线性范围(1~50 U·L-1)相比,该传感器线性范围更宽,说明基于Cu2+-AuNWs/ITO的ALP传感器具有优异的性能.
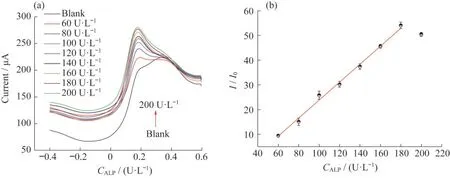
图5 Cu2+-AuNWs/ITO电极对ALP活性检测的分析性能图.(a)Cu2+-AuNWs/ITO电极在不同单位浓度的ALP的DPV响应图(从黑色到绿色的曲线分别为0,60,80,100,120,140,160,180和200 U·L-1);(b)DPV峰值电流与ALP单位浓度的校准曲线图(I0表示空白对照的电流密度)
2.5 传感器的抗干扰性考察
由于在实际样品的检测过程中常存在其他活性物质的干扰,因此需要对制备的传感器进行抗干扰能力的实验.在0.1 mol·L-1Tris-HCl溶液中分别加入50 μmol·L-1PPi,以及物质的量浓度均为500 μmol·L-1的磷酸一氢根(H2PO4
-)、磷酸二氢根(HPO4
2-)和磷酸根(PO43-),电化学响应图如图6(a)所示.可以看出,H2PO4-,HPO42-和PO43-的存在不会明显竞争Cu2+,所以同类磷酸盐干扰较小,其原因可能是Cu2+可以与焦磷酸根离子形成螯合物且结合常数大(结合常数为12.45).在特定底物为PPi的条件下,不同类的干扰物质的影响如图6(b)所示,干扰物分别为葡萄糖氧化酶(GOx,500 U·L-1)、血红蛋白(Hb,1 μmol·L-1)、牛血清蛋白(BSA,1 μmol·L-1)、ATP(1 μmol·L-1)、镁离子(Mg2+,0.1 mmol·L-1)、钙离子(Ca2+,0.1 mmol·L-1)和钾离子(K+,0.1 mmol·L-1),结果显示干扰物的信号远低于ALP(200 U·L-1),证明ALP对PPi的催化作用是有专一性的.

图6 抗干扰实验图(.a)PPi和磷酸盐相关阴离子(H2PO4-,HPO42-和PO43-)在Cu2+-AuNWs/ITO上的电化学响应;(b)其他干扰物(GOx,Hb,BSA,ATP,Mg2+,Ca2+和K+)的影响
2.6 实际样品的分析检测
为了考察基于Cu2+-AuNWs/ITO的传感器在血清样检测中的可靠性,通过测定加标回收率对稀释后血样中的ALP活性进行检测,回收率在100.9%~101.0%,相对标准偏差(RSD)为1.3%~4.8%.结果表明制备的传感器可成功分析样品中ALP活性.
3 结论
本研究构建了一种基于Cu2+-AuNWs/ITO的传感器用于间接无标记定量测定ALP.利用PPi竞争性结合Cu2+使其电化学信号降为稳定值,通过ALP对底物PPi的水解释放Cu2+恢复电化学信号,既利用了酶的专一性又实现了无标记检测酶的活性.制备的Cu2+-AuNWs/ITO无标记传感器抗干扰性良好,对ALP活性检测范围为60~180 U·L-1,可用于实际血清样品中ALP加标检测,并能获得较好的回收率.
