共价有机框架的合成及其在生物医学领域应用研究进展
2022-11-10黎婧怡成雨纯
黎婧怡,成雨纯,谢 辉,陈 楠
(上海师范大学化学与材料科学学院,上海 200234)
0 引言
共价有机框架(COFs)是由碳(C)、氢(H)、氧(O)、硼(B)和氮(N)等轻元素通过共价键而合成的一类多孔结晶性有机聚合物[1-5].其共价连接的分子结构单元在网状化学的引导下可延伸至二维(2D)或三维(3D).COTE等[6]在2005年首次报道了通过缩合反应合成2种2D COFs的方法,随后,不同种类的COFs及其衍生物被设计和合成.COFs具有结构稳定、密度低、比表面积大、结构可设计、孔径大小均一且可调节、易于合成后修饰等诸多优点,因而被开发应用于多个领域,例如气体吸收和分离、催化、传感、光电、质子传导、能量存储等[1,7-11].作为一类生物兼容性良好的多孔材料,COFs被认为在生物传感、抗菌以及肿瘤治疗等生物医学研究中具有潜在应用前景.与模块化多孔晶体材料的另一个主要成员,即金属有机框架(MOFs)相比较[12],COFs具有一些独特的优势.首先,更稳定的共价化学键提高了COFs在复杂生物环境中的稳定性,而无金属离子释放则降低了其细胞毒性.其次,通过预先设计,可以很方便地合成尺寸和形状可控的纳米结构[13],均匀的纳米孔和开放的通道使COFs可以更有效地搭载生物活性物质,并为其提供扩散通道.经过研究人员的不懈努力,COFs在生物医学领域的应用已经取得了实质性的进展,本研究主要综述了COFs的制备方法及其在生物学应用方面的研究进展.
1 COFs的制备方法
形成高度有序和结晶的COFs的关键是共价键形成过程中对于热力学平衡的调节,研究者们往往根据后续应用所需的材料孔隙率以及尺寸结构等因素来选择COFs材料合成所需的结构单元,并设计合成路线.目前已开发了多种COFs的合成方法,其中较为常用的方法包括:溶剂热合成法、离子热合成法、机械化学合成法以及界面合成法等.
1.1 溶剂热合成法
溶剂热合成法因其合成方式简单、制备的材料颗粒大小和形貌可控等优点,已成为目前制备COFs的常用方法之一.例如XU等[14]通过2,4,6-三(4-氨基苯氧基)-1,3,5-三嗪(TPT-NH2)和2,4,6-三(4-甲酰基苯氧基)-1,3,5-三嗪(TPT-CHO)以及对苯二甲醛在溶剂热条件下进行缩合反应,合成了2种新型的2D COFs(TPT-COF-1和TPT-COF-2),后续实验表明,所制备的TPT-COF-1具有高结晶度和较大比表面积(1 589 m2·g-1),如图1(a)所示.此外,XIONG等[15]以2,6-二氨基对苯二酚(DAAQ)和1,3,5-三甲基间苯三酚(TFP)为原料,采用溶剂热法合成了COFDAAQ-TFP电致变色薄膜.该2D COF相邻层之间堆叠的π轨道以及垂直于堆叠方向的纳米孔,为电致变色过程中的电荷转移提供了方便.最近,YANG等[16]提出了一种在溶剂热合成过程中加入表面活性剂,并与酸调节相结合的策略,用于设计β-酮烯胺连接的COFs,成功制备了直径低至20 nm、长度高达几微米的COFs纳米纤维,以及厚度为18 nm的COFs纳米板.
溶剂热合成法的反应条件高度依赖于构建块的溶解性、反应性以及反应的可逆性.此外,反应时间、反应温度、溶剂条件和催化剂浓度也是溶剂热法制备晶态多孔COFs的关键影响因素,诸多复杂因素的影响使该方法耗时较长,且较难用于COFs的大规模生产.
1.2 离子热合成法
应对大规模的工业生产和应用需求,开发一种简单、温和、绿色的COFs材料合成路线是非常必要的.离子液体(IL)是一种低熔点的有机盐,由液态离子组成,具有低蒸汽压、不可燃、液体范围宽、对有机和无机化合物溶解性好和结构可设计等优势,因而作为合成晶态材料的一种绿色、安全的反应介质受到了广泛的关注.例如,KUHN等[17]首次通过简单的策略,以离子液体为绿色溶剂,制备了一系列含COFs的3D离子液体(3D-IL-COFs),如图1(b)所示.这些3D-IL-COFs显示出高结晶度、良好的BET表面积和对CO2/N2和CO2/CH4具有吸附选择性.
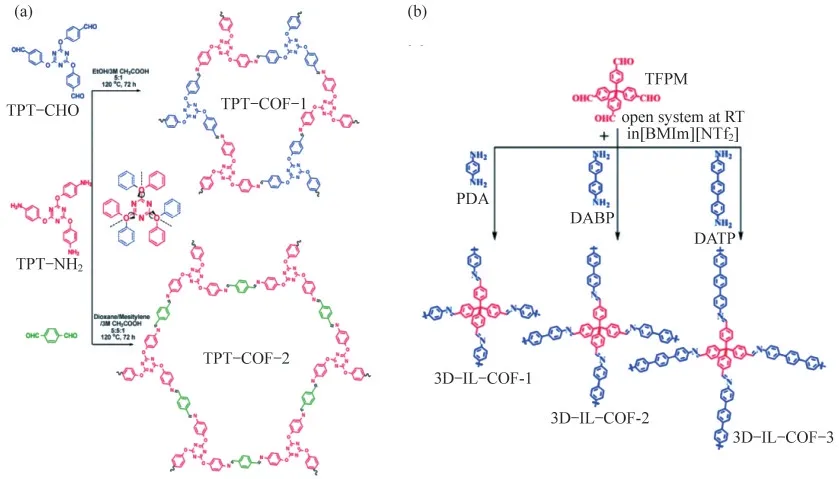
图1 COFs的合成方法示意图.
1.3 机械化学合成法
考虑到溶剂热法的反应条件较为复杂,而通过简单、经济和环境友好的途径构建的机械化学合成法可以克服以上方法的局限性.例如,BISWAL等[18]采用常温、无溶剂、化学研磨的方法合成了3种具有良好热稳定性和化学稳定性的网状COFs.在无溶剂的条件下,利用席夫碱醛-胺缩合反应,将1,3,5-三甲酰基间苯三酚(TP)和对苯二胺(PA-1)放置在研钵中,通过在室温下用研杵研磨得到COFs,如图2(a)所示.所合成的COFs结晶度和孔隙率适中,在沸水、酸和碱中均具有显著的稳定性,且相较于溶剂热法所合成的母体COFs,该COFs的层剥离与COFs的形成可以同时发生.机械化学合成法的优点在于简单、安全、环保,但采用该方法合成的COFs结晶度和孔隙率略差.
1.4 界面合成法
大多数传统的COFs合成方法对材料的形态控制不佳,而界面合成策略是一种制备COFs薄膜并能同时控制其厚度的新颖方法.例如,DEY等[19]在环境条件下利用液-液界面作为模板,制备了厚度50~200 nm高度结晶的COFs.该薄膜是在没有任何支撑的情况下以独立形式生长而成的,表现出显著的溶剂渗透和溶质排斥性能,可以进一步转移到任何需要的基底上.而后MATSUMOTO等[20]将1,3,5三(4-氨基苯基)苯(TAPB)和对苯二甲醛(PDA)合成亚胺连接的TAPB-PDA COFs.在路易斯酸催化剂(Sc(OTf)3)催化下,TAPB-PDA COF通过界面聚合形成的自支撑膜.如图2(b)所示.这种方法合成的亚胺连接的COFs连续膜,其横向尺寸由聚合容器的尺寸决定,而膜的厚度则由初始单体的浓度控制,这种方法可以制备厚度4~50 nm的COFs薄膜,实现了纳米尺度COFs的精确控制与合成.
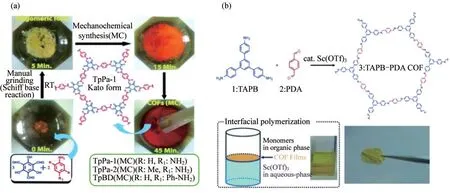
图2 利用机械化学合成法和界面合成法制备COFs.
综上所述,溶剂热合成法运用比较广泛,但难以用于大规模生产;离子热合成法实现了COFs材料的大规模生产,并且该方法合成简单、温和;机械力化学合成法合成方式简单,但合成的COFs结晶度稍差;界面合成法克服了传统COFs合成方法对其形态难以控制的缺点,实现了COFs薄膜制备的同时,并实现了对其厚度的控制.
2 COFs的生物学应用
COFs材料的化学性质稳定,可设计性强,因而成为了材料科学的研究热点.随着相关合成策略的发展和丰富,COFs的种类也更加多样化.由于COFs具有低的骨架密度、高的热化学稳定性、大的比表面积及孔隙率、可控的化学物理性质、开放的孔道结构等特点,在催化技术、气体分离及储存、光电材料、环境与能源等诸多领域中展现出广阔的应用前景.然而COFs在生物医药领域的应用研究还处于起步阶段.与其他的多孔有机骨架材料,如MOFs等相比,COFs具有更好的稳定性、不含有毒金属离子等优势[21],使其在生物学应用方面具有良好的潜力,并已经被尝试应用于生物传感、抗菌制剂、抗肿瘤治疗等领域.以下重点介绍其在生物传感器以及肿瘤治疗方面的应用.
2.1 生物传感器
由于COFs具有良好的生物相容性、较低的细胞学毒性,且在水溶液中保持高稳定性,在生物传感领域得到广泛应用.与其他晶体型多孔材料相比,COFs的优势之一在于能通过合成改性后引入不同的官能团,从而赋予其独特的功能,如催化活性.研究者们基于COFs自身的催化活性,探索了其在生物传感领域的应用.例如,WANG等[22]采用合成后改性的方法,合成了一种基于铁卟啉的COFs材料(Fe-COF),如图3(a)所示.Fe-COF具有很强的辣根过氧化物酶(HRP)拟酶活性,能在3,3′,5,5′-四甲基联苯胺(TMB)存在条件下,用于过氧化氢(H2O2)的比色分析和检测,并获得了较宽的检测范围和较低的检测限.当Fe-COF与葡萄糖氧化酶(GOx)联用时,进一步实现了对葡萄糖的比色分析和定量测定,其检测范围为5~350 μmol·L-1,检测极限为1.0 μmol·L-1.该Fe-COF具有制备简单、稳定性好和催化活性高的优点,从而被成功地应用于人血清样品中葡萄糖的测定.
COFs良好的生物相容性可以为生物分子提供合适的微环境,且COFs的多孔结构使其具有更高的表面自由能和更大的活性比表面积,有助于实现对目标分子的高效负载.此外,COFs的有序晶体结构可以加速电荷载流子的迁移,改善生物传感器的响应速率.因此,COFs与电化学生物传感器的交叉融合为多种生物分子的检测提供了新的策略.例如,FENG等[23]设计了一种HRP-Ab2-Au-COF复合探针,如图3(b)所示,用于心肌钙蛋白I(cTnI)的高灵敏度电化学测定.COF的高孔隙率确保了HRP的高负载,COFs表面修饰的金纳米粒子既为抗体Ab2提供了连接平台,又提高了COFs的电导率.在H2O2和HRP的协同作用下,溶液中的对苯二酚(HQ)被催化氧化为苯醌(BQ),然后BQ在电极表面还原,产生电化学信号.基于H2O2-HRP-HQ信号放大系统,该cTnI生物传感器的线性响应范围为5 pg·mL-1~10 ng·mL-1,检测限为1.7 pg·mL-1,并在实际样品测试中表现出良好的回收率和重现性.
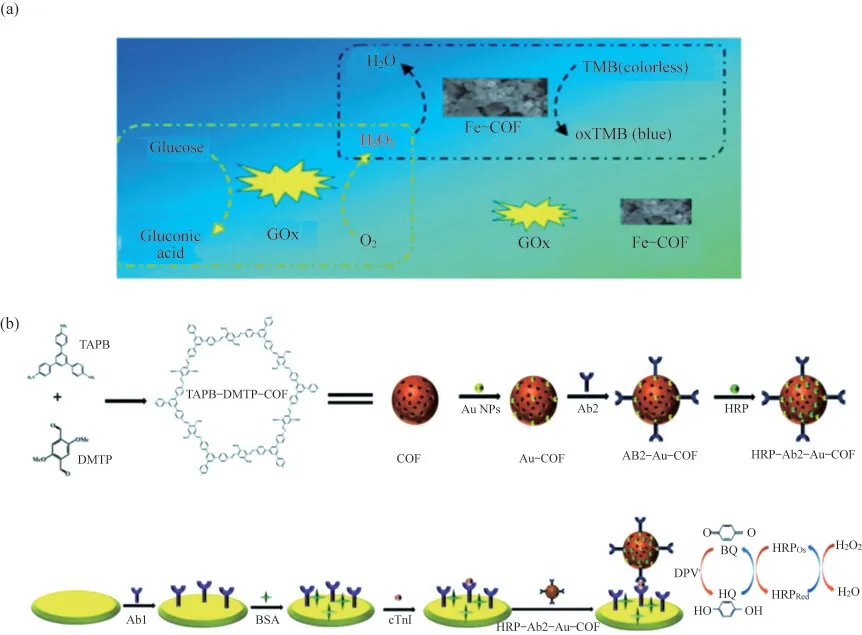
图3 COFs在生物传感方面的应用.
2.2 肿瘤治疗
除了用于构建生物传感器外,COFs在发展肿瘤治疗新方法及其应用方面也非常具有潜力,其被认为是用作药物载体、光热疗法(PTT)、光动力疗法(PDT)和构建肿瘤协同治疗平台的优良材料.
2.2.1 药物递送
化疗是最广泛使用的肿瘤治疗方法,特别是针对有扩散和转移趋势的肿瘤.许多小分子化疗药物[24-25],如阿霉素(DOX)、顺铂和紫杉醇等,肿瘤靶向能力往往较差,并伴随较为明显的副作用.纳米药物递送系统被证明具有较高的载药量、精确的靶向性以及可控的副作用,对改进传统化疗具有重要意义.COFs以其高比表面积、可调节的孔形状、大孔隙率、良好的生物相容性、较好的生物降解性和易于改性等优点,在药物传递领域引发了广泛关注.例如,LIU等[26]以1,3,5-三(4-氨基苯基)苯(TAPB)和2,5-二甲氧基对苯二甲醛(DMTP)为原料,首次用一锅法成功地实现了阿霉素(DOX)的原位包埋,合成了DOX@TAPBDMTP-COF(DOX@COF),如图4(a)所示.这一简单而快速的载药策略不仅缩短了药物摄取的时间,也实现了较高的载药效率(负载率为32.1%).DOX@COF表现出pH响应释放的特性,能够在弱酸性的肿瘤微环境中有效释放DOX.体外和体内实验均证明其具有良好的生物相容性和较高的肿瘤抑制效率.
2.2.2 PDT
PDT是指将光敏剂(PSs)递送至肿瘤部位,利用特定波长的光进行激发,将氧激发成单线态氧(1O2),从而导致肿瘤细胞坏死和凋亡的一种非侵入性治疗方法[27].由于大多数传统的PSs在水中的溶解性很差,其PDT效果通常受到细胞摄取率低的限制.将PSs修饰或负载于纳米载体上可以克服这一缺陷,从而改善PDT抗肿瘤治疗的效果.COFs非常适合作为PSs的纳米载体,用作PDT治疗,一些新型的COFs材料已经被合成,并应用于肿瘤的PDT.例如,CHEN等[28]设计并合成了一类基于碳点的纳米级COFs.该工作以对苯二胺和氟硼二吡咯(BODIPY)为模型单体,与含醛的碳点反应,构建得到了2种纳米级COFs,分别命名为CCOF-1和CCOF-2,如图4(b)所示.经聚乙二醇(PEG)修饰后,生成了更好稳定性和分散性的CCOF-1@PEG和CCOF-2@PEG.实验结果表明,CCOF-2@PEG具有更好的生理稳定性和生物相容性,以及具有强大的活性氧产生能力,有潜力成为一种优良的光动力治疗剂.
2.2.3 PTT
PTT是PDT之外另一种得到广泛应用的非侵入性肿瘤治疗方法.该方法利用近红外(NIR)激光触发光热转导剂(PTAs),能量转移产生的热量会引起肿瘤部位的温度升高,从而选择性地杀死肿瘤细胞.与手术和化疗等传统方法相比,PTT具有微创和高效的特点,适用于安全有效的肿瘤消除.纳米级的COFs可以作为PTAs的载体,实现其在肿瘤部位的有效富集和可控释放.例如,WANG等[29]首次采用无模板溶液陈化法,将对苯二胺(Pa)、Tp和乙酸在室温下混合,制备得到了均匀微米级的多层TpPa-COF,如图4(c)所示,经过三价铁离子(Fe3+)对均匀微米级分层COF(HCOF)进行合成后金属化,使其具备了光热剂(PTA)的性质.在激光照射下,合成的Fe-HCOF具有良好的光热效应和体内抗肿瘤效果(效果达到87.8%),该工作通过合成后修饰使COFs功能化成为可能.
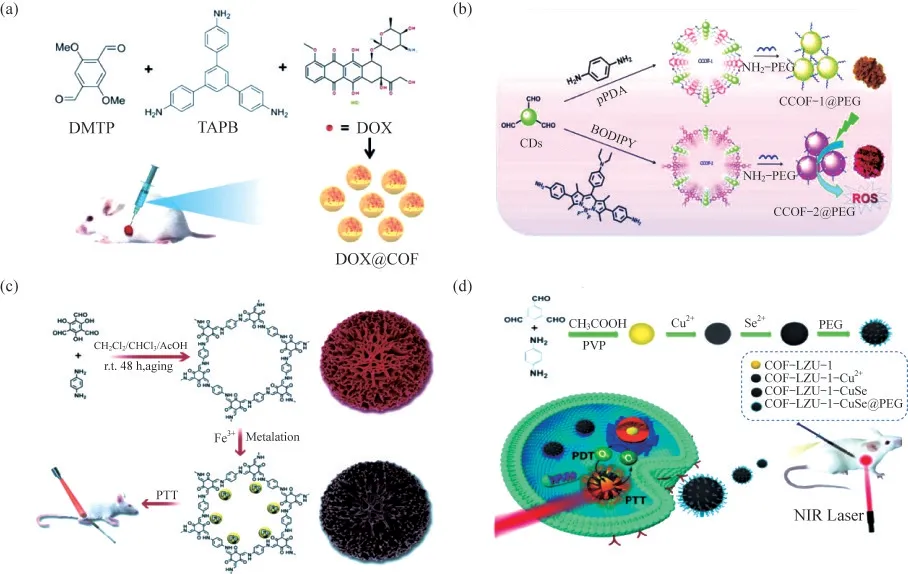
图4 COFs在肿瘤治疗中的应用.
2.2.4 协同治疗
由于肿瘤的异质性和复杂性,单一疗法往往效果有限,很难实现对肿瘤组织的根除,而协同治疗可以克服单一疗法的缺点,进一步提高肿瘤治疗的效果.COFs独特的理化性质决定其很适合作为一个多功能的纳米平台,实现多种疗法的组合和协同作用.例如,HU等[30]制备了一种基于COFs的多功能纳米治疗剂,将PDT与PTT这2种疗法进行协同治疗.在室温下采用溶液相合成法制备了高度单分散的COF,所合成的COFs纳米粒子在650 nm和808 nm激光照射下表现出良好的光动力效应.将原位形成的铯化铜(CuSe)纳米粒子与COFs偶联,构建了COF-CuSe治疗平台,如图4(d)所示.该纳米复合材料具有较高的光热转换效率和增强的光动力学效应,体外和体内实验均证明了COF-CuSe通过协同光热效应和光动力效应,具有显著的抗肿瘤效果.在另一项工作中,GUAN等[31]报道了一种基于纳米COFs的纳米复合试剂.该复合物表面修饰了作为PSs的BODIPY-2I,并包埋了碳酸钙(CaCO3)纳米粒子,最后在表面修饰了能够靶向肿瘤细胞表面CD44受体的糖胺聚糖(Gag),命名为CaCO3@COF-BODIPY-2I@Gag.该纳米复合物能够特异性靶向肿瘤细胞,光触发产生的1O2不仅能够直接杀死肿瘤细胞,还导致了线粒体功能障碍,失去钙调节功能,而线粒体的钙缓冲能力是细胞内钙离子的重要调节机制,破坏该功能很容易产生钙超载.这样,即使在较温和的PDT条件下,PDT与1O2触发的钙超载协同治疗,也可以获得有效的抗肿瘤治疗效果.
3 结论与展望
总结和比较了目前较为常见的几种COFs合成方法,重点介绍了COFs在生物传感和肿瘤治疗等生物医学领域的研究进展.现有的研究结果已经充分证明了COFs在生物学应用中的适用性和无限潜力.然而,作为一类新型材料,COFs进一步的生物学应用仍然面临许多挑战.例如,要将COFs用作生物制剂,其长期生物毒性和代谢结果还需进行系统分析和评估;细胞摄取对材料的大小有要求,材料形貌越均匀,尺度越小,则越易被摄取,现有的合成方法还难以实现大规模制备形貌和尺度均一性良好的COFs材料,因此还需要优化纳米COFs的合成方法.此外,目前COFs作为纳米载体主要用于小分子药物和PSs等的载带,而COFs在核酸、蛋白等生物活性分子的递送方面还有很大的拓展空间.在成功解决这些基本问题后,COFs作为一种纳米材料平台,在生物医学方面的运用将会越来越广泛.
